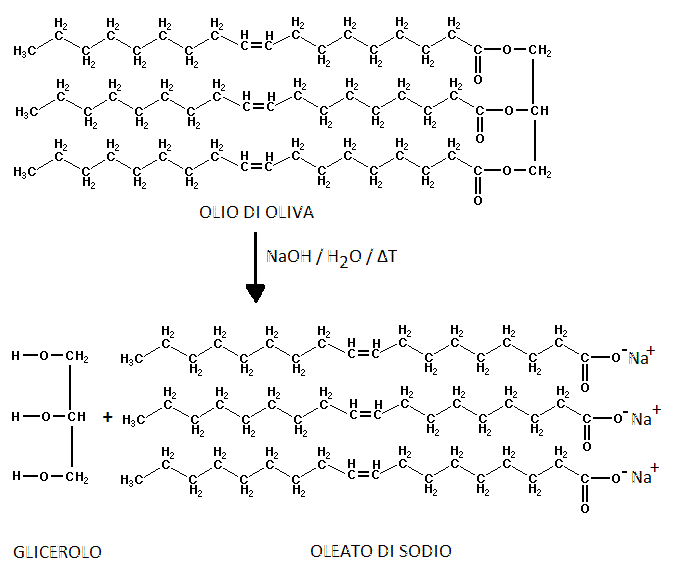
Reazione di Saponificazione
OBIETTIVO: Realizzare un sapone sodico tramite reazione di saponificazione di acidi carbossilici facendo reagire un trigliceride con idrossido di sodio (NaOH).
STRUMENTI: Bilancia tecnica, piastra riscaldante.
VETRERIA: Matraccio da 50 mL, spatola d’acciaio, becker da 100 mL, bacchetta di vetro, imbuto di vetro, pallone di vetro da 500 mL, palline termoregolatrici, becker da 2000 mL, cilindri graduati da 50 e 100 mL, carta filtro, beute da 100 mL, contenitore in plastica.
SOSTANZE: NaOH in palline, Acqua distillata in spruzzetta, olio di oliva, olio essenziale profumato.
DPI: Camice, guanti isolanti.
RISCHI: Scottatura, inalazione di sostanze formate durante le reazioni nell’ebollizione.
REAZIONE:
CONOSCENZE TEORICHE:
La saponificazione è una reazione che consiste nell’idrolisi basica degli esteri. Fra i grassi naturali hanno notevole importanza gli oli, gli esteri della glicerina, i lipidi e gli acidi carbossilici a catena lunga.
La saponificazione è una reazione di sostituzione nucleofila acidica, irreversibile, che porta alla consumazione di una mole di NaOH per una mole di estere.
PROCEDIMENTO:
- PREPARAZIONE DELLA SOLUZIONE DA 50 mL DI NaOH AL 20%:
- Calcolare, tramite le giuste proporzioni, i grammi di NaOH da pesare;
- Prelevare i grammi di NaOH in palline pesandoli tramite la bilancia tecnica e porli in un becher da 100 mL;
- Aggiungere una piccola quantità di H2O distillata in modo da far sciogliere tutte le palline aiutandosi con una bacchettina di vetro;
- Versare la soluzione in un matraccio da 50 mL tramite un imbuto. Recuperare i residui di soluzione presenti nel becher, sulla bacchetta e nell’imbuto lavandoli con H2O distillata e in seguito portare a volume il matraccio per ottenere la soluzione a titolo noto;
- Chiudere il matraccio con il tappo e agitare in modo da ottenere una soluzione omogenea.
- REAZIONE DI SAPONIFICAZIONE:
- Prelevare 50 mL di olio di oliva utilizzando un cilindro graduato da 50 mL e 100 mL di H2O distillata tramite cilindro da 100 mL;
- Versare in un pallone di vetro da 500 mL tutta la soluzione di NaOH presente nel matraccio, i 50 mL di olio di oliva ed i 100 mL di H2O distillata;
- Aggiungere nel pallone delle palline termoregolatrici dell’ebollizione;
- Preparare il bagno-maria inserendo dell’acqua di rubinetto in un becker da 2000 mL e ponendolo su una piastra riscaldante elettrica;
- Immergere 1/3 del pallone nel becker da 2000 mL sostenendolo con un supporto di ferro;
- Proseguire la reazione con un riscaldamento lento e cauto sotto agitazione continua della soluzione tramite bacchettina di vetro;
- Portare ad ebollizione l’acqua e procedere per un ora e mezza, fino a quando non si nota più la separazione delle fasi.
- FILTRAZIONE:
- Utilizzando dei guanti isolanti si rimuove il pallone dal bagno-maria scollegandolo dal sostegno, iniziando a far raffreddare la soluzione al suo interno;
- Nel frattempo si prepara la carta filtro da porre nell’imbuto che andrà posizionato sulla beuta;
- Versare delicatamente la soluzione del pallone nell’imbuto contenente la carta filtro facendo attenzione a non far cadere le palline termoregolatrici;
- Dopo aver filtrato, porre la sostanza presente sul filtro (il sapone) in un contenitore in cui avverrà il raffreddamento e la solidificazione del sapone;
Proprietà detergenti dei saponi
OBIETTIVO: Verificare il potere detergente confrontando i saponi industriali con il sapone tradizionale.
VETRERIA: Provette con porta provette, bacchetta di vetro, becker, cilindro graduato da 25 mL, spatola d’acciaio, pipetta monouso.
SOSTANZE: olio di oliva, spruzzetta con H2O distillata, Sapone tradizionale, detersivo per piatti (sapone industriale).
DPI: Camice.
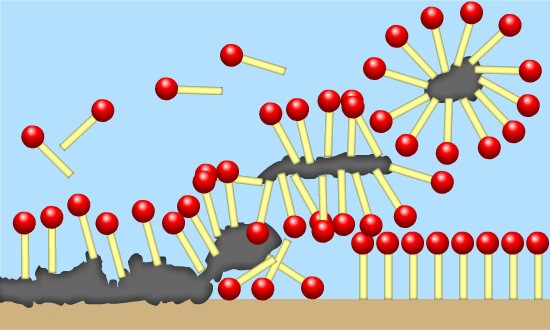
CONOSCENZE TEORICHE:
Lo sporco è costituito da grasso: polvere mista ad olio. Esso in acqua viene inglobato dal sapone con la sua parte lipofila che lo allontana dalla superficie sporca.
Il sapone può esercitare la sua azione detergente in acqua dolce con basso contenuto di sodio e magnesio, questo per evitare la formazione di sali insolubili.
Ci sono tre tipi di saponi: anionici, cationici e non ionici.
I detergenti devono contenere lunghe catene idrocarburiche. L’industria per produrre saponi si avvale di alcoli grassi primari più economici del petrolio che veniva utilizzato in precedenza
PROCEDIMENTO:
- Si predispongono 3 provette numerandole, la prima provetta sarà di controllo, la seconda sarà utilizzata per contenere il sapone tradizionale e la terza conterrà il detersivo per piatti;
- Si prelevano 5 mL di H2O distillata, utilizzando un cilindro graduato, e li si versano in ognuna delle provette;
- In ciascuna provetta si aggiungono 5-10 gocce d’olio, prelevate con una pipetta monouso, per simulare la presenza di grasso e sporco;
- Si preleva, con una spatola di acciaio, una piccola aliquota di sapone tradizionale e la si pone nella seconda provetta;
- Nella terza provetta si inserisce una piccola quantità di detersivo per piatti;
- Si agitano le tre provette in modo da favorire le reazioni (N.B. nella prima provetta deve rimanere la separazione delle fasi, dovuta all’assenza del sapone);
OSSERVAZIONI: Con l’inserimento dei saponi e l’agitazione delle provette si ha un emulsione dei grassi. Questa emulsione è molto più evidente nel detersivo per piatti grazie al suo potere detergente maggiore rispetto a quello del sapone sintetizzato tradizionalmente.
Misurazione del pH dei saponi
OBIETTIVO: Verificare l’acidità, neutralità o basicità dei vari saponi.
VETRERIA: Cartina tornasole, becher, bacchette di vetro, spatole d’acciao.
SOSTANZE: Saponi tradizionali, detersivo per piatti, sapone per le mani liquido.
DPI: Camice.
CONOSCENZE TEORICHE:
Il pH indica la concentrazione di ioni H+ presenti in una sostanza, cioè ne misura l’acidità. Si può determinare il pH di un sapone solo disciogliendolo in acqua. Il pH, però, varia anche dalla quantità di acqua utilizzata. Abbiamo diversi tipi di saponi:
I saponi tradizionali, hanno un pH neutro intorno al 7.
I saponi prodotti in casa che hanno un pH che varia da 8,5 a 10. Questi favoriscono la conservazione in quanto i batteri non proliferano a pH basici.
I detergenti con pH 5,5. Questi sono liquidi e favoriscono la proliferazione. Per essere utilizzati senza problemi devono contenere sostanze antibatteriche.
PROCEDIMENTO:
- Si preparano 5 becher numerandoli e riempiendoli per metà con acqua di rubinetto possibilmente tiepida;
- Nei primi 3 becher si inseriscono i tre saponi tradizionali preparati diversamente, nel 4 becher si inserisce il sapone per le mani, nell’ultimo si aggiunge il detersivo per piatti;
- Si favorisce lo scioglimento dei saponi nell’acqua tramite l’agitazione con la bacchettina di vetro;
- Si misura il pH di ogni soluzione tramite la cartina tornasole;
OSSERVAZIONI: il pH dovrebbe essere neutro in tutte le soluzioni per non irritare e danneggiare la pelle. I saponi tradizionali segnalano un pH 8, 10, 14. La basicità è dovuta alla presenza dei residui alcalini. Per ovviare a questo problema occorre lavare il sapone.
Effetto della durezza dell’acqua
OBIETTIVO: Verificare l’influenza della durezza dell’acqua sul potere detergente dei saponi.
VETRERIA: Provette con porta provette, becker, spatola di acciaio, bacchetta di vetro, pipetta tarata da 2 mL, pipetta tarata da 5 mL, propipetta.
SOSTANZE: Cloruro di Calcio [1%], H2O di rubinetto, sapone tradizionale, detersivo per piatti, sapone per mani, detersivo in polvere per bucato.
DPI: Camice
CONOSCENZE TEORICHE:
Il termine durezza è legato al fatto che le acque rendono difficoltoso l’utilizzo del sapone in quanto tendono a precipitare sotto forma di Sali di calcio e magnesio. Solo dopo questa precipitazione si ottiene il ripristino del potere detergente (se si forma il precipitato bisogna aggiungere più sapone per ripristinare il potere detergente, quindi si vede la qualità del sapone. Questo accade soprattutto con i saponi tradizionali).
I detersivi di sintesi non formano precipitati con l’acqua in quanto le industrie usano additivi e saponi con catene idrocarburiche più lunghe.
PROCEDIMENTO:
- Numerare 4 provette e 4 becher;
- Inserire in ciascun becher dell’acqua di rubinetto;
- Aggiungere nel primo becher il sapone tradizionale, nel secondo il detersivo per piatti, nel terzo il detersivo per mani, nel quarto il sapone in polvere e agitare ciascuna soluzione per omogeneizzarle;
- Prelevare 5 mL delle soluzioni saponose preparate precedentemente e versarle nella corrispondente provetta utilizzando la pipetta tarata da 5 mL;
- Aggiungere 2 mL di Cloruro di Calcio nella provetta prelevandoli con una pipetta tarata 2 mL;
- Agitare le provette per favorire le reazioni.
OSSERVAZIONI: La durezza dell’acqua è determinata dalla presenza di [Cl–] disciolti in essa. La presenza di cloruri può influenzare il potere detergente dei saponi in quanto comporta la formazione di Sali poco solubili in acqua che precipitano.
Nei saponi tradizionali ed in quello in polvere, la reazione con il cloruro di calcio comporta la formazione di precipitati che influiscono sul potere detergente. Quindi per aumentare il potere detergente occorre aumentare le dosi di detersivo o sapone.
Nei saponi industriali, non avviene la formazione di precipitato in quanto, essendo stati prodotti industrialmente, sono stati aggiunti prodotti per adattare il sapone a qualsiasi tipo d’acqua.