Alla fine del XIX secolo, gli scienziati erano convinti che la materia fosse costituita di atomi, ma non avevano idea di come fossero fatti. Essi pensavano, inoltre, che l’atomo fosse la più piccola particella costitutiva della materia e che non la si potesse scindere in altre particelle più piccole. Oggi sappiamo invece che gli atomi sono formati da particelle subatomiche: protoni, neutroni ed elettroni.
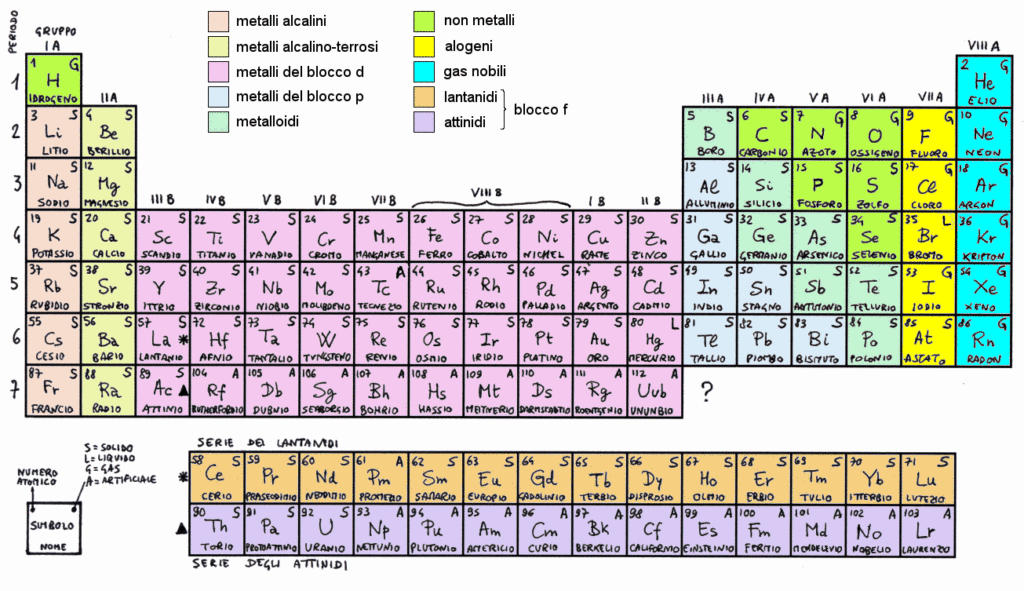
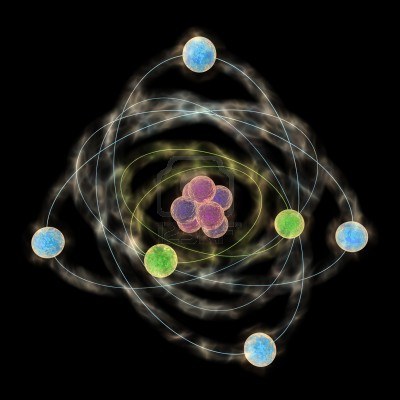
Nel 1911, il chimico inglese Ernest Rutherford descrisse la struttura dell’atomo con un modello in cui l’atomo è per lo più spazio vuoto, e la maggior parte della sua massa è concentrata in un nucleo centrale, attorno al quale ruotano gli elettroni, particelle con carica elettrica negativa. Il nucleo, a sua volta, è formato da protoni, particelle con carica elettrica positiva, e da neutroni, particelle elettricamente neutre. Allo stato naturale ogni atomo è elettricamente neutro, perché il numero degli elettroni è uguale al numero dei protoni e quindi le loro cariche si bilanciano.
Questo modello atomico è noto come modello planetario, perché ricorda un minuscolo Sistema solare con il Sole al centro e i pianeti degli ruotano attorno. Ma se tutti gli atomi sono formati dalle stesse particelle subatomiche, come mai in natura esistono circa 90 elementi chimici diversi?
Ciò che rende diverso un elemento da ogni altro è il numero dei protoni presenti nel suo nucleo: il numero dei protoni (e di conseguenza quello degli elettroni) è detto numero atomico. Per esempio, ogni atomo di idrogeno, H, ha un solo protone nel nucleo: il suo numero atomico è 1. Un atomo di Elio, He, ha due protoni nel nucleo e uno di carbonio, C, ne ha sei. Nella tavola periodica, gli elementi sono disposti secondo il loro numero atomico crescente.
Nel nucleo, come sappiamo, sono presenti anche i neutroni: la somma del numero dei neutroni e dei protoni, cioè di tutte le particelle che costituiscono il nucleo di un atomo, si chiama numero di massa.
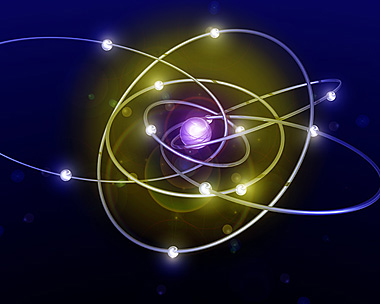
Il modello planetario dell’atomo fu in seguito sostituito da un nuovo modello, chiamato modello quantomeccanico. Secondo il nuovo modello, gli elettroni non ruotano attorno al nucleo su orbite definite come quelle percorse dei pianeti attorno al Sole; il loro comportamento è descritto invece da orbitali. Un orbitale è una regione di spazio intorno al nucleo, simile a una nube, all’interno della quale esiste una certa probabilità di trovare un elettrone. Gli orbitali sono raggruppati in strati, o livelli energetici, che possiamo immaginare come una serie di gusci concentrici, con un contenuto di energia crescente via via che ci si allontana dal nucleo.
In tutti gli atomi gli elettroni riempiono gli orbitali partendo da quelli più interni, dotati di minor energia. Il livello energetico più esterno è quello che determina le proprietà chimiche di un elemento, cioè il suo comportamento durante le reazioni. Per esempio, gli atomi con il livello più esterno completamente riempito di elettroni sono molto stabili, cioè reagiscono raramente con altri atomi. Al contrario, gli atomi con il livello esterno incompleto reagiscono facilmente con altri atomi, per poterlo completare.
Nella tavola periodica, tutti gli elementi di uno stesso gruppo (cioè della stessa colonna verticale) hanno lo stesso numero di elettroni nel livello più esterno e mostrano proprietà chimiche simili.