ESERCITAZIONE: Metodi di separazione, la distillazione
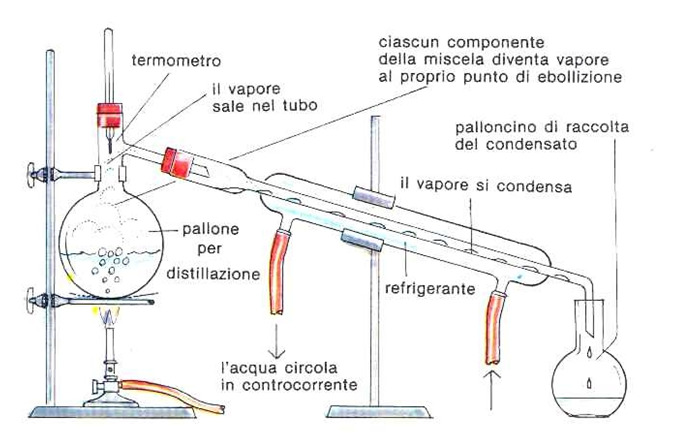
OGGETTO: confronto tra due metodi di separazione, distillazione frazionata e semplice, lavorando con una stessa miscela (alcool e acqua distillata).
STRUMENTI, APPARECCHI E SOSTANZE
Strumenti:
- 2 MATRACCI;
- RISCALDATORE ELETTRICO ;
- TUBI DI PLASTICA PER RACCORDARE;
- RISCALDATORE ELETTRICO;
- IMBUTO;
- PIETRA POMICE;
- TERMOMETRO;
- CILINDRO GRADUATO DI VETRO;
- CILINDRO GRADUATO DI PLASTICA;
- COLONNA DI VIGREUX ;
- PALLONE DI DISTILLAZIONE;
- TUBI REFRIGERANTI IN VETRO;
- SPRUZZETTE ;
- FORNETTO ELETTRICO.
Soluzione:
- ACQUA DISTILLATA
- ALCOOL ETILICO DENATURATO: composto formato dal 90% alcool, 10% acqua;
- MISCELA BINARIA: formata da 50 ml da acqua distillata e 50 ml da alcool etilico denaturato.
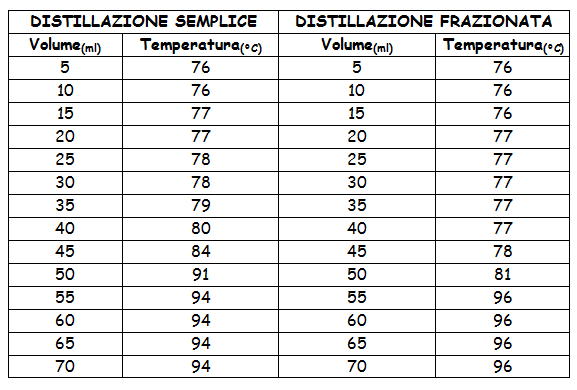
TABELLA:
CONOSCENZE TEORICHE
Distillazione: per separare i componenti di un miscuglio ci sono varie possibilità: la distillazione semplice, la distillazione frazionata.
La DISTILLAZIONE SEMPLICE è una tecnica che si può effettuare con un apparecchio formato da due contenitore collegati da un tubo. In pratica la separazione di due elementi, ad esempio acqua e sale, avviene in modo molto semplice: si fa evaporare l’acqua, riuscendo così a separarli e poi far condensare l’acqua (farla tornare liquida) per creare la cosìdetta acqua distillata. questo processo ovviamente è possibile eseguirlo con qualsiasi coppia di sostanze, sfruttando le loro proprietà, come ad esempio, farne evaporare una o farla solidificare. In alcuni casi, però la distillazione non è sufficiente e uno dei due composti rimane ancora un miscuglio, e in questo caso la sostanza prende il nome di arricchita.
La DISTILLAZIONE FRAZIONATA è una particolare distillazione in cui vengono separate più di due sostanze. Come nel caso della distillazione binaria, i componenti della miscela di partenza sono separati in base alla loro differente volatilità (o temperatura di ebollizione): infatti nella parte più alta della colonna di distillazione (detta “testa”) si ha una maggiore concentrazione delle sostanze più volatili, mentre nella parte più bassa (detta “coda”) si ha una maggiore concentrazione delle sostanze meno volatili. La colonna di distillazione utilizzata per tale tipo di distillazione è detta colonna di frazionamento. La distillazione frazionata si basa su una lunga serie di cicli di vaporizzazione-condensazione, che avvengono nell’apparecchiatura. Il profilo di temperatura nella colonna è caratterizzato da valori di temperatura più elevati vicino al ribollitore (dove bolle la miscela) e più bassi vicino al condensatore. L’apparecchiatura utilizzata è la stessa della distillazione semplice, ma con l’aggiunta di una colonna di rettifica che viene inserita tra il pallone di distillazione e il tubo refrigerante (condensatore).
Le colonne di rettifica possono essere di due tipi:
- la colonna Vigreux che è costituita da un semplice tubo di vetro che presenta una serie di sporgenze interne che hanno la funzione di aumentare la superficie di contatto con i vapori.
- la colonna a riempimento che è un tubo di vetro liscio riempito interamente di palline di vetro che hanno la funzione di aumentare la superficie di contatto tra il vapore ascendente e il liquido di riflusso.
Se la soluzione da distillare è costituita da due componenti, il vapore che si forma durante il riscaldamento li contiene entrambi, dato che entrambi sono volatili; è per questo che i vapori vengono fatti passare attraverso la colonna di rettifica. All’interno di essa, i vapori salendo si raffreddano e subiscono continue condensazioni ed evaporazioni, che portano alla formazione di un vapore sempre più ricco del componente più volatile, cioè del componente che ha temperatura di ebollizione più bassa; il liquido che condensa è invece più ricco del componente meno volatile.In altre parole i vapori che salgono verso l’alto incontrano le palline di vetro e si raffreddano. Il componente meno volatile si condensa, cade verso il basso e incontra i nuovi vapori in risalita. Questi, raffreddandosi, cedono al liquido il componente meno volatile. Alla sommità della colonna arrivano solo i vapori del componente più volatile. Questi vapori vengono successivamente condensati nel tubo refrigerante (condensatore) e convogliati nel recipiente di raccolta.Se la colonna è sufficientemente lunga, i vapori che arrivano in cima ad essa sono formati dal solo componente più volatile e il termometro ne misura la temperatura di ebollizione. Fin quando la temperatura rimane costante, sta distillando solo quel componente; e quando comincia ad aumentare, vuol dire che la sua distillazione è terminata. A questo punto si può interrompere il processo, dato che la separazione dei due componenti della soluzione iniziale si è realizzata.
Miscela ideale: In chimica una soluzione ideale o una miscela ideale è una soluzione in cui l’entalpia di soluzione (o entalpia di miscelamento) è pari a zero;più l’entalpia della soluzione si approssima allo zero, più la soluzione si approssima al comportamento ideale.In una soluzione ideale i coefficienti di attività (i quali misurano la deviazione dall’idealità) sono uguali ad uno.Il concetto di soluzione ideale è fondamentale nella termodinamica chimica e nella determinazione delle proprietà colligative.
Evaporazione: L’evaporazione è il passaggio allo stato di vapore delle particelle che costituiscono un liquido. I liquidi evaporano in misura maggiore o minore a seconda delle entità delle forze che mantengono unite nel liquido le particelle che lo costituiscono (forze intermolecolari).
Tensione di vapore: Quando un solvente puro è introdotto in un recipiente chiuso ad una data temperatura, all’interno del recipiente si crea un equilibrio dinamico a seguito del quale il numero di molecole che nell’unità di tempo si allontanano dalla superficie del liquido (N1) è uguale al numero di molecole che dal vapore rientrano nel liquido (N2). La pressione che il vapore esercita sulle pareti del recipiente quando si trova in equilibrio dinamico con il liquido ad una data temperatura è chiamata tensione di vapore.
DESCRIZIONE DELLA PROVA:
L’esercitazione della prova consisteva nei due diversi metodi di distillazione, ovvero la distillazione frazionata e distillazione semplice, per avere appunto un confronto fra i due metodi avendo una stessa miscela. Tali distillazioni possono essere eseguite se lavoriamo con miscele formate da solventi con componenti totalmente miscibili, ma con diversa temperatura di ebollizione e di conseguenza con diversa volatilità. La miscela usata era un composto binario formato da alcool etilico denaturato e acqua distillata. La soluzione è stata realizzata ponendo in un cilindro graduato, con l’aiuto di un imbuto, 50 ml di alcool etilico e 50 ml di acqua distillata. Dopodiché prendiamo un riscaldatore elettrico, contente due matracci, in cui viene versata la sostanza con pietra pomice (materiale inerte) , che serve come regolatore di ebollizione. Le due distillazioni le effettuiamo a temperatura atmosferica. Nel caso della distillazione semplice, colleghiamo un tubo a T collegato a suo volta ad un termometro per il rilevamento della temperatura dei vapori. Il tubo a T è collegato ad un tubo refrigerante che possiede un ingresso posta verso il basso ed un’uscita posta verso l’alto; nel tubo refrigerante passa dell’acqua fredda in controcorrente a circa 15 °C e la sostanza evaporata. Queste sostanze però sono separate tra di loro e non hanno un contatto. L’acqua però, che si trova nel tubo refrigerante, interagendo con i vapori, si riscalda e di conseguenza si raffreddano i vapori stessi, avendo così il passaggio dallo stato gassoso a liquido, che non è altro che il distillato che viene raccolto da un contenitore. Ed è su questo principio che si basa la distillazione. Nel caso della distillazione frazionata, colleghiamo un matraccio ad una colonna denominata Vigreux, che di conseguenza è collegata ad un termometro per visualizzare e misurare la temperatura dei vapori; questa, è collegata ad un tubo refrigerante composto da una serpentina e da acqua dove avviene appunto il passaggio dei vapori a liquido. Dopo questo passaggio si ottiene il distillato che viene raccolto in un contenitore.
Una volta ottenuto ciò passiamo al riscaldatore elettrico in cui le miscele cominciano a riscaldarsi. Per ogni intervallo di 5 ml di distillato registriamo la temperatura. Con i dati ottenuti possiamo ricavare il grafico, per notare le differenze fra i due metodi. Possiamo notare che inizialmente la miscela è colorata, il distillato ottenuto però è incolore.




