ESERCITAZIONE: Analisi Volumetrica
OGGETTO:
- Preparazione e standardizzazione delle soluzioni per argentometria;
- Determinazione della concentrazione dei cloruri nell’acqua.
SCHEMA:

FORMULE:
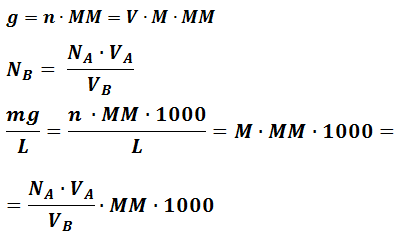
LEGENDA:
g: grammi;
mg: milligrammi;
MM: Massa Molecolare;
N: Normalità;
V: Volume (in Litri);
n: Moli;
M: Molarità;
V0: Volume determinazione in bianco.
REAZIONI DI PRECIPITAZIONE:
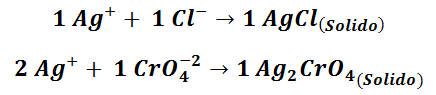
STRUMENTI, APPARECCHI E SOSTANZE:
- Spruzzetta con acqua distillata;
- Spatola d’acciaio;
- Bilancia Tecnica e Bilancia Analitica;
- Matraccio tarato (200 ml e da 100 ml);
- Vetrino d’orologio;
- Beuta (200 ml e da 100 ml);
- Buretta graduata (50 ml) con sostegno e relativo imbuto;
- Cilindro graduato;
- Becherino (100 ml);
- Contenitore scuro;
- Pipetta tarata (20 ml) con propipetta;
- Stufa elettrica;
- Essiccatore a pressione atmosferica;
- Nitrato di Argento (Reattivo Titolante);
- Cloruro di Sodio (Soluzione Standardizzante);
- Cromato di Potassio (Indicatore);
- Acqua Piovana e di Rubinetto.
CALCOLI E RISULTATI:

RELAZIONE:
CONOSCENZE TEORICHE:
La titolazione o Analisi Volumetrica è una tecnica analitica che consiste nel far reagire una soluzione a titolo noto di un reagente (titolante) con un volume noto di una soluzione contenente l’analita (titolando). Conoscendo il volume di titolante utilizzato e la stechiometria di reazione si può risalire alla concentrazione dell’analita con semplici calcoli. Esistono diversi tipi di titolazione: titolazioni redox, titolazioni di precipitazione, titolazioni acido-base, titolazioni complessometriche…
Nella titolazione di precipitazione gli analiti vengono determinati per via volumetrica basandosi su reazioni analitiche che portano alla formazione di composti poco solubili che precipitano quasi del tutto, come nel caso del Cloruro di argento che ha Kps di 1.77 ∙ 10–10.
Le applicazioni più importanti riguardano quindi la formazione di sali insolubili dello ione Ag+, che forma precipitati aventi le dovute caratteristiche con alcuni anioni come gli alogenuri.
Questo campo dell’analisi volumetrica che usa come reattivo l’argento, prende il nome di argentometria e può essere utilizzato sia per il dosaggio dello ione Ag+ che per quello degli anioni, che con esso formano sali insolubili. Come per tutte le titolazioni, la reazione analitica deve soddisfare alcuni requisiti essenziali: dev’essere rapida e completa, seguire una stechiometria ben definita, non ci devono essere molte interferenze con altre specie chimiche e consentire l’individuazione del punto di fine in maniera agevole e adeguatamente vicina al punto di equivalenza della reazione. A volte, per garantire la completezza della precipitazione, si può intervenire sulla composizione del solvente. L’individuazione del punto di fine, connessa alla natura dell’analita e dell’agente precipitante, si ottiene di norma con l’impiego di opportuni indicatori che provocano un cambiamento di colore della soluzione o la formazione di un precipitato colorato in corrispondenza del punto di equivalenza.
I principali metodi argento metrici prendono il nome dei ricercatori che li hanno messi in punto, e sono: metodo di Mohr, metodo di Volhard e metodo di Fajans.
Il metodo di Mohr viene utilizzato specialmente nella titolazione dei cloruri e dei bromuri in soluzioni neutre. Esso sfrutta come indicatore lo ione cromato (CrO4– 2), che forma con lo ione argento un composto poco solubile, Ag2CrO4, di colore rosso mattone. Il principio è quello della precipitazione frazionata: gli alogenuri d’argento sono meno solubili del cromato e quindi precipitano prima. In corrispondenza del punto di equivalenza, quando la concentrazione di alogenuro è praticamente nulla, comincia a formarsi il cromato di argento, la cui presenza è segnalata dalla colorazione caratteristica.
Un piccolo eccesso di ioni Ag+, necessario per fare avvenire la formazione del cromato di argento e per apprezzare la comparsa della colorazione rossa, costituisce l’errore di titolazione, che spesso rientra nei limiti dell’accuratezza richiesti dall’analisi, ma può essere anche minimizzato conducendo una prova in bianco su una soluzione trattata come il campione, ma priva di ioni cloruro. Nella determinazione secondo Mohr degli alogenuri bisogna controllare che il pH della soluzione si mantenga su valori neutri o leggermente basici. Una acidità elevata interferirebbe con la formazione di Ag2CrO4, perché lo ione cromato in ambiente acido tende a trasformarsi in HCrO4–, formando una reazione di equilibrio. Anche un pH elevato è da evitare perché in ambiente basico lo ione Ag+ forma un idrossido insolubile di colore nero.
DESCRIZIONE DELLA PROVA:
Per eseguire le operazione dell’argentometria bisogna preparare in primo luogo le soluzioni.
La prima soluzione da preparare è il nitrato di argento (AgNO3). Il nitrato di argento però non è una soluzione madre, inoltre è facilmente soggetto ad alterazioni perché l’argento è fotosensibile e quindi per poter determinare la concentrazione esatta di questa soluzione bisogna eseguire una standardizzazione e quindi una titolazione, facendolo reagire con il Cloruro di Sodio (NaCl) che è la nostra soluzione standardizzante.
La soluzione di nitrato da preparare è di 200 ml circa 0,1 N. Siccome la concentrazione del permanganato è approssimata, per prelevare la sostanza si utilizza la bilancia tecnica. Essendo l’argento monovalente, la normalità è uguale alla molarità e quindi seguendo le formule, i grammi da prelevare sono 3,40 (come si può vedere dai calcoli). Adesso si prelevano le quantità di sostanza calcolate nel vetrino utilizzando la spatola e dopo il prelievo la si versa nel matraccio aiutandosi con un imbuto (facendo molto attenzione perché il nitrato di argento lascia macchie indelebili ed il costo dell’argento è molto elevato quindi non si accettano errori). Con dell’acqua distillata si cerca di raccogliere tutti i granelli rimasti nel vetrino e nell’imbuto fino a riempire un terzo del matraccio, ora si procede nell’agitare in modo da portare a soluzione tutta la sostanza. Dopo aver far sciolto tutto il permanganato si porta a volume della taratura. Per questo procedimento ci si può aiutare anche utilizzando una pipetta monouso (anche se in questo caso l’errore è poco rilevante visto che non è una soluzione a titolo noto). Poi si agita coprendo con della carta parafilm l’imboccatura. Terminata l’agitazione si versa il tutto in un contenitore condiviso per gruppi frontali scuro, in modo da evitare le radiazioni solari.
La soluzione di cloruro di sodio da preparare è di 100 ml 0,1 M. Attraverso la stessa formula usata in precedenza per il nitrato, si calcolano i grammi di NaCl da prelevare(si può vedere il procedimento nei calcoli), nel nostro caso 0,5844 g. Prima della pesata, la sostanza va però messa in stufa per un paio d’ore a 130 °C e poi a raffreddare e conservare in essiccatore per rimuovere eventuali impurezze provocate dall’umidità. La pesata questa volta va eseguita con la bilancia analitica perché essendo una sostanza madre bisogna essere molto precisi. Una volta pesata, la sostanza va messa nel matraccio aiutandosi con un imbuto, con una spruzzetta con acqua distillata si cerca di recuperare tutti i cristalli rimasti sul vetrino e sull’imbuto e si riempie fino ad un terzo il matraccio. Adesso si agita la soluzione per far disciogliere tutto il soluto. Appena tutto il soluto si è disciolto, si porta a volume fino al segno di taratura (aiutandosi anche questa volta con una pipetta monouso). Adesso la soluzione di cloruro di sodio si travasa in una beuta per poter essere conservata per la standardizzazione.

Per poter individuare il punto equivalente si utilizza come indicatore una soluzione di cromato di potassio (K2CrO4). La soluzione da preparare è di 100 ml di con una concentrazione del 20 % quindi i grammi da prelevare sono 20. La pesata viene effettuata con la bilancia tecnica, poi si versa il tutto in un matraccio da 100 ml e si inserisce l’acqua facendo prima sciogliere tutto il sale.
Come già detto la standardizzazione viene eseguita utilizzando un’opportuna reazione chimica di precipitazione.
Prima di iniziare la standardizzazione si preleva il nitrato di argento in un becherino, si avvina e si azzera la buretta con il nitrato di argento. Si pongono 20 ml di cloruro di sodio (usando una pipetta tarata con la relativa propipetta) e 50 ml di acqua distillata (usando un cilindro graduato di plastica) in una beuta, si aggiungono 3 – 4 gocce di Cromato di Potassio che ci indicherà il punto di equivalenza. La soluzione iniziale è di colore giallo. Ora si procede con la standardizzazione facendo scendere goccia dopo goccia il nitrato d’argento. Mentre si aggiunge il nitrato di argento, bisogna agitare la beuta. Già con poche gocce la soluzione inizia ad intorbidirsi (Figura 1).

Quando la soluzione diventa di colore rosso vuol dire che si è raggiunto il punto equivalente e tutto il cloruro è precipitato diventando cloruro di argento (come si può anche vedere dalla Figura 2). Un millesimo di goccia in più ci farà superare questo punto facendo precipitare anche il cromato di argento, il quale da il colore rosso alla soluzione. Questa operazione va ripetuta per 3 volte. Lo scarto dei volumi non deve superare i 0,2 ml. Essendo a conoscenza della concentrazione esatta del cloruro di sodio e del volume di nitrato di argento utilizzato, si può risalire alla concentrazione esatta di quest’ultimo. Nel nostro caso i millilitri di AgNO3 utilizzati erano 20,2 quindi il titolo preciso del nitrato d’argento è 0,0995 M.
La prova effettiva da fare è la determinazione dei cloruri nell’acqua. La determinazione da noi effettuata è quella con il metodo Mohr, in cui le soluzioni da titolare devono essere a pH neutro o leggermente alcalino per via argentometrica, quindi per determinare la concentrazione dei cloruri nell’acqua piovana o di rubinetto, essa viene titolata con il nitrato di argento di cui già si conosce la concentrazione.
Si preleva con un cilindro graduato 100 ml di acqua piovana o acqua di rubinetto.
Si avvina e azzera di nuovo la buretta con il nitrato. Si inserisce l’acqua in una beuta e si inseriscono 4 – 5 gocce di cromato di potassio. Ora si può procedere con la titolazione. Il colore dell’acqua diventa subito di colore arancio perché la quantità di cloruro è bassa. Infatti nel nostro caso i ml di AgNO3 necessari per la precipitazione dei cloruri è stata di 1,1 nel caso dell’acqua di rubinetto e 0,1 nell’acqua piovana. Non sempre i valori ricavati sono esatti, ci potrebbero essere delle interferenze di specie complessanti o precipitanti l’argento.
Per eliminare interferenze del metodo analitico, si esegue anche una determinazione in bianco utilizzando invece del campione di acqua di rubinetto, un’acqua sicuramente priva di cloruri, in modo da trovare l’errore che il metodo analitico sta commettendo e correggerlo con opportuni trattamenti. Nel nostro caso l’acqua distillata ha impiegato 0,1 ml di AgNO3. Questo volume va sottratto al volume della determinazione dei cloruri nei campioni.
Conoscendo la concentrazione ed il volume di nitrato necessario per far precipitare i cloruri, si può calcolare la concentrazione di questi ultimi nell’acqua prendendo in considerazione anche la determinazione in bianco.
Normalmente l’acqua potabile dovrebbe avere valore di cloruri non superiori dei 250 mg/l. Nel nostro caso l’acqua di rubinetto ne ha mostrati 35,2 mentre l’acqua piovana 0. Questo vuol dire che l’acqua piovana è priva di cloro (o è presente in minima quantità).
Per concludere posso dire che nell’acqua di rubinetto c’è una presenza di cloruri nella norma. Mentre nell’acqua piovana è assente perché in effetti l’acqua piovana dovrebbe essere come un distillato e non avere ioni sciolti al suo interno, se non quelli che acquista nel percorso prima di raggiungere la cisterna.