ESERCITAZIONE: Cromatografia

OGGETTO: Separazione delle sostanze presenti nella buccia d’arancia tramite cromatografia su strato sottile.
STRUMENTI, APPARECCHI e SOSTANZE:
- Mortaio con pestello;
- Bisturi;
- Arancia;
- Lastra sottile in alluminio (TLC);
- Pipetta monouso;
- Becher;
- Becher a collo alto;
- Bilancia tecnica (0,1 g);
- Cilindro graduato di vetro;
- Solfato di Sodio anidro Na2SO4;
- Cicloesano C6H12;
- Diclorometano CH2Cl2;
- Carta stagnola;
- Beuta;
- Piastra elettrica riscaldante;
- Carta da filtro;
- Imbuto di vetro.
RELAZIONE:
CONOSCENZE TEORICHE:
La cromatografia (dal greco khrômatos : “colore” e graphía: “scrivere”, così chiamata perché forma dei disegni colorati di determinate sostanze) è una tecnica analitica per separare specifiche sostanze in una miscela. Essa è una tecnica efficace per separare le componenti di miscele complesse.
Le separazioni si basano su interazioni fisico-chimiche a livello molecolare tra il supporto cromatografico, le sostanze da separare e qualche componente del solvente. Il supporto cromatografico è la fase fissa (o stazionaria) che può essere un solido o un liquido, mentre il solvente è la fase mobile e percola attraverso la fase stazionaria e può essere un liquido o un gas. Le sostanze si distribuiscono fra la fase fissa e la fase mobile in modo diverso, principalmente a seconda della loro struttura e peso molecolare. Alcuni componenti si legano più saldamente alla fase stazionaria, altri di meno: questo comporta che, durante la percolazione della fase mobile, i primi sono più lenti nel loro movimento, i secondi si muovono più velocemente. In questo modo le sostanze di una miscela si separano e possono essere identificate.
Ci sono principalmente tre tipi di cromatografie: di adsorbimento, di ripartizione e di filtrazione su gel.
Nella cromatografia di adsorbimento, i composti da separare sono inizialmente adsorbiti sulla superficie, finemente suddivisa, di un materiale solido. La separazione delle sostanze avviene grazie alla loro diversa affinità per l’adsorbente e la relativa solubilità nell’eluente. La separazione varia in base alla natura della sostanza, all’adsorbente ed il solvente utilizzato.
Nella cromatografia di ripartizione, la fase stazionaria è un liquido supportato su una matrice solida inerte.
Nella cromatografia per filtrazione sul gel, si ha una filtrazione con gel che separa le molecole in base alle loro dimensione. Il gel è quindi la fase stazionaria. In questa tecnica il soluto si distribuisce fra la fase mobile e quella fissa, imbevendo i pori del gel. I componenti della miscela passano attraverso il gel e sono più o meno frenati, a seconda delle rispettive dimensioni.
Le separazioni di cromatografia possono avvenire su una colonna cromatografica o su di una lastra TLC.
La cromatografia su strato sottile o TLC, è una tecnica cromatografica di semplice preparazione; questo la rende particolarmente adatta per l’esecuzione di valutazioni qualitative o semi-quantitative. Come tutte le cromatografie, si basa sulla diversa separazione di diverse sostanze tra una fase stazionaria ed una fase mobile, in funzione dell’affinità di ogni sostanza con esse.
Nella TLC l’eluente si muove dal basso verso l’alto attraverso un strato sottile per capillarità. I composti si muovono con diversa velocità, in base alla diversa affinità della sostanza analizzata, verso un eluente e verso la fase stazionaria. Si ha separazione poiché i composti più affini all’eluente si muovono di più sulla lastra, mentre quelli più affini alla fase stazionaria sono più trattenuti.
La fase stazionaria è generalmente uno strato dallo spessore uniforme di circa 1 mm di materiale adsorbente, depositato su una lastra di vetro o plastica. Lo spessore può essere anche molto inferiore se il supporto è di alluminio.
Il materiale adsorbente può essere gel di silice, allumina, cellulosa in polvere o polvere di diatomee, tutti materiali polari.
La fase mobile è un solvente opportunamente scelto (od una miscela di solventi), capace di separare i componenti della miscela da analizzare e poco affine per polarità alla fase stazionaria scelta. La polarità è fondamentale per la scelta dell’eluente è da essa che dipende l’entità del trascinamento delle sostanze lungo la lastrina in una TLC.
Come scegliere la fase fissa e la fase mobile.
- Le due fasi devono necessariamente interferire tra loro il meno possibile;
- I componenti della miscela da separare devono interagire con le due fasi;
- Il campione deve essere solubile nell’eluente;
- Rf ≤ 0,5; ΔRf ≥ 0,1; il ΔRf (rapporto di frazionamento) tra due componenti della miscela deve essere il più alto possibile.
Il rapporto di frazionamento è il rapporto tra la distanza percorsa dal soluto e la distanza percorsa dal solvente. Questo valore è caratteristico di ogni sostanza e rimane invariato se si utilizzano la stessa fase fissa e mobile. Grazie al rapporto di frazionamento si può quindi condurre anche un’analisi qualitativa per riconoscere la sostanza separata.
Le applicazioni della cromatografia interessano un vasto campo della chimica, dall’inorganica all’organica, sia di sintesi che naturale. In particolare la cromatografia è una tecnica indispensabile nella chimica di sintesi e delle sostanze organiche naturali, per isolare e purificare i componenti di miscele di varia natura, e in campo biologico per purificare polisaccaridi, proteine, acidi nucleici, virus e anche cellule.
DESCRIZIONE DELLA PROVA:

Nel nostro caso si effettua una separazione delle sostanze presenti nella buccia d’arancia tramite cromatografia su strato sottile.
Tutti i vegetali, specialmente foglie e frutta, contengono una varietà di pigmenti colorati. Nelle foglie verdi prevalgono le clorofille. Nelle carote, pomodori, buccia di arancio, di limone, di pompelmo si trovano i carotenoidi licopene, β-carotene, xantofilla. Per poter eseguire una cromatografia di queste sostanze occorre prima fare una estrazione con solvente.
Si prelevano 5 grammi di buccia di arancia (solo la parte più esterna) utilizzando un bisturi e pesando con la bilancia tecnica. Poi si trita la buccia in un mortaio con il pestello. Si eseguono tre estrazioni aggiungendo 20 mL di cicloesano, prelevato con un cilindro graduato. Le sostanze estratte con il cicloesano vengono versate in un becher, dove si aggiunge qualche spatolata di Na2SO4. Il solfato di sodio anidro serve per trattenere ed assorbire l’acqua presente nel miscuglio che si è formato.
Una volta separata l’acqua bisogna anche separare le micro particelle di buccia rimaste nel miscuglio. Per fare ciò si filtra il tutto con della carta da filtro. Adesso per avere la soluzione più concentrata, si fa evaporare parte del solvente con la piastra elettrica riscaldante.
Siccome, questa prova è stata effettuata in giorni diversi, il nostro estratto era completamente solidificato, quindi bisognava riportare in soluzione concentrata inserendo qualche mL di cicloesano. (Tutte le operazioni nella quale si utilizza il cicloesano andrebbero eseguite sotto cappa, nel nostro caso non è stato possibile, quindi si opera vicino ad una finestra).
Adesso che si ha l’estratto concentrato si può passare alla cromatografia. Nel nostro caso la cromatografia è eseguita su uno strato sottile di alluminio diviso in 8 pezzi da 4,5 cm.
Con una matita si traccia la linea di inizio, dove poi si seminerà la sostanza, questa linea va tracciata 1-2 cm sopra il bordo inferiore perché l’estratto seminato non deve essere immerso nel solvente. Si utilizza la matita perché formata da grafite che non reagisce con la fase fissa e la fase mobile. Se si utilizza una penna si avrà una cromatografia anche dell’inchiostro.
Adesso si semina la soluzione concentrata lungo la linea spostandosi 5 mm dai bordi laterali. Durante queste operazioni bisogna stare attenti a toccare il meno possibile con le dita la parte bianca, perché le mani contengono degli amminoacidi, per cui si potrebbe inquinare la prova.
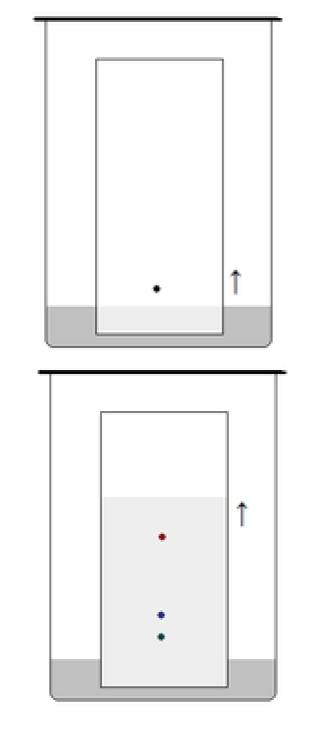
Una volta seminata la lastra la si va ad immergere in una camera di sviluppo, nel nostro caso costituita da un becher a collo alto e una miscela di solventi. Per preparare questa miscela si prelevano 3 mL di Diclorometano e 10 mL di cicloesano attraverso un cilindro graduato. Si versa la miscela nel becher a collo alto, si immerge la lastra inserendola obliquamente e si chiude con della carta stagnola per non far evaporare il solvente.

Pian piano l’eluente migra per capillarità verso l’alto, trasportando e separando le sostanze presenti nell’estratto. Si interrompe la cromatografia prima che il solvente raggiunga la fine della lastra. Quando si decide di interrompere la cromatografia, si segna con una matita il fronte del solvente.
Dall’immagine a fianco si può notare come nel nostro caso si sono separate 4 sostanze. Grazie all’immagine in negativo è più facile rilevare le diverse macchie.
Sicuramente questa cromatografia ha separato anche altre sostanze che purtroppo non sono visibili ad occhio nudo perché emettono altre radiazioni. Esse sono però visibili se si utilizza una lampada U.V. che il nostro laboratorio non dispone.



