ESERCITAZIONE: Conduttimetria
OGGETTO:
- Titolazione conduttimetrica tra Acido Forte e Base Forte;
- Titolazione conduttimetrica tra Acido Debole e Base Forte;
- Standardizzazione delle soluzioni di Nitrato di Argento tramite conduttimetria;
- Determinazione della concentrazione dei cloruri nell’acqua di rubinetto tramite conduttimetria e Metodo di Mohr.
STRUMENTI, APPARECCHI E SOSTANZE:
- Spruzzetta con acqua distillata;
- Matraccio tarato (200 ml e da 100 ml);
- Buretta graduata (50 ml) con sostegno e relativo imbuto;
- Becherino (250 ml);
- Pipetta tarata (20 ml) con propipetta;
- Conduttimetro con cella conduttimetrica;
- Agitatore Magnetico;
- Nitrato di Argento AgNO3 (Reattivo Titolante incognito);
- Acido Cloridrico HCl (Acido forte incognito);
- Idrossido di sodio NaOH (0,1 N – Titolante);
- Acido Acetico CH3COOH (Acido debole incognito);
- Acido Cloridrico KCl (0,1 N – Acido forte titolante);
- Idrossido di Ammonio NH4OH;
- Acqua di Rubinetto (200 mL).
FORMULE:

LEGENDA:
mg: milligrammi;
MM: Massa Molecolare;
N: Normalità;
V: Volume;
L: Litro;
n: Moli;
M: Molarità.
REAZIONI:
NaOH + HCl → NaCl + H2O
NaOH + CH3COOH → CH3COONa +H2O
KCl + AgNO3 → AgCl(s) + KNO3
AgNO3 + Cl– → AgCl(s) + NO3–
CALCOLI E RISULTATI:

GRAFICI e TABELLE
[embeddoc url=”http://www.bmscience.net/blog/wp-content/uploads/2015/03/tabella-e-grafici-acidoforte-baseforte.docx” download=”all” viewer=”google”]
Dal grafico, ma anche dalla tabella, si può individuare il volume del Titolante necessario per raggiungere il punto equivalente della titolazione che, nelle titolazioni conduttimetriche, coincide con il livello in cui cambia la linea di conducibilità. La conducibilità diminuisce perché aggiungendo NaOH, gli ioni H+ dell’HCl reagiscono con gli ioni OH– dell’idrossido di sodio, formando H2O. Successivamente il grafico presenta una risalita perché ormai gli ioni H+ sono stati consumati, non si produce più acqua e l’aggiunta di OH– rende la soluzione più conducibile. Il grafico non appare simmetrico a causa della diversa mobilità e quindi conducibilità tra gli ioni H+ e quelli OH–.
[embeddoc url=”http://www.bmscience.net/blog/wp-content/uploads/2015/03/tabella-e-grafici-acidodebole-baseforte.docx” height=”550px” download=”all” viewer=”google”]
Nel caso dell’Acido debole con la base forte, all’inizio si può vedere una piccola discesa e poi risalita di conducibilità che è dovuta all’idrolisi provocata dal sale. Inoltre si può notare che all’inizio la conducibilità è bassa a causa della natura dell’acido che, essendo debole, libera pochi H+. L’aggiunta di titolante fa sì che la conducibilità aumenti, specialmente dopo il punto di equivalenza, che anche in questo caso è distinguibile.
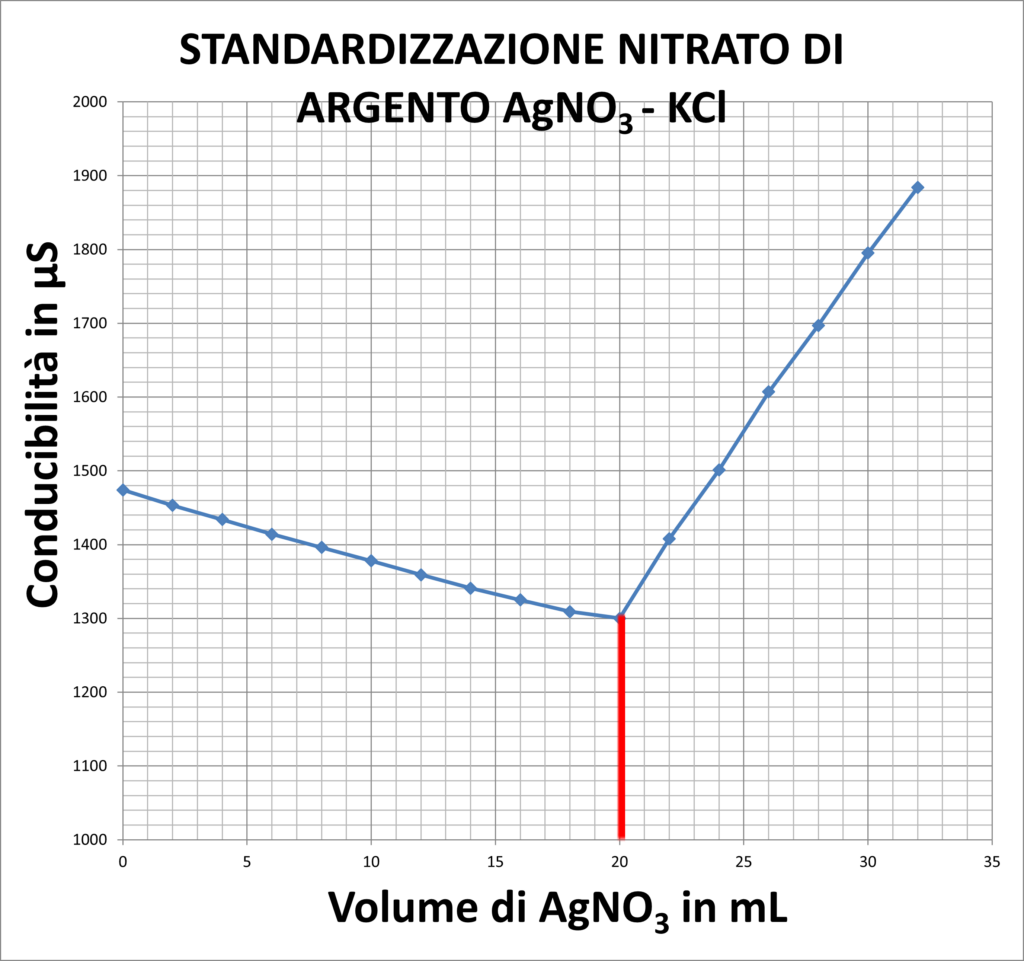
| STANDARDIZZAZIONE AgNO3 | |
| Conducibilità [μS] | Volume AgNO3 [mL] |
| 1474 | 0 |
| 1453 | 2 |
| 1434 | 4 |
| 1414 | 6 |
| 1396 | 8 |
| 1378 | 10 |
| 1359 | 12 |
| 1341 | 14 |
| 1325 | 16 |
| 1309 | 18 |
| 1300 | 20 |
| 1408 | 22 |
| 1501 | 24 |
| 1607 | 26 |
| 1697 | 28 |
| 1795 | 30 |
| 1884 | 32 |
| DETERMINAZIONE CLORURI | |
| Conducibilità [μS] | Volume AgNO3 [mL] |
| 722 | 0 |
| 720 | 0,5 |
| 717 | 1 |
| 714 | 1,5 |
| 711 | 2 |
| 727 | 2,5 |
| 762 | 3 |
| 786 | 3,5 |
| 815 | 4 |
| 847 | 4,5 |
| 872 | 5 |
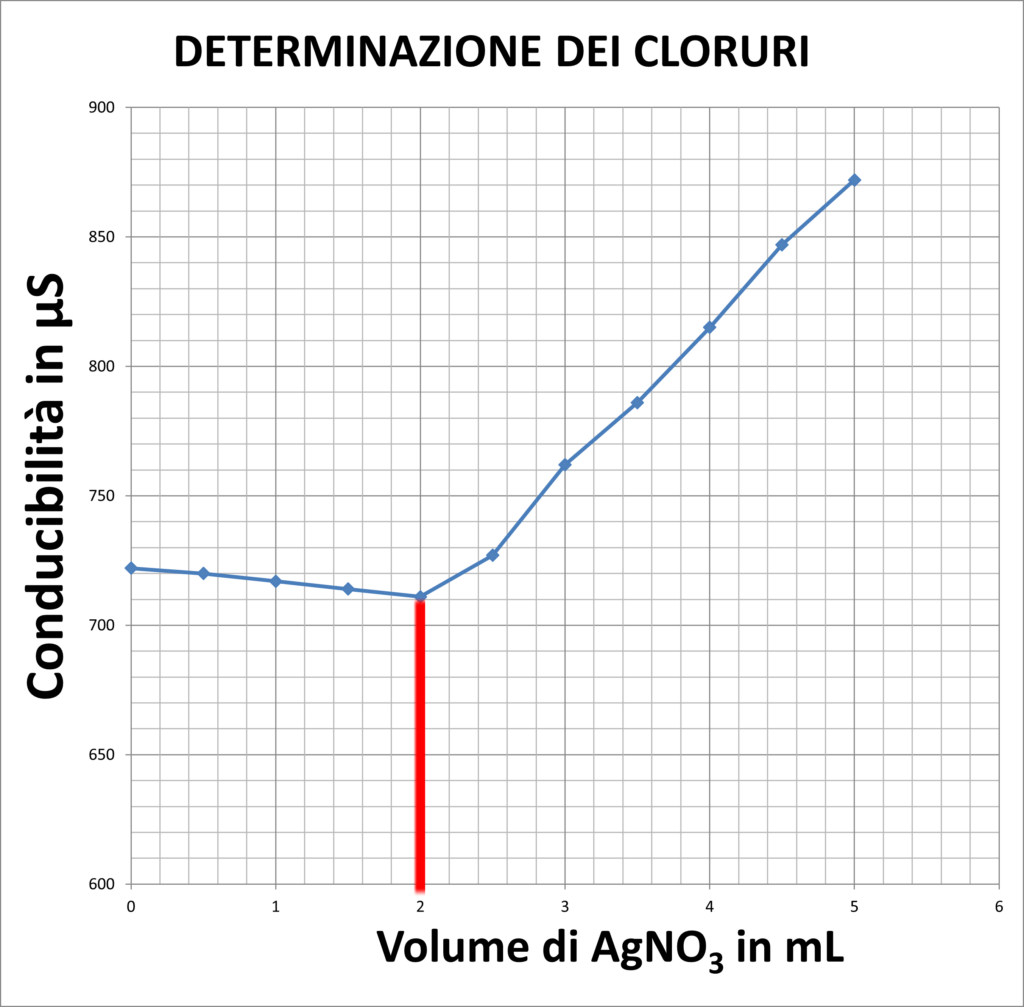
In questi altri due casi, invece, la conducibilità diminuisce a causa della formazioni di Sali poco solubili in acqua. La formazione del sale permette quindi che gli ioni presenti in soluzione si riducano, riducendo anche la conducibilità.
In particolare nel secondo caso, la variazione di conducibilità in iniziale è molto bassa a causa dello scarso numero di ioni Cl– presenti nell’acqua di rubinetto.
RELAZIONE
CONOSCENZE TEORICHE

La conduttimetria è una tecnica elettrolitica che si basa sulla misura della conducibilità elettrica di una soluzione elettrolitica e della sua variazione al variare del tipo o della concentrazione delle specie ioniche in essa presenti.
Le soluzioni elettrolitiche conducono l’elettricità molto meno dei metalli, ma più dei solventi organici, che non contengono ioni mobili, e più dell’acqua deionizzata. I fattori che agiscono sui meccanismi di conduzione sono sostanzialmente la concentrazione degli ioni in soluzione, le cariche ioniche, la temperatura e la velocità di migrazione degli ioni in soluzione.
La conducibilità elettrica di una soluzione viene misurata mediante un conduttimetro collegato ad una cella conduttimetrica, che è costituita da due elettrodi, in genere di platino platinato, immersi nella soluzione di analisi. Si tratta di celle a funzionamento amperometrico, nelle quali il valore di conducibilità viene ricavato in base a misure di corrente elettrica.
La conduttimetria viene applicata per le titolazioni conduttimetriche, nel quale si verifica un’apprezzabile variazione di conducibilità in corrispondenza del punto di equivalenza che perciò può essere facilmente individuato se si opera a temperatura costante.
Nelle titolazioni di precipitazione, invece, si rimuove una determinata specie chimica dalla soluzione, sostituendola con un’altra, in modo tale che si verifichi una sensibile variazione.
DESCRIZIONE DELLA PROVA
Le prime prove che andiamo ad effettuare sono delle titolazioni conduttimetriche. Il primo caso riguarda le titolazioni acido forte-base forte. Le soluzioni in questione sono l’acido cloridrico, la cui concentrazione è ignota, e l’idrossido di sodio 0,1 N.
Innanzitutto si avvina e azzera la buretta con l’NaOH. Si prelevano 20 mL di campione incognito (HCl) con una pipetta tarata e li si versano in un matraccio tarato da 100 mL; si porta a volume il matraccio con dell’acqua distillata. Dopo aver ben miscelato e omogeneizzato la soluzione, la si versa in un becher da 200 mL. Nel becher vanno poi inseriti la cella conduttimetrica, un magnete e un termometro (per verificare che la temperatura sia costante). Adesso si attiva l’agitatore magnetico e il conduttimetro, dopo averlo sciacquato con acqua distillata ed impostato con l’unità di misura più opportuno, milliSiemens nel caso della prima prova. Dopo aver annotato la prima conducibilità si procede con la titolazione. Aggiungendo il titolante dalla buretta, la conducibilità varia così come è mostrato dal primo grafico “TITOLAZIONE ACIDO FORTE-BASE FORTE”. Il punto di equivalenza coincide con il punto in cui la variazione di conducibilità cambia. Una volta individuato il volume di titolante utilizzato si procede al calcolo della Normalità così come mostrato nella sezione calcoli.
Lo stesso procedimento viene effettuato per la titolazione base forte-acido debole, la cui unica differenza è l’unità di misura della conducibilità: questa volta si opera in micro Siemens. Anche il grafico mostra un’andatura diversa.
La seconda prova che andiamo ad effettuare è la determinazione dei cloruri nell’acqua di rubinetto. Il Titolante che utilizziamo in questo caso è il Nitrato di Argento, di cui però bisogna identificare la concentrazione. Per fare ciò lo si titola con KCl 0,1 N ricordando però che l’argento è fotosensibile, quindi si usano contenitori scuri. Questa volta il principio sfruttato è quello delle titolazioni di precipitazione, infatti, gli ioni che si formano nella soluzione facilmente si associano per formare cloruro di argento, un sale poco solubile che quindi riduce la conducibilità. La soluzione risulta quindi opalescente. I procedimenti da effettuare sono tuttavia gli stessi delle altre titolazioni conduttimetriche. Al termine di questa prova, si pulisce la cella con l’idrossido d’ammonio in modo da togliere l’argento che si è depositato sulla sua superficie, e la si risciacqua con l’acqua distillata.
Lo stesso principio viene sfruttato nella prova vera e propria di determinazione di cloruri nell’acqua prelevando 200 mL di acqua di rubinetto. Questa volta il precipitato è meno visibile a causa della bassissima concentrazione di Cl– nell’acqua che, come si può vedere dai calcoli, risulta essere 35,45 mg/L.
CONCLUSIONE
Per concludere possiamo dire che la conduttimetria può essere applicata nell’ambito delle titolazioni grazie alla variazione di conducibilità. Questa tecnica è molto semplice ed efficace, anche se richiede particolare pazienza e attenzione nelle operazioni manuali.


