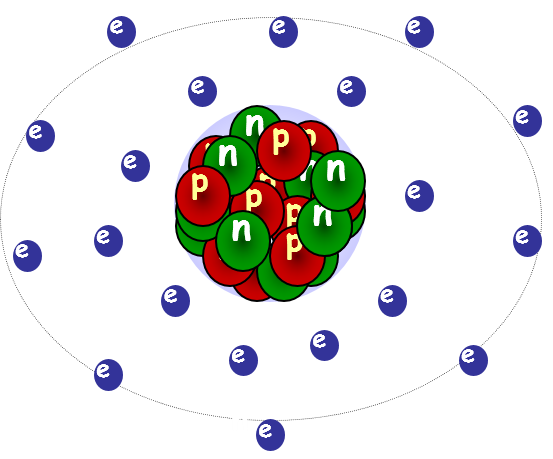
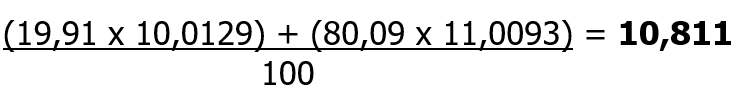L’atomo non è indivisibile ma è formato da tre particelle principali che sono: i protoni (con carica positiva), gli elettroni (con carica negativa) e i neutroni (senza carica elettrica).
In un atomo allo stato fondamentale, cioè neutro, il numero di protoni coincide con il numero di elettroni, ma non necessariamente con quello dei neutroni.
Le masse e le cariche delle particelle subatomiche oggi sono note in dettaglio e con grande precisione.
Il protone pesa 1,672623 ∙ 10-27 Kg ed ha una carica di +1,602177 ∙ 10-19 C.
L’elettrone pesa 0,000911 ∙ 10-27 Kg ed ha una carica di -1,602177 ∙ 10-19 C.
Il neutrone pesa 1,674928 ∙ 10-27 Kg ed ha una carica di 0 C.
Le varie particelle sono disposte nell’architettura atomica in maniera non uniforme ma, la massa principale, data dai neutroni ed i protoni, è concentrata nella regione dell’atomo chiamata nucleo, mentre gli elettroni sono sparsi nella regione intorno al nucleo, chiamato orbitale, a distanza variabile a seconda dell’energia. Quando un atomo acquista o perde un elettrone, diventa uno ione con una carica che sarà positiva, nel caso perda un elettrone, negativa quando lo acquista.
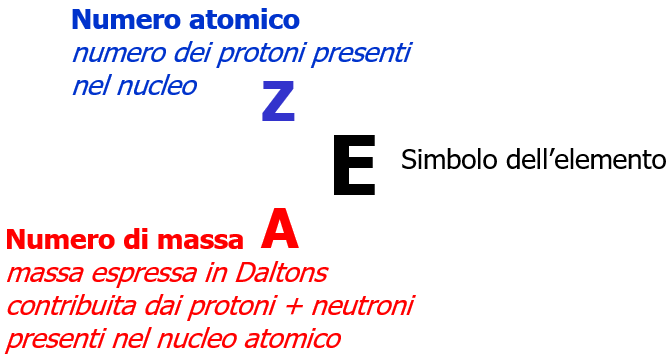
Il numero atomico di un elemento viene indicato con la lettera Z e corrisponde al numero dei protoni presenti in un atomo (ovviamente, quando l’atomo è neutro il numero atomico coincide anche con il numero di elettroni).
Il numero di massa viene indicato con la lettera A e corrisponde al numero dei protoni e dei neutroni.
L’unità di massa atomica (u.m.a.), o equivalente Dalton (Da), è l’unità di riferimento arbitraria che viene utilizzata come grandezza e che corrisponde ad 1/12 della massa dell’isotopo 12C = 1,6605 x 10-24 g. Quindi tutte le masse atomiche derivano da questo rapporto che è una grandezza relativa e perciò adimensionale.
Di ogni elemento esistono delle varianti chiamate isotopi che presentano diverse caratteristiche fisiche e chimiche.
Ad esempio il carbonio può esistere in due stati: 12C e 14C in cui il numero atomico è sempre 6, ma cambia il numero di massa in quanto varia il numero di neutroni.
La presenza di isotopi ci fa capire come il numero di massa non è quasi mai un numero intero, ma che presenta spesso dei numeri decimali significativi. Ad esempio il boro ha un numero atomico di 5 protoni, ma ha un numero di massa di 10,8 dovuto alla diversa percentuale dei suoi isotopi presenti in natura. Il boro è presente per il 19,91 % con 5 protoni e 5 neutroni, mentre per l’ 80,09 % con 5 protoni e 6 neutroni. La massa atomica del boro è quindi calcolata facendo una media ponderata delle masse effettive degli isotopi rispetto alla loro presenza percentuale in natura:
Le molecole invece sono le più piccole unità discrete, costituita da 2 o più atomi uguali o diversi, che mantengono le stesse caratteristiche chimiche del composto (ad esempio H2O, NH3, C6H12O6). Il peso molecolare sarà invece la somma dei pesi atomici di tutti gli atomi che costituiscono la molecola.
A volte la formula chimica non sottintende una unità discreta molecolare, ma piuttosto un rapporto stechiometrico costante degli elementi. Ad esempio, l’acqua può essere considerata come unità molecolare, mentre il sale da cucina (NaCl) non è una molecola. I composti ionici o metallici non possono essere isolati come molecole, ma hanno una formula empirica che indica solo il tipo di atomi e in quale rapporto sono presenti.