La progressione del ciclo cellulare è sottoposta ad un rigido e raffinato sistema di controllo che verifica il passaggio tra le diverse fasi. Infatti, il passaggio da una fase all’altra non è automatico, ma avviene solo dopo la verifica di segnali biochimici indicativi delle condizioni intracellulare ed extracellulari (controlli intrinseci ed estrinseci). Affinché una fase possa essere avviata, quella precedente deve essere correttamente terminata.
In particolar modo, negli organismi unicellulari, contano soprattutto le condizioni ambientali (la presenza di nutrienti), negli organismi multicellulare contano anche i segnali chimici derivanti da altre cellule (fattori solubili quali mitogeni, fattori di crescita, di sopravvivenza…).
Le verifiche applicate al ciclo cellulare vengono chiamate checkpoint o punti di controllo. Ci sono tre principali checkpoint:
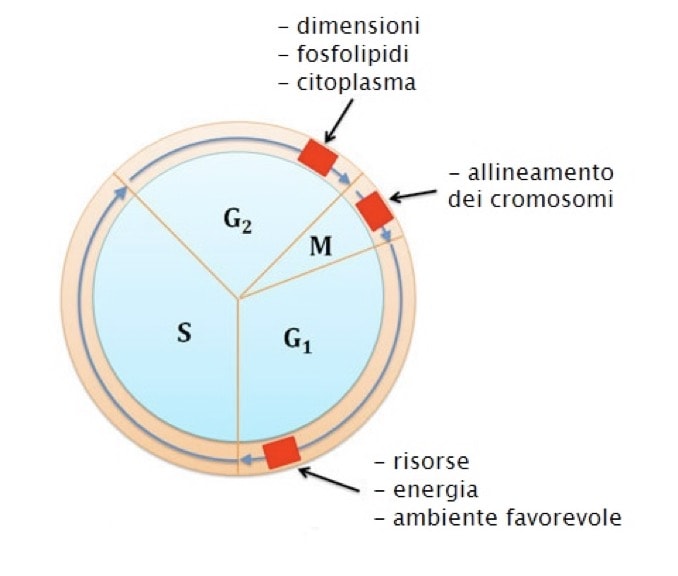
- Il ceckpoint che controlla l’ingresso nella fase S (tra la fase G1 e la fase S). Questo checkpoint controlla che il DNA sia integro e che ci siano abbastanza nutrienti per la crescita cellulare oltre che i fattori di crescita idonei. Un non superamento di questo controllo determina l’uscita dal ciclo cellulare e l’ingresso della cellula in una fase G0 di quiescenza cellulare.
- Il ceckpoint che controlla l’ingresso nella fase M (tra la fase G2 e la fase M), che controlla che il DNA non abbia subito danni o mutazioni. Se la cellula non supera questo controllo non prosegue con la mitosi.
- Il checkpoint che controlla il completamento della fase M (tra la metafase e la citodieresi). Questo checkpoint controlla la progressione della mitosi, in particolare l’interazione tra le fibre del fuso mitotico ed i diversi cromosomi, oltre che il loro corretto allineamento lungo la zona equatoriale della cellula.
Quindi le transizioni avvengono soltanto se sono presenti i fattori di crescita ed i nutrienti, se il DNA non è danneggiato ed è avvenuta una corretta replicazione, se le dimensioni ed il volume cellulare sono sufficienti alla divisione e se i cromosomi sono allineati perfettamente ed agganciati al fuso mitotico. Se una qualsiasi di queste condizioni non viene soddisfatta si ha il blocco del ciclo.
Diversi approcci sperimentali hanno contribuito a definire il complesso di interruttori molecolari coinvolto nel controllo del ciclo. Negli anni ’70, grazie ad esperimenti basati sulla fusione tra cellule di mammifero in diverse fasi del ciclo, con produzione di un eterocarionte, si è scoperta l’esistenza di fattori in grado di indurre l’ingresso in mitosi e di replicare il DNA su cellule G1.
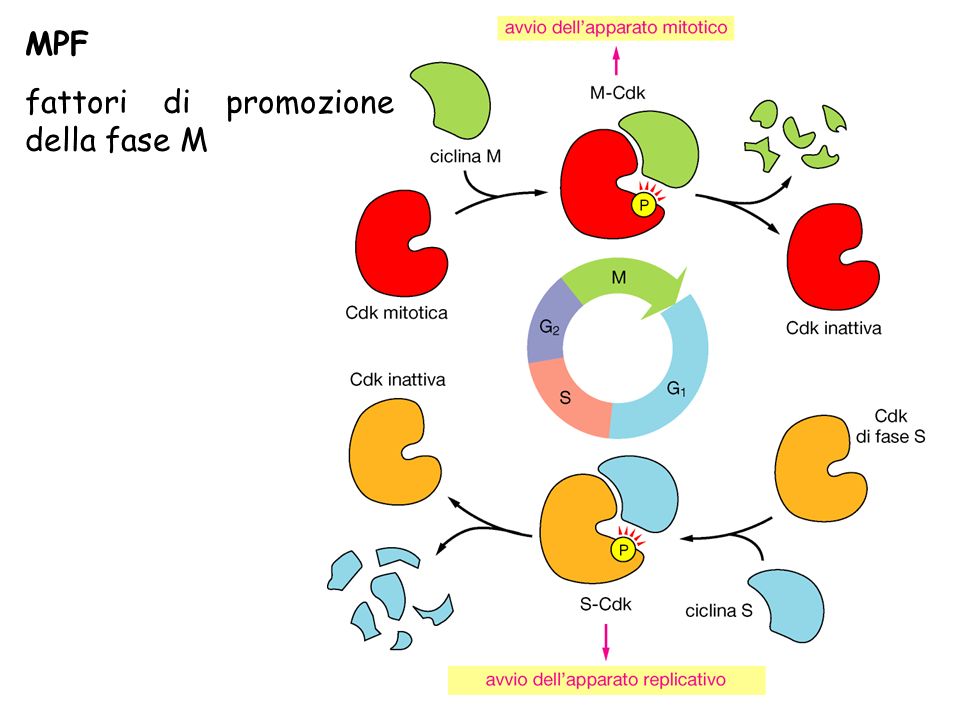
In seguito ad altri studi biochimici su oociti di anfibio, si è visto come tramite microiniezione di estratti proteici ottenuti da oociti in divisione meiotica, si induce la cellula alla meiosi. Questo risultato appariva simile a quello ottenuto con le fusioni cellulari, ma in più dimostrava che il fattore in grado di indurre l’ingresso in mitosi fosse di natura proteica e la sua attività poteva essere controllata dal progesterone. Il fattore individuato venne rinominato MPF (meiosis/maturating promoting factor) poiché induce la maturazione di oociti.
Altri studi condotti su cellule di lievito, hanno permesso di capire gli effetti dei mutanti cdc (cell division cycle). I geni cdc a temperature permissive si dividono normalmente, mentre a temperature non permissive si bloccavano in una particolare fase del ciclo manifestando l’effetto della mutazione. Diversi geni che generano mutazioni cdc sono stati identificati nel lievito, ma sicuramente il più significativo è rappresentato dal gene Cdc2 e dal suo omologo Cdc28. Questi due geni codificano per enzimi con attività serina-treonina chinasica. Vari ortologhi di questi geni sono stati trovati anche nell’uomo.
Un ultimo contributo alla definizione del sistema di controllo del ciclo è dovuto all’analisi proteica degli estratti da uova di riccio di mare che ha consentito la scoperta delle cicline, delle proteine con concentrazione citosolica oscillante legata ai vari stadi del ciclo.
Il macchinario molecolare che regola il ciclo cellulare eucariotico si basa quindi sull’interazione di due processi:
- un orologio molecolare indipendente che segue le varie fasi del ciclo e si basa sull’alternarsi ritmico di sintesi e degradazione delle cicline. Le cicline, in particolare quella A e quella B, associandosi agli enzimi Cdk (Cyclin dependent kinase – Chinasi ciclina-dipendente), formano dei complessi che, grazie alla loro attività enzimatica, permettono il superamento dei checkpoint.
- un processo che regola l’orologio molecolare in base ai segnali intracellulari ed extracellulari avvalendosi di proteine ed enzimi che più o meno modulano l’attività di cicline e Cdk.
L’MPF è un enzima proteina-chinasi dimerico costituito da due subunità, una catalitica ortologa a cdc28 e cdc2 del lievito (CDK1), ed una regolatrice necessaria per la sua attività (ciclina B).
Durante il ciclo cellulare, il passaggio attraverso le diverse fasi è consentito proprio dall’azione del complesso chinasi-ciclina. La chinasi funziona solo insieme alla subunità regolativa ciclina, per questo è chiamata chinasi ciclina-dipendente.
Durante il ciclo cellulare non è sufficiente accumulare la ciclina per attivare la Cdk, ma il complesso Cdk-ciclina è oggetto a molteplici regolazioni. C’è corrispondenza tra variazione di fase nel ciclo cellulare, variazione di attività di MPF e variazione di concentrazione di ciclina.
Infatti, la chinasi (CDK1) dipende per la sua attività dalla ciclina e la sua attività riflette l’andamento ciclico della ciclina B ma non perfettamente. La Cdk si attiva repentinamente solo dopo che la ciclina ha iniziato ad accumularsi da un bel po’. Questo perché l’attività di Cdk dipende da un lato dai livelli di ciclina, dall’altro anche da un complesso pattern di fosforilazione-defosforilazione sulla Cdk stessa in cui sono coinvolti anche altri enzimi chinasi e fosfatasi. Uno di questi enzimi è il CAK (Cdk Activating Kinase, chinasi che attiva il Cdk) che fosforila una treonina di Cdk attivandola.
L’attivazione completa è favorita con meccanismo a feedback positivo innescato dalla formazione stessa del complesso cdk-ciclina che provoca un aumento rapido dell’attività chinasica di Cdk.
L’attività di CDK1 è spenta dalla degradazione ubiquitina-proteasoma-dipendente della ciclina. L’ubiquitinazione della ciclina è indotta dal complesso APC (Anaphase Promoting Complex, complesso che promuove l’anafase) a sua volta indotto dalla stessa Cdk. La funzionalità di Cdk è quindi limitata ad una precisa finestra temporale e la stessa Cdk contribuisce al proprio spegnimento seguendo un meccanismo a feedback negativo.
Una volta attivata la CDK1 del MPF, essa fosforila le proteine target cruciali per l’ingresso e la progressione della cellula in mitosi. La Cdk si occupa di fosforilare diverse componenti: le lamine nucleari disgregando l’involucro nucleare; le MAP (Microtubule Associated Protein, proteine associate ai microtubuli) riorganizzando i microtubuli e formando il fuso mitotico; gli enzimi condensine, permettendo un compattamento della cromatina (quest’ultima regolazione risulta ancora oscura in quanto non è stato ancora interpretato come venga controllato il compattamento).
Fonte: Biologia e Genetica.