Il nome più corretto degli amminoacidi, come nome generico, è in realtà alfa-amminoacidi perché il primo carbonio, legato al gruppo funzionale della molecola, che è il gruppo carbossilico, viene indicato con la lettera α.
Tutti gli amminoacidi, sono rappresentati da una comune struttura di base che è caratterizzata dalla presenza di un carbonio centrale, che è appunto il carbonio alfa, avente un’ibridazione di tipo sp3, quindi con i 4 sostituenti disposti ai vertici di un tetraedro, di cui 3 di questi sono uguali in tutti gli amminoacidi, e sono:
- 1 atomo di H;
- 1 gruppo carbossilico;
- 1 gruppo amminico;
Come si può notare dalle caratteristiche chimiche del gruppo carbossilico e del gruppo amminico, questi due gruppi sono rispettivamente un gruppo acido e un gruppo basico e a pH fisiologico, pari all’incirca a 7.4, sono dei gruppi ionizzabili, quindi presentano rispettivamente la carica negativa sul gruppo carbossilico (avendo carattere acido tende a deprotonarsi cedendo il protone, a pH inferiore a quello fisiologico diventa protonato) e la carica positiva sul gruppo amminico (a pH fisiologico presenta un protone in più, quindi una carica positiva, mentre aumentando il pH tende a perdere questo protone).
Un’altra caratteristica è la presenza del 4° sostituente che viene indicato genericamente con R e rappresenta la cosiddetta Catena Laterale dell’amminoacido, che è la parte variabile dell’amminoacido stesso. Ogni amminoacido è caratterizzato da una differente catena laterale che può essere più o meno complessa ed è la struttura chimica che ci permette di suddividere i vari amminoacidi nelle varie classi.
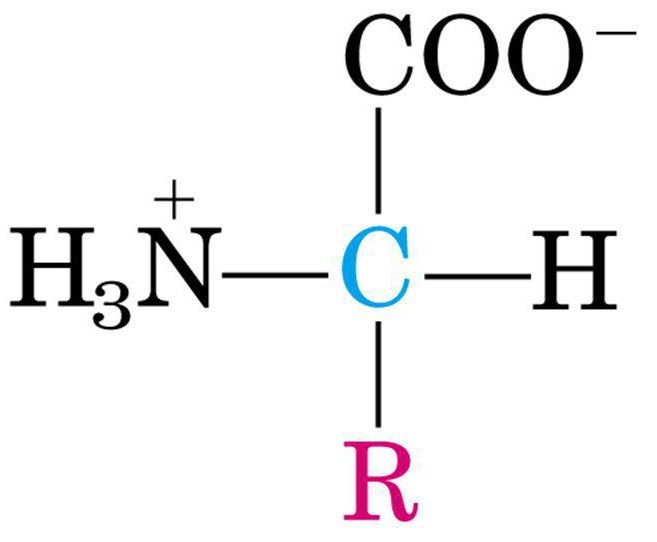
Quindi la forma più corretta per rappresentare gli amminoacidi a pH fisiologico è quella ionizzata, ossia con il gruppo acido deprotonato e il gruppo basico protonato sull’azoto che viene detta Zwitterionica e presenta carica netta uguale a 0.
Per gli amminoacidi, e per tutte le molecole che possono essere cariche positivamente oppure negativamente, esiste un’importante correlazione tra il valore di pH e il valore di pKa. Questa relazione è impostata dalla equazione di Henderson Hasselbach. La Ka è la costante di dissociazione acida, quindi maggiore è il valore della Ka e maggiore sarà la forza dell’acido. Stessa cosa dicasi anche per il pKb.
Il pKa, come anche il pH, è dato dal –log10 della Ka, oppure dal log10 dell’inverso di Ka. Questa equazione quindi, correla il valore del pH col valore del pK + log delle concentrazioni della forma ionizzata e dell’acido, del sale col suo acido.
Quindi pKa è uguale a –log Ka e quanto più è piccola tanto più l’acido è forte. In realtà, il rapporto tra le concentrazioni di un acido debole e della sua base coniugata dipende dal pH della soluzione e dalla sua capacità intrinseca di rilasciare il protone.
Struttura chimica degli amminoacidi
Tutti gli amminoacidi (i 20 amminoacidi che fanno parte delle proteine, tranne la glicina) presentano un αC, che è un carbonio di tipo chiralico, quindi presenta un piano di asimmetria, cioè un centro stereogenico o asimmetrico della molecola. Questo vuol dire che tutti gli amminoacidi, tranne la glicina, possono essere presenti nelle due forme enantiomeriche, stereosomeriche, meglio definite come enantiomeri D e L.
Gli enantiomeri sono quelle forme isomeriche (particolari forme di isomeria, con la quale può presentarsi la molecola) che si definiscono come immagine speculare l’una dell’altra, non sovrapponibile. La condizione necessaria affinché il carbonio presente all’interno di una molecola sia un centro chiralico, o un centro stereogenico o un centro asimmetrico, è che i quattro sostituenti legati a questo atomo di carbonio siano tutti differenti tra di loro. Ecco perché la glicina, che presenta come catena laterale l’H, è una molecola perfettamente simmetrica.
Per questo motivo, si pensava che ci potessero essere delle miscele racemiche delle due forme enantiomeriche degli amminoacidi; invece è ampiamente dimostrato che tutte le proteine sono costituite soltanto dall’associazione della forma L di tutti gli amminoacidi. Nel corso dell’evoluzione è stata selezionata questa forma amminoacidica ed è stata portata avanti. Inoltre è proprio dalla forma dell’amminoacido che deriva la configurazione del sito attivo dell’enzima che catalizza la reazione di quel determinato substrato. Le reazioni sono stereospecifiche, cioè un enzima che può catalizzare per esempio la rottura di un determinato substrato (potrebbe trattarsi anche di un amminoacido), agirà soltanto sull’amminoacido della forma L, perché il sito attivo dell’enzima in questione è adatto ad accogliere soltanto la forma L. È biologicamente rilevante, allora, la presenza di un determinato tipo di configurazione.
Cosa importante è che un carbonio può essere di tipo stereogenico o chirale soltanto nello stato di ibridazione sp3, quindi una molecola con una geometria tetraedrica.
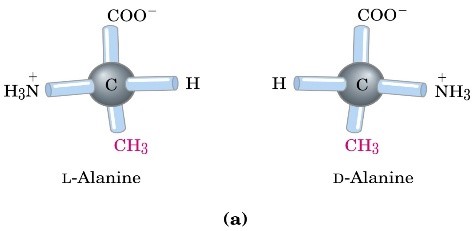
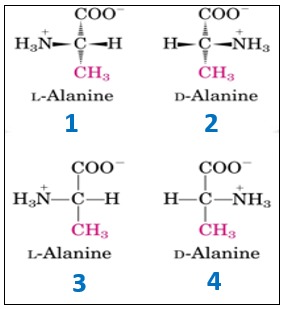
Come convenzione maggiormente utilizzata per la descrizione o la classificazione degli amminoacidi, in una forma o nell’altra, che identificano le due forme enantiomeriche degli amminoacidi, viene utilizzata la convenzione D/L e il tipo di scrittura utilizzata normalmente per disegnare una molecola può essere di due tipi. Il primo è con i cunei (tipo 1-2), dove i cunei più scuri sono le parti della molecola che vengono al di sopra del piano individuato dal foglio, mentre i cunei tratteggiati sono la parta della molecola che va verso il basso.
Il secondo tipo di scrittura sono le proiezioni di Fischer (tipo 3-4), in cui ci sono trattini semplici che, a prima vista, non indicano la tridimensionalità della molecola. Per convenzione, le linee orizzontali sono le parti della molecola che sporgono dal piano, mentre le linee verticali sono le parti che vanno dietro il foglio.
Il sistema D/L si basa sulla configurazione assegnata alla molecola di gliceraldeide utilizzata come esempio di enantiomero D/L. Gli amminoacidi descritti dalla forma D o dalla forma L si rappresentano con al centro il carbonio chiralico (carbonio alfa) dell’amminoacido, in alto il gruppo carbossilico e in basso la catena laterale. Se il gruppo amminico, poi, si trova a sinistra abbiamo la forma L, se si trova a destra abbiamo la forma D. Poiché sappiamo che, per convenzione, abbiamo solo amminoacidi L, questi saranno rappresentati con il gruppo amminico a sinistra.
Bisogna fare attenzione. Questo sistema L/D crea confusione perché si può pensare in un primo momento che le due lettere possano rappresentare un’indicazione del potere rotatorio della luce. Sappiamo che gli enantiomeri rappresentano la stessa molecola, l’unica differenza è la disposizione degli atomi intorno al carbonio chiralico. L’unica differenza fisica esistente tra due enantiomeri è la capacità di rotazione del piano della luce polarizzata: per esempio se abbiamo una miscela di reazione contenente l’isomero L di una determinata molecola e una miscela contenente l’isomero D, osserviamo in un caso una deviazione rispetto al piano della luce polarizzata, che sta attraversando il nostro mix di reazione, verso destra (orario); nell’altro caso invece verso sinistra (antiorario). Queste due forme enantiomeriche si possono distinguere in destrorotatoria o destrogiro e levorotatorio o levogiro. Però questa proprietà fisica non è da confondere con la dicitura D-alanina o L-alanina, perché ci sono molti amminoacidi che appartengono alla serie L, ma che sono destrorotatori e non levorotatori. Quindi L/D è una convenzione adottata dagli scienziati, mentre il potere levorotatorio o destrorotatorio sono proprietà fisiche che si possono registrare in una molecola (quindi non una convenzione fissata dagli scienziati, ma una proprietà intrinseca alla molecola).
Gli amminoacidi si possono sintetizzare in laboratorio, applicando una condizione prebiotica con la sintesi di Strecker, partendo da un composto aldeidico, in presenza di alcuni composti come il KCN (cianuro di potassio) o il cloruro di ammonio, si ottiene un composto intermedio chiamato α-ammino nitrile e poi si ottiene l’α-amminoacido. Questo prevede la formazione di un intermedio che è la base di Shiff intermedia, da cui poi si potrebbero ottenere sia la forma L dell’amminoacido sia la forma D.
Tutti gli amminoacidi sono nella forma L perché probabilmente la selezione di uno dei due enantiomeri da parte delle prime forme di vita è stata casuale ed è stata poi trasmessa alle generazioni successive. Questa rappresenta una importante evidenza dell’origine comune di tutti gli organismi viventi da un unico ancestore.
Una curiosità a proposito della scelta casuale della forma L degli amminoacidi che costituiscono le proteine e che avvalora l’ipotesi della cosiddetta origine extraterrestre della Terra, è il “meteorite di Murchison”: sono stati ritrovati vari frammenti (ammontare complessivo di circa 100kg di materiale) caduti nel 1969 sulla Terra, precisamente in Australia. Tra i vari elementi analizzati nel meteorite sono stati trovati molti amminoacidi, tutti appartenenti curiosamente alla serie L: si è giunti alla conclusione che questi amminoacidi si siano formati indipendentemente dalla formazione della crosta terrestre, perché era presente anche l’isotopo 15 dell’azoto tra questi amminoacidi, che invece si trova molto poco sugli amminoacidi che si sono formati sul nostro pianeta. Un’altra componente fondamentale, che avvalorerebbe la comparsa della vita extraterrestre, è anche un’alta percentuale di acqua, all’incirca il 12%, come costituente di questo meteorite di natura carbonacea.
Oltre agli amminoacidi della serie L, però, bisogna anche sottolineare la presenza, all’interno delle molecole che costituiscono le nostre cellule, di amminoacidi della serie D. Sebbene siano molto meno presenti e non facciano parte delle proteine (nessuna proteina è costituita da amminoacidi della serie D), li possiamo trovare ugualmente; infatti dopo la sintesi delle proteine, intervengono degli enzimi chiamati racemasi che converte la forma L della serina nella forma D oppure L-aspartato in D-aspartato. Un esempio è dato da alcuni neurotrasmettitori che fungono da agonisti del recettore dell’N-metil-D-aspartato (NMDA).
Un altro esempio biologico molto studiato da alcuni decenni è la cosiddetta “medicina Kambo”, che viene soprattutto utilizzata dalle popolazioni indigene del Sud America, in particolar modo dagli Indios Matses che vivono lungo la linea di confine tra il Brasile e il Perù. La medicina Kambo si basa sull’utilizzo della secrezione gelatinosa di alcune rane (in particolare la rana appartenente alla specie Phyllomedusa bicolor), che contiene molti peptidi bioattivi. Con il termine “bioattivo” ci si riferisce a quelle molecole che innescano una determinata risposta quando vengono inoculate all’interno del nostro organismo. Tra i peptidi che fanno parte della secrezione gelatinosa di questa rana, ci sono nove peptidi bioattivi in particolare che contengono amminoacidi di tipo D. È stato dimostrato che la sostituzione dell’amminoacido D in quella determinata posizione con l’amminoacido L, non provoca nessun effetto, quindi è un’ulteriore prova a favore dell’importanza della configurazione delle molecole e della stereospecificità della risposta innescata da determinate molecole, tra cui gli amminoacidi. Questa medicina Kambo, che viene comunemente chiamata anche “vaccino della foresta”, proprio perché le popolazioni che la utilizzano si trovano nella foresta Amazzonica, è uno dei più potenti anestetici e analgesici che si conoscano. È stata isolata da questa secrezione gelatinosa la Deltorfina-A, che contiene la D-metionina in una particolare posizione, che va a legarsi ai recettori degli oppioidi ed è stato dimostrato avere un potere anestetico o analgesico 4000 volte superiore rispetto a quello della morfina, quindi può essere utilizzata in sindromi molto dolorose quali le coliche renali, il cancro o l’insufficienza vascolare periferica.
Proprietà acido-base
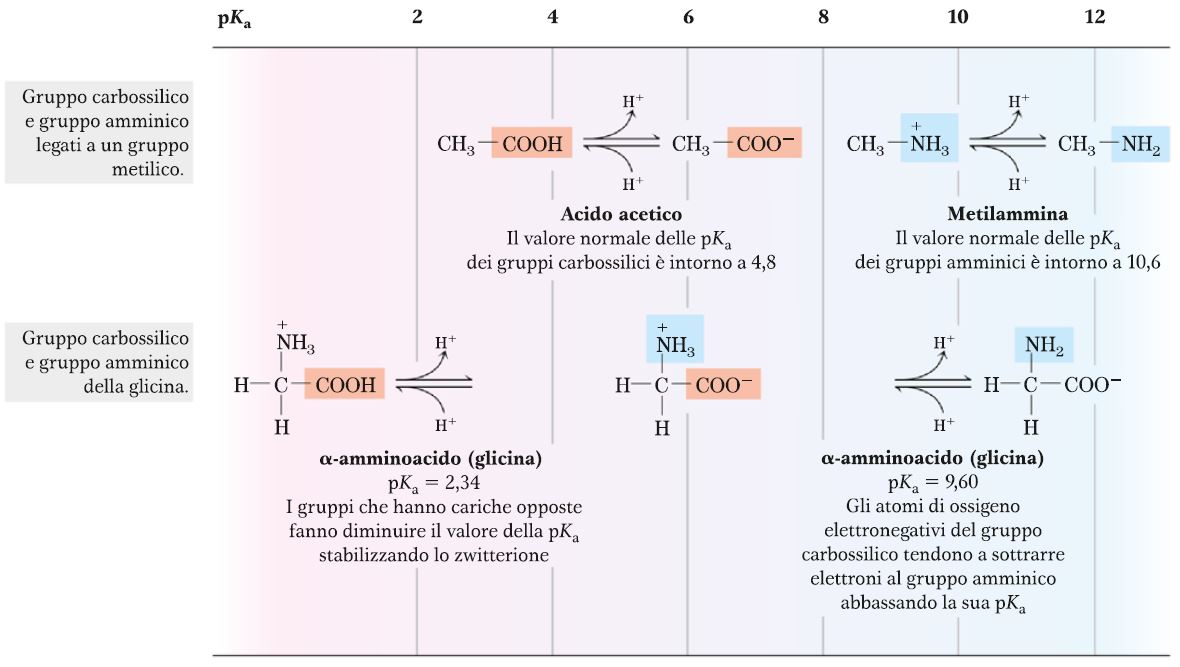
Per quanto riguarda le proprietà acido-base di un amminoacido confrontate con quelle di un acido carbossilico e di un’ammina, come si può notare da questo diagramma, abbiamo un valore di pKa per l’acido acetico pari più o meno a 4,8 che è un valore un tantino più alto rispetto a quello del gruppo carbossilico nella glicina, che ha un pKa di 2,34. Quindi il pKa più basso indica che la forza dell’acido è maggiore. Questo è causato dal fatto che c’è una certa repulsione elettrostatica tra i due gruppi. La stessa cosa la possiamo dire anche per il gruppo amminico, infatti il pKa della metilammina, che è l’analogo del gruppo amminico della glicina, è pari a 10,6 rispetto al pKa della glicina che è 9,6. Questo vuol dire che la glicina è una base meno forte rispetto alla metilammina. Anche in questo caso, il carattere un po’ più acido del gruppo basico è determinato dall’intorno chimico, cioè dai sostituenti sull’atomo di C. Quindi entrambi i gruppi, sia il gruppo carbossilico che il gruppo amminico, presentano un grado di acidità maggiore rispetto invece ai gruppi isolati, cioè legati con una porzione più semplice.
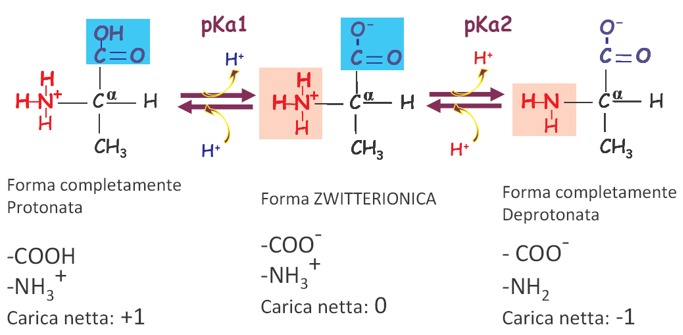
Quindi, in un amminoacido sono presenti almeno due gruppi capaci di dissociare un protone e per tutti gli amminoacidi potremmo registrare almeno 2 costanti di dissociazione acida, 2 pKa. In soluzione saranno presenti 3 forme diversamente ionizzate in equilibrio tra di loro. Qui è riportato l’esempio dell’amminoacido Alanina (la catena laterale dell’Alanina è un CH3), quindi abbiamo, partendo da sinistra verso destra, la forma completamente protonata, che è quella presente in un ambiente più acido rispetto al pH fisiologico. La prima reazione è la perdita del protone del gruppo più acido, quindi del gruppo carbossilico. Viene perso il primo protone e abbiamo la depronotazione con formazione del gruppo carbossilico COO–. Quindi abbiamo il primo equilibrio, k di dissociazione del gruppo carbossilico al quale corrisponderà un certo valore di pKa che viene indicato con pKa1. Questo corrisponde alla formazione della forma zwitterionica. A pH fisiologico, quindi, si ha la ionizzazione del gruppo carbossilico mentre il gruppo amminico essendo basico continua a mantenere il protone legato. La carica netta della molecola a pH fisiologico è uguale a 0. Andando verso pH più basici, ossia oltre il 7,4 del pH fisiologico, otteniamo la forma completamente deprotonata, in cui anche il gruppo amminico perde il proprio protone e quindi la carica netta della molecola in questa situazione sarà uguale a -1. La prevalenza in soluzione di una forma sulle altre dipende chiaramente dal pH.
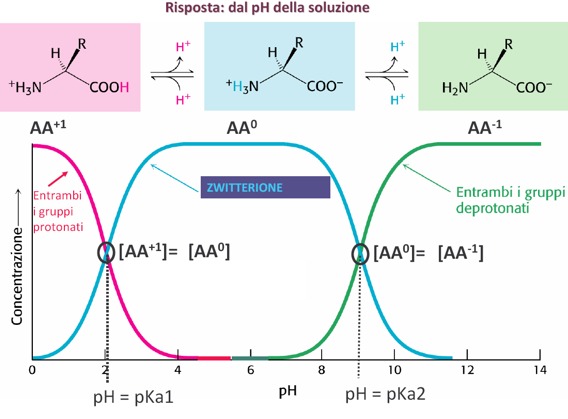
Quindi, queste sostanze anfotere, come tutte le sostanze anfotere, rispondono a variazioni di pH come si nota da questo grafico, man mano che varia il pH cambiano anche le concentrazioni relative delle varie specie, acida e basica, e di quella con carica netta uguale a 0. Quindi, abbiamo una condizione iniziale in cui è massima la forma amminoacidica carica positivamente, man mano che aumenta il pH la curva diminuisce, contemporaneamente aumenta la forma zwitterionica che presenta le 2 cariche positiva e negativa contemporaneamente, fino a raggiungere la concentrazione massima della curva. Da notare che la forma carica positivamente e la forma con carica netta 0, quindi zwitterionica, si incrociano in corrispondenza di un determinato valore di pH. Questo pH non è altro che il valore del pKa1, cioè della prima costante di dissociazione che ha un valore poco più alto di 2. Questo in accordo con l’equazione di Henderson Hasselbach dove pH = pKa + log del rapporto delle concentrazioni del sale sulla forma carica negativamente e sulla forma acida, e questo valore non è casuale, ma è il valore in cui le due concentrazioni del sale (che sarebbe in questo caso la forma zwitterionica, al numeratore) e dell’acido (al denominatore, forma acida che ha carica netta +1) si equivalgono tra di loro, il logaritmo di 1 è uguale a 0, quindi il pH è uguale a pKa1.
Man mano che aumenta il pH, comincia ad aumentare anche la forma carica negativamente dell’amminoacido. Prevale la deprotonazione del gruppo amminico e diminuisce la forma zwitterionica, perché il gruppo amminico perde il suo protone presente nella forma zwitterionica e le due curve, verde e blu, si incrociano in un punto che rappresenta un valore di pH corrispondente al pKa2, ossia il 2° equilibrio di dissociazione che consiste nella perdita del protone del gruppo amminico, cioè del gruppo basico, ed è la situazione in cui anche in questo caso il sale e l’acido sono uguali tra di loro, il rapporto è uguale a 1 e il logaritmo di 1 è uguale a 0. In questo caso il sale sarà la forma con la carica negativa e invece l’acido sarà la forma zwitterionica.
Punto isoelettrico
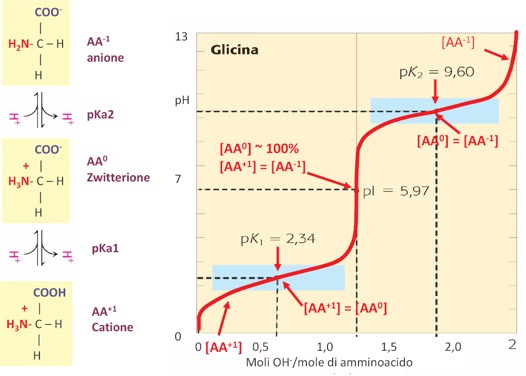
Il punto isoelettrico viene indicato con pI e rappresenta il valore di pH in cui l’amminoacido in soluzione ha carica netta uguale a 0. Quindi, ogni amminoacido presenterà un proprio valore di punto isoelettrico. La forma ionica prevalente al punto isoelettrico è lo zwitterione, la forma cationica e la forma anionica sono presenti in soluzione in uguale concentrazione. Per esempio, per la Glicina (in cui la catena laterale è rappresentata da un atomo di H) si ha il 50% di Glicina con carica positiva e il 50% di Glicina con carica negativa. Per ogni amminoacido con due gruppi dissociabili si calcola il pI facendo la media tra i due pKa. Quindi, per esempio, per la Glicina, i valori sono 2,34 per il gruppo acido (il gruppo carbossilico) e 9,6 invece per il gruppo basico (il gruppo amminico), facendo la media otteniamo 5,97 ed è esattamente in questo punto che abbiamo il massimo della concentrazione della forma zwitterionica. E’ chiaro che il punto isoelettrico cambia a seconda delle proprietà acido-base che ci possono essere anche nella catena laterale degli amminoacidi.
Il pKa e il pI di un amminoacido si possono determinare anche sperimentalmente facendo un’operazione chimica che comunemente si fa nei laboratori di chimica che è la Curva di Titolazione. Nella curva di titolazione si costruisce un grafico in cui viene riportato in ordinata il pH e in ascissa la concentrazione, oppure come in questo caso, il numero di moli di titolante che viene aggiunto. Il titolante è una specie chimica a concentrazione nota, così come il volume che si aggiunge. Quello che si deve determinare nella curva di titolazione classica della chimica generale, è la concentrazione della specie acida o basica, a seconda che si faccia la titolazione di un acido forte con una base forte o viceversa, oppure di un acido debole con una base forte e viceversa. Qui è riportato l’esempio della Glicina, per il quale noi abbiamo due equilibri di dissociazione acida che sono uno più acido e l’altro più basico che corrispondono a dei protoni presenti rispettivamente sul gruppo carbossilico e sul gruppo amminico. Da una concentrazione ad un pH basso in cui abbiamo il prevalere della carica netta uguale a +1, man mano che si aggiunge la base forte, quindi un certo numero di moli, aumenta il pH, fino ad un primo punto di flesso che rappresenta la situazione in cui la concentrazione dell’amminoacido carico positivamente equivale alla concentrazione della forma zwitterionica. Il punto ha un valore di pKa1 pari a 2,34. Man mano che continuiamo ad aggiungere un certo numero di moli del titolante si avrà il punto di flesso centrale della curva in cui è presente il cosiddetto Punto di Equivalenza, in cui possiamo registrare il pI dell’amminoacido ed in cui prevale la specie chimica con la carica netta uguale a 0. Quindi abbiamo il 100% di concentrazione di amminoacido con carica netta uguale a 0. In corrispondenza di questo pI la concentrazione dell’amminoacido con carica + equivale alla concentrazione dell’amminoacido con carica – ed è pari a 5,97. Continuando con l’operazione di titolazione, si ottiene un altro punto di flesso in corrispondenza di pH più basici, in cui abbiamo il secondo equilibrio di dissociazione acida pKa2 che ha un valore di pH pari a 9,6 e che rappresenta il secondo equilibrio di dissociazione in cui l’amminoacido con carica netta uguale a 0, quindi la forma zwitterionica, si equivale con la concentrazione dell’amminoacido con carica netta uguale a -1. Si ottiene poi la totale deprotonazione del gruppo basico.
Dalla curva di titolazione si possono ricavare delle informazioni sul carattere acido o basico dell’amminoacido e soprattutto sulla presenza o meno di altri gruppi ionizzabili oltre ai due gruppi classici che ci sono in tutti gli amminoacidi (che sono il gruppo carbossilico e il gruppo amminico legati al carbonio α). In questo caso è la curva di titolazione con acido diprotico perché con questa operazione abbiamo rimosso, quindi abbiamo titolato, i due gruppi dissociabili che sono il gruppo carbossilico e il gruppo amminico.
Tampone biologico
Si possono utilizzare gli amminoacidi come tamponi. Esiste un’importante categoria di sostanze che sono classificate come Tamponi Biologici. All’interno del nostro organismo, affinché possano essere efficienti tutte le varie potenzialità dell’organismo, c’è bisogno del mantenimento intorno a valori prefissati molto precisi di alcuni parametri fisico-chimici tra cui la temperatura e il pH. La stragrande maggioranza degli enzimi hanno un optimum di funzionalità in corrispondenza del pH fisiologico, gli enzimi gastrici funzionano in corrispondenza di pH molto bassi. Quindi è assolutamente necessario impedire oscillazioni troppo grandi del pH, difatti sono tollerate delle oscillazioni rispetto a 7,4 di al massimo 0,2 unità di pH, in su o in giù. Per contrastare queste oscillazioni all’interno della cellula ci sono dei sistemi chimici che funzionano come i sistemi tampone. La cosa fondamentale è che sono costituiti da un acido debole e dal sale formato dalla sua base coniugata perché devono contrastare l’aggiunta oppure la diminuzione della concentrazione di protoni. Se fossero delle specie chimiche di tipo forte (acido forte o base forte) non potrebbero tornare indietro nella reazione di idrolisi. È molto improbabile che si torni verso la forma indissociata dell’acido. Ecco perché deve essere debole la tendenza della specie chimica ad andare verso la reazione di dissociazione.
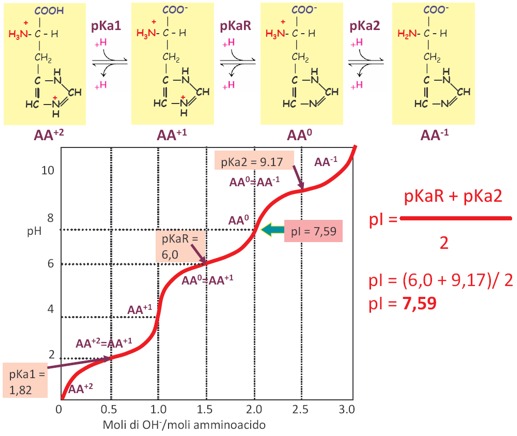
Tra i vari sistemi tampone che ci sono nelle cellule, i più importanti coinvolgono alcune proteine, in particolare l’amminoacido Istidina. Secondo la fondamentale equazione di Henderson Hasselbach, l’efficienza tamponante di una coppia tampone è molto maggiore quanto più vicini sono i valori del suo pKa con il pH. Ciò deriva dal fatto che in questa condizione le due concentrazioni del sale e dell’acido, che sono la forma dissociata e la forma indissociata dell’acido, se consideriamo un acido debole, sono uguali a 1, e quindi molto più facilmente possono contrastare l’aggiunta di un acido o di una base nel sistema biologico, mentre invece se noi avessimo un rapporto tra il sale e l’acido molto diverso da 1, allora questo andrebbe a favorire la forma acida o la forma basica, cioè il sale e l’acido della nostra coppia tampone. È quindi importantissimo che il valore del pKa della coppia tampone abbia un valore uguale, o comunque abbastanza vicino, al valore del pH fisiologico (pH=7,4). La Glicina dato che ha dei valori di pKa pari a 2,34 e a 9,6, non rappresenta un potenziale tampone biologico perché ha dei valori di pK molto distanti dal pH fisiologico. Mentre invece, tra gli amminoacidi, l’unico che può funzionare da tampone biologico è l’Istidina, perché nella catena laterale presenta l’anello imidazolico che possiede due protoni di cui uno dei due è ionizzabile, cioè può acquistare o perdere un protone, e quindi si può comportare come acido o base a seconda del pH in cui si viene a trovare; nella condizione di pH cellulare, acquistando o cedendo un protone, può tamponare un eventuale alterazione di pH e riesce a fare bene questo perché è caratterizzato da un pKaR (guardando la curva di titolazione dell’istidina), in cui c’è un punto di flesso aggiuntivo rispetto a quanto visto per la glicina perché c’è un terzo gruppo ionizzabile che è quello presente nella catena laterale, nell’anello imidazolico. Quindi ha il primo pKa che è 1,82 e si riferisce alla formazione dell’anione carbossile. Poi abbiamo l’ultimo pKa che è relativo al gruppo ammidico (il gruppo basico) che è 9,17. Nella porzione centrale della curva di titolazione c’è un terzo valore chiamato pKaR che è uguale a 6, un valore molto vicino al pH fisiologico e difatti è l’unico tra gli amminoacidi che presenta questo tipo di carattere chimico e come tale può funzionare da tampone biologico. È molto importante la capacità tamponante dell’istidina. Il pI dell’istidina è pari a 7,59 (ossia in corrispondenza di questo pH prevale la forma zwitterionica). Quindi, possiamo utilizzare questa equazione approssimata e definire la capacità tamponante di una specie chimica il cui pKa abbia un’oscillazione rispetto al pH di +1 o di -1 e l’istidina rientra perché ha un pKaR uguale a 6.
Classificazione
Gli amminoacidi presenti in natura, che costituiscono la maggior parte delle proteine se non tutte le proteine, sono in un numero abbastanza limitato. Ci sono 20 amminoacidi a cui dobbiamo aggiungere altri amminoacidi che sono stati scoperti negli ultimi decenni e che sono stati classificati come amminoacidi 21°esimo e 22°esimo e i cosiddetti “amminoacidi modificati” (ossia amminoacidi che vanno incontro a modificazioni post-traduzionali). I 20 amminoacidi standard possono essere suddivisi in 5 classi. Il criterio che è stato utilizzato per individuare queste classi è il carattere più o meno polare dell’amminoacido. La polarità indica il carattere idrofilo dell’amminoacido. Quindi, ci sono amminoacidi che sono idrofilici e amminoacidi che sono idrofobici e questo carattere polare o non polare è più o meno spiccato a seconda del tipo di amminoacido.
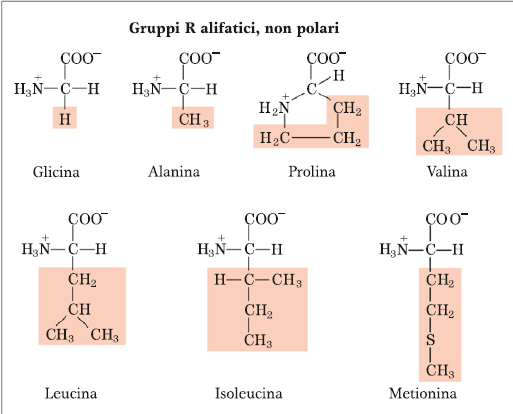
Amminoacidi Alifatici
Alifatico è un sinonimo di non-polare, o idrofobo o lipofilo. Di questa classe fanno parte i primi 7 amminoacidi che sono: Glicina, Alanina, Prolina, Valina, Leucina, Isoleucina e Metionina. Le catene laterali sono rappresentate, essendo molecole molto idrofobe, soltanto da carbonio e idrogeno, quindi sono dei derivati idrocarburici (alifatico è anche un sinonimo di idrocarburico) e come tali non c’è nessuna funzione chimica che possa reagire con l’acqua, né il C, né tantomeno l’H legato al C. Questo perché per il legame a idrogeno, è necessario che l’H sia legato ad un elemento con valore di elettronegatività superiore rispetto a quella del C. Il C ha una elettronegatività troppo piccola per poter giustificare l’interazione a ponte H e quindi la molecola è idrofobica. Tra questi amminoacidi abbiamo l’amminoacido più semplice che è la Glicina, la cui catena laterale è rappresentata dalla presenza di un altro H. La presenza di questo H ha un’importante conseguenza anche sulla configurazione dell’amminoacido, infatti la Glicina è l’unico dei 20 amminoacidi per il quale non possiamo distinguere le due forme configurazionali di enantiomeri di tipo D o di tipo L, mentre invece per tutti gli altri possiamo distinguere le due forme enantiomeriche. Per quanto riguarda la Prolina, più che un amminoacido è definito come imminoacido perché la catena laterale oltre che sul C alfa è legata anche sull’N amminico a formare una struttura ciclica che ha delle importanti conseguenze nella costituzione della catena polipeptidica e nel tipo di struttura a cui può andare incontro la proteina che si forma. Quindi, inserire la prolina in uno scheletro polipeptidico è come inserire un elemento di rigidità. Poi abbiamo Valina, Leucina ed Isoleucina che sono altamente idrofobici. E infine la Metionina, l’unico amminoacido (insieme alla Cisteina che invece fa parte degli amminoacidi polari) che contiene lo zolfo legato con due C idrocarburici. E quindi la presenza dello S la distingue da tutti gli altri amminoacidi, e la Metionina entra in una particolare via metabolica che si chiama “Via del metile attivato” perché rappresenta uno dei più importanti donatori di gruppi metilici durante tutto il metabolismo, quindi entra in questa via specializzata della cellula proprio perché la presenza dello S rende trasferibile facilmente il gruppo metilico ad un accettore, che abbia delle particolari caratteristiche chimiche. La presenza dello S giustifica una elevata reattività di questo gruppo metilico che invece non si ha per esempio sull’Isoleucina dove si ha un legame covalente omopolare tra un C e un altro C.
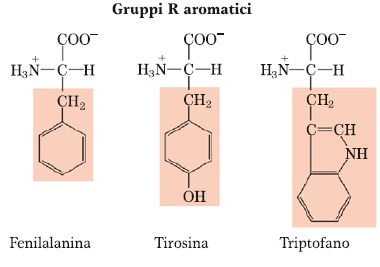
Amminoacidi Aromatici
Amminoacidi in cui è presente l’anello benzenico o fenilico. Il primo è la Fenilalanina che, come si può notare dal nome, è un derivato dell’alanina perché l’alanina ha un gruppo metilico e se un atomo di H del gruppo metilico dell’alanina lo sostituiamo col gruppo benzenico otteniamo la Fenilalanina. La Tirosina è praticamente identica alla Fenilalanina soltanto che presenta un gruppo ossidrilico in posizione para rispetto al gruppo metilenico. La presenza di questo gruppo ossidrilico in alcuni casi giustifica una certa, seppur molto limitata, idrofilicità della molecola perché questo gruppo è capace di per sé di formare ponti a H, sebbene il resto della catena laterale sia molto idrofobico. Inoltre, questo gruppo ossidrilico permette le cosiddette modificazioni post-traduzionali delle proteine. Le modificazioni avvengono in senso attivatorio o inibitorio, sono degli effettori di tipo positivo oppure negativo della proteina. In uno scheletro polipeptidico, non tutti gli amminoacidi possono essere modificati con l’aggiunta o rimozione di questi gruppi, ma soltanto quegli amminoacidi che hanno delle funzioni chimiche in grado di reagire. Per esempio, col gruppo fosforico, uno dei gruppi che maggiormente può reagire con esso, è il gruppo ossidrilico OH e infatti il residuo dell’amminoacido Tirosina rappresenta uno degli amminoacidi in moltissime proteine che è soggetto a questo tipo di modificazione. Per quanto riguarda il Triptofano esso è caratterizzato dalla presenza oltre che del gruppo Fenilico/Benzenico, anche dalla presenza di un Indolo, quindi ha una catena laterale un po’ più complessa. È uno degli amminoacidi meno presenti in una casistica di proteine costituita da un numero superiore a 1000 proteine, quindi è uno degli amminoacidi meno presenti.
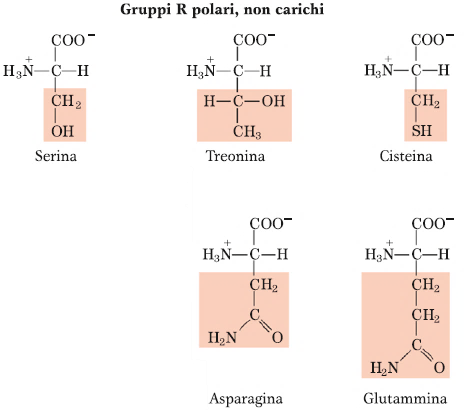
Amminoacidi polari, non carichi
Gli amminoacidi polari non carichi sono 5: Serina, Treonina, Cisteina, Asparagina e Glutammina. Questi amminoacidi, che presentano un carattere idrofilico o idrofilo, sono caratterizzati tutti da gruppi che possono creare dei ponti a H. La Serina col gruppo OH, la Treonina con un gruppo OH, l’Asparagina e la Glutammina con il loro gruppo amminico. L’Asparagina e la Glutammina, in particolare, come si può notare dalla struttura, possono essere considerati come dei derivati di altri amminoacidi che sono Aspartato e Glutammato, perché contengono questo legame di tipo ammidico con un gruppo amminico aggiuntivo, laddove nell’Aspartato e Glutammato vi è la funzione carbossilica.
Per quanto riguarda la Cisteina, invece, presenta un gruppo Tiolico, o Sulfidrilico (-SH) che è fondamentale nel mondo biologico. Il gruppo -SH in generale, riveste un’importanza fondamentale perché può andare incontro a reazioni di tipo redox e quindi può funzionare da difesa anti-ossidante della cellula. Con la reazione di ossidazione a cui vanno incontro 2 residui di Cisteina si ha la formazione del cosiddetto Ponte Disolfuro.
Le reazioni redox non avvengono mai soltanto nel verso della riduzione o nel verso dell’ossidazione ma si accompagnano sempre tra di loro, cioè abbiamo sempre una semi-reazione di ossidazione e una semi-reazione di riduzione.
Oltre a questa funzione anti-ossidante dei gruppi tiolici in generale, in realtà, scendendo nello specifico della Cisteina, la formazione del ponte disolfuro rappresenta anche una funzione molto importante nella cosiddetta formazione della struttura terziaria delle proteine perché la creazione di ponti di solfuro è uno degli aspetti chimici che si ha nel processo di folding delle proteine. Quindi, questi punti disolfuro in uno scheletro polipeptidico si possono formare soltanto tra molecole di Cisteina poiché è l’unico amminoacido che possiede il gruppo tiolico. Il dimero costituito da due residui di Cisteina si chiama Cistina.
Quando si parla di amminoacidi, spesso o sempre si utilizza il termine “residui amminoacidici”, in quanto negli amminoacidi che fanno parte di una catena polipeptidica (schema polipeptidico di una proteina) tale termine sta ad indicare ciò che rimane (il residuo) dopo la formazione del legame peptidico che è alla base dell’unione degli amminoacidi nella catena polipeptidica.
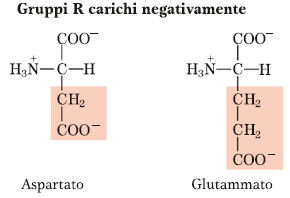
Amminoacidi acidi
Amminoacidi che nella catena laterale contengono un secondo gruppo carbossilico oltre al gruppo carbossilico presente nella struttura di base di tutti gli amminoacidi legato al carbonio alfa. Si tratta dell’aspartato e del glutammato, in cui la struttura è molto simile, ma la differenza è di un gruppo metilenico in più.
Per quanto riguarda la curva di titolazione degli amminoacidi acidi, avremo quattro specie chimiche che si succedono durante la titolazione di questi amminoacidi e si comportano come acidi triprotici. Quello che succede durante l’operazione di titolazione deve essere la rimozione sequenziale dei vari protoni, legati due sui due gruppi carbossilici (sul carbonio alfa e sul carbonio gamma della catena laterale) e il terzo protone che viene allontanato è quello del gruppo basico presente sul carbonio alfa: avremo quindi quattro forme ioniche dell’amminoacido in equilibrio per loro. Perciò dobbiamo considerare tre valori di pKa che corrispondono ai tre equilibri che si instaurano tra le diverse forme: amminoacido carico positivamente, amminoacido in forma zwitterionica, amminoacido con una carica negativa e amminoacido con due cariche negative. Questi pK sono indicati con pKa1 (valore del pK relativo al guppo carbossilico in alfa, quindi il COOH legato al carbonio alfa ha il carattere più acido), pKaR (valore del pK relativo al gruppo carbossilico della catena laterale, quindi gruppo carbossilico gamma), pKa2 (che rappresenta la fase di deprotonazione del gruppo amminico più basico).
Amminoacidi basici
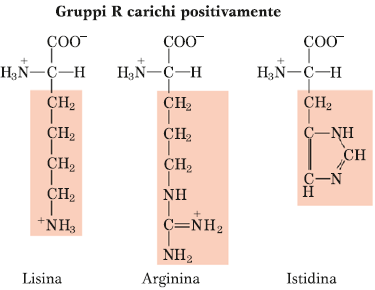
Amminoacidi con carattere chimico opposto al gruppo precedente e sono lisina, arginina e istidina. Essi presentano una carica netta positiva a pH fisiologico, soprattutto la lisina e l’arginina.
L’istidina, invece, poiché presenta una struttura limite, ha una situazione limite anche per quanto riguarda la carica netta positiva, in quanto sulla catena laterale essa presenta l’anello imidazolico, che conferisce la capacità di funzionare come sistema tampone. Quindi piccole oscillazioni di pH intorno al pH fisiologico fanno comportare questo anello imidazolico dell’istidina sia da base che da acido (carattere anfoterico).
Amminoacidi non comuni
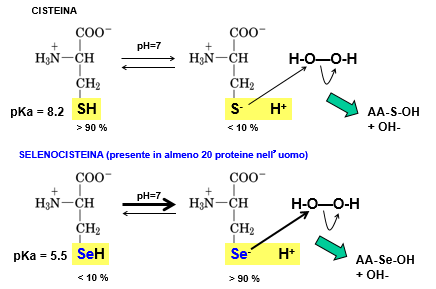
Gli amminoacidi proteinogenici standard (che danno origine alle proteine) sono 20 e sono codificati dal codice genetico universale, ossia uguale in tutti gli organismi, dal più semplice al più complesso. Ogni amminoacido corrisponde, durante il processo di decodificazione, a una tripletta di basi sul filamento di mRNA e a questi, negli ultimi anni, sono stati aggiunti altri due amminoacidi: la selenocisteina e la pirrolisina. Questi due amminoacidi sono abbastanza rari e sono introdotti durante la sintesi delle proteine. Contrariamente a quanto si potrebbe pensare, la selenocisteina, durante la biosintesi degli amminoacidi, non deriva dalla cisteina ma dalla serina. Inizialmente si percorre la via di sintesi della serina e poi, ad un certo punto, dato che la serina e la selenocisteina differiscono solo per un atomo di O nella serina e un atomo di Se nella selenocisteina, viene introdotto il gruppo SeH della selenocisteina al posto del gruppo idrossilico presente nella serina.
La selenocisteina è quindi caratterizzata dalla presenza di Se (selenio), elemento chimico facente parte dello stesso gruppo dell’ossigeno e dello zolfo e presenta perciò proprietà chimiche molto simili, non del tutto uguali a quelle dell’ossigeno e dello zolfo, ma non la capacità di formare due legami covalenti. Gli orbitali che sono convolti nella formazione dei legami covalenti del selenio rispetto allo zolfo e all’ossigeno sono differenti: questa è la principale diversità tra selenio e zolfo, zolfo e ossigeno (può aumentare il carattere acido o basico degli elementi a cui sono legati). La selenocisteina ha un’importanza biologica nelle proteine in cui è presente (nelle proteine dell’uomo la percentuale con cui è presente è molto più bassa rispetto agli altri amminoacidi), svolgendo la funzione fondamentale nota come proprietà antiossidante. Ciò si può notare dalle due reazioni di detossificazione da perossido di idrogeno (H2O2, la comune acqua ossigenata), che è una molecola molto dannosa a livello cellulare insieme ad altre specie radicaliche dell’ossigeno che prendono tutte il nome di ROS (Reactive Oxygen Species), ossia specie reattive dell’ossigeno che vengono prodotte a livello cellulare in maniera fisiologica e che non solo svolgono solo una funzione tossica per le cellule ma intervengono nei processi dei “ROS Signaling”, ossia nelle vie di biosegnalazione all’interno della cellula e sono segnalatori per il trasferimento di informazioni all’interno della cellula. Tra i ROS oltre al perossido di ossigeno, troviamo anche l’anione superossido (●O2–) e il radicale ossidrilico (●OH–); essi sono accomunati dalla loro particolare reattività, essendo specie chimiche molto instabili che tendono a reagire con le molecole che si trovano intorno (quindi ad esempio, nell’ambiente cellulare attaccano i lipidi di membrana, comportando la perossidazione lipidica che protratta nel tempo causa la rottura delle membrane con tutto l’effetto negativo che ne può derivare; oppure possono causare mutazioni a livello del filamento polinucleotidico del DNA, soprattutto a livello mitocondriale). Le due funzioni dei ROS (tossica e di biosegnalazione) agiscono secondo una questione di concentrazione e di tempo: se la concentrazione di queste sostanze viene mantenuta al di sotto di un certo limite allora funzionano come biosegnalatori in un arco di tempo abbastanza ristretto; quando invece la loro concentrazione aumenta oltre un certo limite allora i ROS esplicano la loro funzione biologicamente dannosa.
La selenocisteina si inserisce quindi come detossificatore, cioè come sostanza che detossifica. Tra i sistemi di difesa ci sono i cosiddetti enzimi antiossidanti (es. la catalasi, la superossido dismutasi o SOD), che sono presenti in tutte le cellule, ma in quantità diverse e in isoforme diverse (es. 2 isoforme per la catalasi, 3 per la dismutasi). Con il termine “isoforme” si indicano quelle proteine che svolgono la stessa funzione ma sono differenti per la loro sequenza amminoacidica, per la distribuzione tissutale, oppure differiscono nella distribuzione all’interno della cellula in organuli particolari o nel citoplasma (es. per la SOD ci sono delle isoforme citoplasmatiche e almeno una isoforma mitocondriale, la SOD3). Generalmente le isoforme di un enzima o di una proteina vengono distinte con dei numeri (es. SOD1, SOD2, SOD3 – quello che cambia tra la SOD1 e la SOD3 è la presenza del cofattore metallico che interviene nella reazione di detossificazione).
Oltre alla presenza di questi enzimi antiossidanti, come sistemi di difesa, ci sono anche delle piccole molecole che funzionano da antiossidanti, in modo tale che questo danno ossidativo provocato alla cellula venga mantenuto ad un livello il più basso possibile. Si può fare riferimento anche alla teoria dell’invecchiamento, secondo la quale ci sarebbe, alla base dell’invecchiamento cellulare, quindi della disfunzione organica cui va incontro l’organismo umano con il passare degli anni, una sovrapproduzione di ROS e un deficitario funzionamento di questi sistemi antiossidanti, che quindi non si bilanciano tra loro.
La selenocisteina a pH fisiologico svolge una funzione antiossidante migliore rispetto alla cisteina. Il valore del pKa della cisteina è uguale a 8.2 e in corrispondenza di questo valore di pH abbiamo una uguale concentrazione della forma dissociata del sale rispetto all’acido. All’interno delle nostre cellule, però, il pH fisiologico è pari a 7.4, quindi inferiore a 8.2, quindi la cisteina sarà predominante nella forma protonata e perciò non può funzionare come acido debole e non può detossificare la cellula da eventuali molecole di ROS. Viceversa la selenocisteina, proprio grazie alla presenza del selenio al posto dello zolfo, ha un pKa di 5.5, inferiore al pH fisiologico; essa è quindi presente nella forma deprotonata e con la carica negativa può fungere da sistema antiossidante della cellula. Ciò si evince anche dai valori percentuali: a pH fisiologico la cisteina è presente al 90% nella forma protonata e al 10% nella forma deprotonata, quindi funge da acido debole ma in percentuale molto bassa; viceversa la selenocisteina è presente al 90% in forma deprotonata e 10% protonata, quindi può fungere da sistema antiossidante facendo reazioni di questo tipo.
Proteine di rilevanza biologica che contengono la selenocisteina sono per lo più enzimi antiossidanti quale la glutatione perossidasi, che è un enzima che ci difende dall’azione dannosa dei perossidi e agisce con meccanismi molto simili a quelli della catalasi, che appartiene sempre alla famiglia delle perossidasi. L’azione della glutatione perossidasi è quindi quella di convertire l’H2O2 (reso dannoso e instabile per la presenza del legame tra i due atomi di ossigeno) in acqua e ossigeno, che sono molto meno reattivi e più stabili.
Altri amminoacidi non comuni, ossia che non si trovano nelle proteine, sono la 4-idrossiprolina, la 5-idrossilisina, la 6-n-metil lisina, il γ-carbossiglutammato e la desmosina.
La 4-idrossiprolina è un amminoacido che deriva dall’amplificazione della prolina: sul C4 della catena laterale della prolina è inserito un gruppo ossidrilico. Esso si trova in proteine con ruolo prettamente strutturale, come il collagene: questo è una delle proteine più abbondanti nel nostro corpo dato che è una delle molecole dominanti in tutti i tessuti connettivi.
La 5-idrossilisina deriva dall’amplificazione post-traduzionale della lisina ed è presente anche nel collagene. La 6-n-metil lisina deriva anche essa dalla lisina.
Il γ-carbossiglutammato è un amminoacido derivante dal glutammato amplificato: sul carbonio-γ della catena laterale del glutammato viene aggiunto un gruppo carbossilico. A pH fisiologico, questo residuo amminoacidico, rispetto al solito glutammato, invece di avere una carica negativa ne ha due. Queste due cariche negative presenti sul γ-carbossiglutammato lo rendono attivo in fasi particolari della cascata coagulativa. Infatti l’amminoacido entra a far parte di uno degli enzimi principali agenti nella cascata coagulativa, la protrombina e rappresenta un punto di legame molto forte (per la presenza delle due cariche negative) per gli ioni calcio.
La desmosina è una molecola abbastanza complessa caratterizzata dalla presenza di un anello pirimidinico al centro, da cui si dipartono quattro bracci di residui lisinici, quindi quattro molecole di lisina legate agli atomi di carbonio di un anello pirimidinico al centro della molecola. Si trova in una proteina con ruolo strutturale, detta elastina.
Oltre a questi sono stati descritti altri 300 amminoacidi, che svolgono particolari funzioni all’interno della cellula; tuttavia quelli sopracitati sono quelli più importanti perché più abbondanti anche per il tipo di funzionalità che svolgono.
Amminoacidi essenziali e non essenziali
Nell’ambito degli amminoacidi bisogna fare una distinzione tra quelli essenziali e quelli non essenziali: gli amminoacidi che riusciamo a sintetizzare, quindi, si formano all’interno delle nostre cellule, indipendentemente dall’alimentazione (non essenziali) e quelli che, invece, devono essere introdotti con la dieta, perché non sintetizzabili all’interno del nostro organismo (essenziali).
Gli amminoacidi essenziali sono: arginina ed istidina (importanti soprattutto durante il periodo di crescita nell’individuo molto giovane), isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano e valina. Gli amminoacidi non essenziali sono: alanina, asparagina, aspartato, cisteina (che può derivare dalla metionina introdotta con la dieta), glutammato, glutammina, glicina, prolina, serina e tirosina (che può derivare dalla fenilalanina, perché l’unica differenza tra di loro è la presenza del gruppo ossidrilico nella catena laterale).
Per quanto riguarda la richiesta giornaliera di alimenti proteici, cioè di amminoacidi essenziali e non essenziali, è inversamente correlato con l’età: più un individuo è giovane, maggiore sarà la richiesta di alimenti contenenti amminoacidi non essenziali oppure essenziali, perché questo corrisponde ad una fase di maggiore crescita tissutale (fascia 0-12 mesi oppure 10-12 anni oppure nell’individuo adulto).