Esiste un’importante categoria di sostanze che sono classificate come Tamponi Biologici. All’interno del nostro organismo, affinché possano essere efficienti tutte le varie potenzialità dell’organismo, c’è bisogno del mantenimento intorno a valori prefissati molto precisi di alcuni parametri fisico-chimici tra cui la temperatura e il pH. La stragrande maggioranza degli enzimi hanno un optimum di funzionalità in corrispondenza del pH fisiologico, gli enzimi gastrici funzionano in corrispondenza di pH molto bassi. E quindi è assolutamente necessario impedire oscillazioni troppo grandi del pH, difatti sono tollerate delle oscillazioni rispetto a 7,4 di al massimo 0,2 unità di pH, in su o in giù. Per contrastare queste oscillazioni all’interno della cellula ci sono dei sistemi chimici che funzionano come i sistemi tampone classici che vengono studiati nella chimica, l’esempio classico in chimica generale è l’Acido Acetico con l’Acetato di Sodio, mentre per i sistemi biologici abbiamo il sistema CO2/Acido Carbonico o Acido Carbonico/Bicarbonato. La cosa fondamentale è che anche i sistemi tampone biologici funzionano nello stesso modo dell’acido acetico/acetato di sodio e sono costituiti da un acido debole e dal sale formato dalla sua base coniugata. Devono avere delle caratteristiche di acido debole oppure di base debole perché devono contrastare l’aggiunta oppure la diminuzione della concentrazione di protoni e se fossero delle specie chimiche di tipo forte (acido forte o base forte) non potrebbero tornare indietro nella reazione di idrolisi. Se noi per esempio volessimo utilizzare l’HCl oppure un altro acido forte, è molto improbabile che le due specie chimiche che si dissociano dall’HCl, quindi H+ e Cl–, tornino in questa reazione che è completamente spostata verso la formazione dell’H+ e del Cl–. È molto improbabile che si torni verso la forma indissociata dell’acido. Ecco perché deve essere debole la tendenza della specie chimica ad andare verso la reazione di dissociazione.
Istidina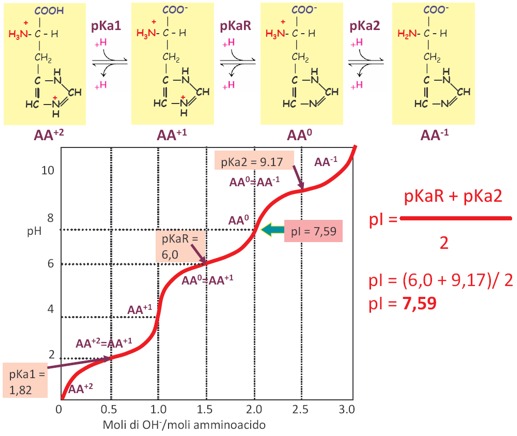
Tra i vari sistemi tampone che ci sono nelle cellule, i più importanti coinvolgono alcune proteine, in particolare l’amminoacido Istidina. Secondo la fondamentale equazione di Henderson Hasselbach, l’efficienza tamponante di una coppia tampone è molto maggiore quanto più vicini sono i valori del suo pKa con il pH. Ciò deriva dal fatto che in questa condizione le due concentrazioni del sale e dell’acido, che sono la forma dissociata e la forma indissociata dell’acido, se consideriamo un acido debole, sono uguali a 1, e quindi molto più facilmente possono contrastare l’aggiunta di un acido o di una base nel sistema biologico, mentre invece se noi avessimo un rapporto tra il sale e l’acido molto diverso da 1, allora questo andrebbe a favorire la forma acida o la forma basica, cioè il sale e l’acido della nostra coppia tampone. È quindi importantissimo che il valore del pKa della coppia tampone abbia un valore uguale, o comunque abbastanza vicino, al valore del pH fisiologico (pH=7,4). La Glicina dato che ha dei valori di pKa pari a 2,34 e a 9,6, non rappresenta un potenziale tampone biologico perché ha dei valori di pK molto distanti dal pH fisiologico. Mentre invece, tra gli amminoacidi, l’unico che può funzionare da tampone biologico è l’Istidina, perché nella catena laterale presenta l’anello imidazolico che possiede due protoni di cui uno dei due è ionizzabile, cioè può acquistare o perdere un protone, e quindi si può comportare come acido o base a seconda del pH in cui si viene a trovare; nella condizione di pH cellulare, acquistando o cedendo un protone, può tamponare un eventuale alterazione di pH e riesce a fare bene questo perché è caratterizzato da un pKaR (guardando la curva di titolazione dell’istidina), in cui c’è un punto di flesso aggiuntivo rispetto a quanto visto per la glicina perché c’è un terzo gruppo ionizzabile che è quello presente nella catena laterale, nell’anello imidazolico. Quindi ha il primo pKa che è 1,82 e si riferisce alla formazione dell’anione carbossile. Poi abbiamo l’ultimo pKa che è relativo al gruppo ammidico (il gruppo basico) che è 9,17. Nella porzione centrale della curva di titolazione c’è un terzo valore chiamato pKaR che è uguale a 6, un valore molto vicino al pH fisiologico e difatti è l’unico tra gli amminoacidi che presenta questo tipo di carattere chimico e come tale può funzionare da tampone biologico. È molto importante la capacità tamponante dell’istidina. Il pI dell’istidina è pari a 7,59 (ossia in corrispondenza di questo pH prevale la forma zwitterionica). Quindi, possiamo utilizzare questa equazione approssimata e definire la capacità tamponante di una specie chimica il cui pKa abbia un’oscillazione rispetto al pH di +1 o di -1 e l’istidina rientra perché ha un pKaR uguale a 6.
Acido carbonico/ione bicarbonato
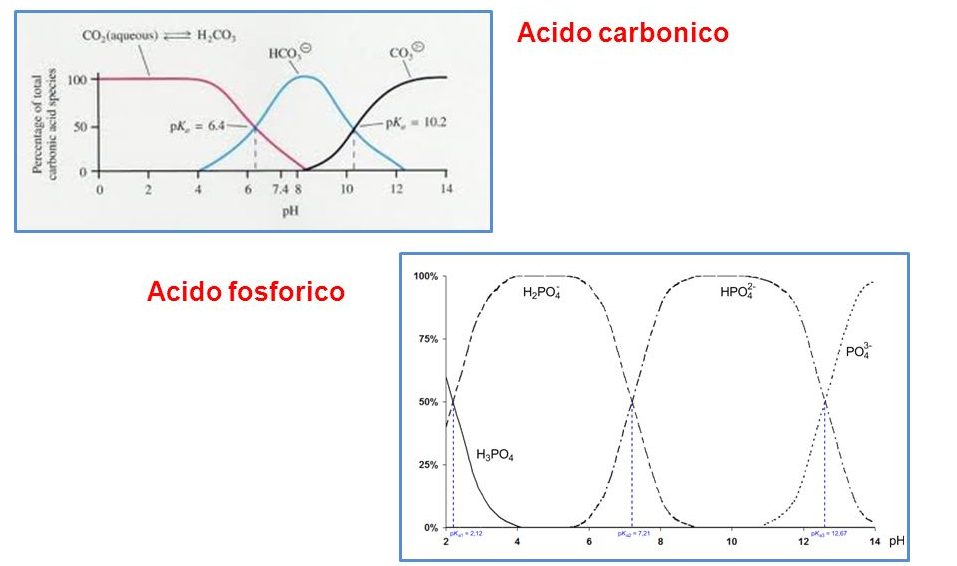
Un altro sistema tampone biologicamente rilevante è il sistema tampone costituito dalla coppia acido carbonico (debole) con la sua base coniugata ione bicarbonato, che presenta un pKa di 6.1. Esso può svolgere la sua azione tamponante nell’intervallo di pH compreso tra +1 e -1, cioè tra 7.1 e 5.1. La particolarità di questo equilibrio chimico da acido carbonico a ione bicarbonato è che è molto spostato verso destra: poiché l’acido carbonico spontaneamente si dissocia nelle due forme ioniche che lo costituiscono (H+ e HCO3–), ci sarebbe ipoteticamente un valore di pKa molto più alto rispetto a quello effettivo che invece si registra a livello intracellulare. Questo perché in realtà l’equilibrio chimico è un po’ più complesso rispetto al solito equilibrio del sistema tampone, cioè acido debole e base coniugata, perché interviene anche la fase gassosa, da cui deriva poi l’acido carbonico che è la CO2: soprattutto nei tessuti che sono metabolicamente molto attivi e dove c’è una forte produzione di CO2, perché rappresenta uno dei prodotti finali principali del catabolismo. L’aumento di CO2 provoca l’aumento di H2CO3. La CO2 è un gas che in soluzione acquosa e in tutti gli ambienti intra ed extracellulari, va incontro immediatamente a questo equilibrio tramite un enzima presente in tutte le cellule che si chiama anidrasi carbonica (la reazione è H2O + CO2 → H2CO3). È vero che l’equilibrio è spostato verso destra, però interviene la produzione di CO2 per ripristinare l’equilibrio.
Tampone fosfato
Un terzo tipo di tampone biologico molto importante, anche se la sua concentrazione è molto inferiore rispetto alla coppia acido carbonico/ione bicarbonato: è il tampone fosfato. L’acido ortofosforico H3PO4 presenta tre tipi di dissociazione acida, ognuno dei quali corrisponde ad una costante di dissociazione acida e quindi ad un valore di pKa. L’equilibrio chimico che può essere utile ai fini del funzionamento da tampone biologico (a pH 7) è quello che presenta un pKa molto vicino al pH fisiologico: sono perciò da scartare i valori di pKa 2,16 e 12,32. Viceversa la coppia H2PO4–/HPO42- (rispettivamente l’acido debole e la sua base coniugata) funzionano come sistema tampone biologico: infatti a pH fisiologico, le concentrazioni del sale HPO42- e dell’acido H2PO4– sono più o meno uguali e quindi possono controbilanciare oscillazioni del pH, nonostante la concentrazione sia molto minore rispetto alla coppia acido carbonico/ione bicarbonato. Sebbene i fosfati non siano quantitativamente rappresentati nel sangue come i bicarbonati (per ovvi motivi, poiché la CO2, che è il maggiore prodotto di scarto della cellula, ha una concentrazione molto più elevata rispetto allo ione fosfato), il loro valore di pKa 7.2, molto prossimo al pH fisiologico del sangue, gli conferisce un elevato potere tampone.