Negli animali il glucosio in eccesso viene convertito in glicogeno per lo stoccaggio, nelle piante invece viene convertito in amido.
Il glicogeno è un omopolisaccaride costituito da unità ripetute di glucosio. I legami tra i monomeri sono di tipo α1→4, con ramificazioni ogni 8-12 unità legate al carbonio 6 del glucosio dal quale prendono origine (legami delle ramificazioni: α1→6). Questo polisaccaride si trova nel citosol delle cellule di muscolo e fegato, condensato in grossi granuli. Nei granuli si trovano legati al glicogeno gli enzimi necessari per la sintesi e la degradazione di quest’ultimo. Ogni ramificazione termina con un residuo non riducente, sono quindi molto numerose queste estremità in ogni molecola di glicogeno. Viceversa si incontra una sola estremità riducente per ogni molecola. Gli enzimi che degradano la macromolecola si attaccano alle numerose estremità non riducenti e agiscono simultaneamente, permettendo una veloce degradazione del glicogeno.
Le riserve di glicogeno epatico sono utilizzate per assicurare il mantenimento della concentrazione di glucosio ematico tra un pasto e l’altro e, comunque, per un intervallo di tempo non superiore alle 12-18 ore. Il glicogeno muscolare, invece, si esaurisce in meno di un’ora durante un’intensa attività.
GLICOGENOLISI
La glicogenolisi è la degradazione del glicogeno con produzione di glucosio 1-fosfato (G1P) che sarà convertito in glucosio 6-fosfato (G6P). In questo processo entrano in gioco 3 enzimi:
- glicogeno fosforilasi: rompe legami α1→4 glicosidici con rilascio di glucosio 1-fosfato (circa 90%);
- enzima deramificante: rompe legami α1→6 glicosidici con rilascio di glucosio libero (10%);
- fosfoglucomutasi: converte il G1P in G6P.
Glicogeno fosforilasi
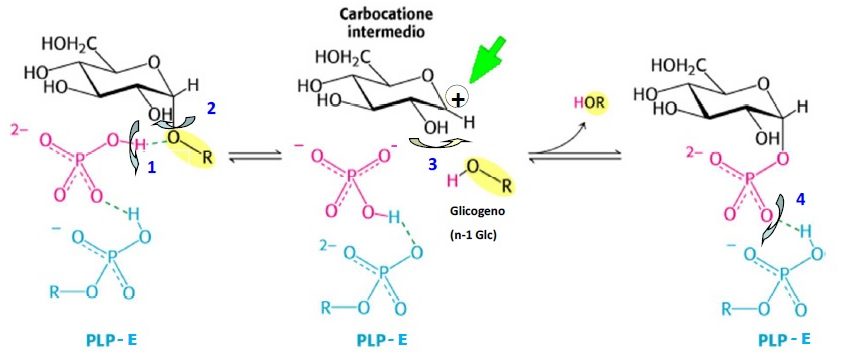
L’enzima glicogeno fosforilasi rompe legami α 1→4 glicosidici tra due residui di glucosio situati all’estremità non riducente di una catena. Rilascia come prodotto il glucosio 1-fosfato. Questa reazione è detta fosforolitica poiché il legame viene scisso da un fosfato inorganico (Pi). L’enzima necessita del cofattore piridossal fosfato (PLP) che agisce da catalizzatore acido generale promuovendo l’attacco da parte del Pi sul legame glicosidico.
Al PLP è legato, mediante legame idrogeno un Pi. Questo enzima può agire ripetutamente sulle estremità non riducenti fino a che non arriva a 4 monomeri di distanza da una ramificazione. A quel punto deve intervenire l’enzima deramificante.
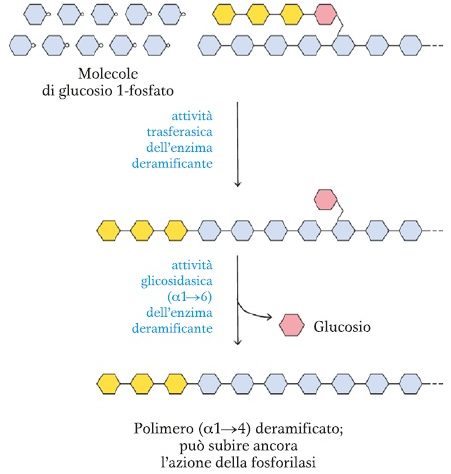
Enzima deramificante
L’enzima deramificante (oligo (α1→6) (α1→4) glucantrasferasi) catalizza il trasferimento della ramificazione sulla catena principale.
Il legame α1→6 che trattiene l’ultima molecola di glucosio dell’ex ramificazione viene idrolizzato, con liberazione di glucosio libero.
Questo enzima ha quindi sia attività trasferasica che glicosidica.
La successione degli eventi che portano alla formazione del G6P termina con la conversione del G1P in G6P, catalizzata dall’enzima fosfoglucomutasi.
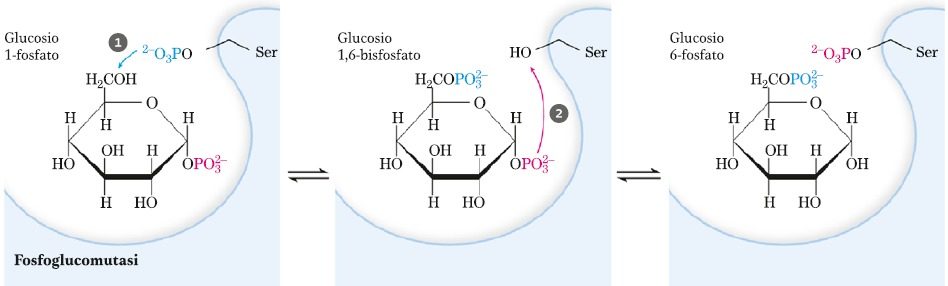
Fosfoglucomutasi
Questo enzima determina la conversione del G1P in G6P che può essere defosforilato dalla glucosio-6 -fosfatasi e divenire glucosio libero.
Quest’ultimo enzima è presente solo nelle cellule di fegato e rene, il cui sito attivo è rivolto verso il lume del reticolo endoplasmatico per essere poi immenso nel torrente ematico.
GLICOGENOSINTESI
La glicogenosintesi avviene nelle cellule epatiche e muscolari. Richiede UDP-glucosio, un primer e 2 enzimi (glicogeno sintasi ed enzima ramificante).
Sintesi UDP-glucosio (uridina difosfoglucosio)
Le reazioni di glicogenosintesi si servono di zuccheri legati a nucleotidi per 4 ragioni:
- la loro formazione è irreversibile, questo contribuisce a rendere irreversibili anche i processi biosintetici di cui sono intermedi;
- le trasformazioni chimiche che avvengono negli zuccheri legati a nucleotidi non coinvolgono gli atomi dei nucleotidi. Tuttavia questi ultimi possono potenzialmente dare origine a interazioni non covalenti;
- i gruppi nucleotidici sono eccellenti gruppi uscenti (attivano il carbonio a cui sono legati rendendolo più disponibile ad attacchi di nucleofili);
- i gruppi nucleotidici legati agli zuccheri possono fare da “etichetta” per questi ultimi, permettendo l’instradamento verso determinate reazioni (ad esempio biosintesi del glicogeno).
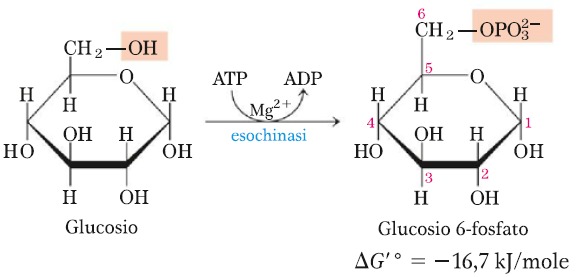
La prima reazione che avviene è la conversione del glucosio in glucosio 6-fosfato grazie all’enzima esochinasi. Il glucosio assunto durante i pasti viene prima convertito in lattato dagli eritrociti e poi convertito in glucosio 6-fosfato nel fegato.
La seconda reazione è la conversione del glucosio 6-fosfato in glucosio 1-fosfato tramite l’enzima fosfoglucomutasi.
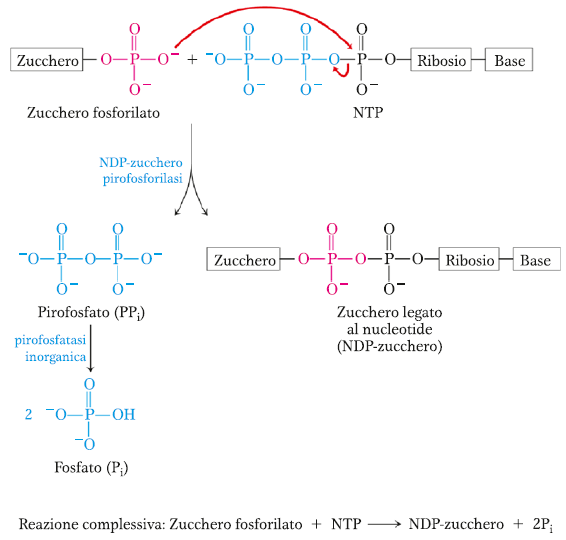
La terza reazione è la formazione di UDP-glucosio. Per fare ciò il glucosio 1-fosfato viene legato ad una molecola di UTP con formazione di UDP-glucosio e pirofosfato. La UDP-glucosio pirofosforilasi catalizza questa reazione. Il PPi che si forma viene rapidamente degradato dalla pirofosfatasi inorganica con formazione di 2 Pi.
Glicogeno sintasi
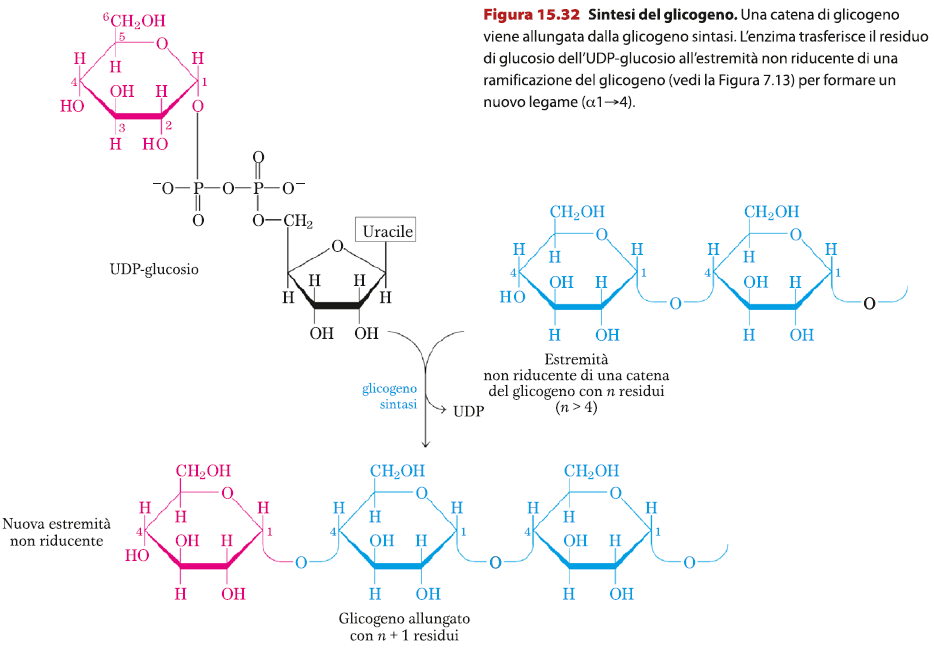
La glicogeno sintasi catalizza l’attacco di un UDP-glucosio ad un’estremità non riducente di un primer, formando legami di tipo α1→4. Questo enzima però non può formare legami di tipi α1→6, necessari per la costruzione di ramificazioni. Per adempire a questo compito interviene la amilo (α1→4) (α1→6) transglicosilasi anche detto glicosil-(4→6)-trasferasi che catalizza il trasferimento di un segmento terminale di 6 o 7 residui dall’estremità non riducente di una catena lunga almeno 11 residui, al gruppo ossidrico sul C6 di un glucosio più interno della stessa catena (o anche di un’altra).
Le ramificazioni servono per permettere la formazione di più estremità non riducenti (che implica più punti di attacco per glicogeno sintasi/fosforilasi), nonché anche ad aumentare l’interazione col solvente acquoso.
Il primer può essere:
- un frammento di glicogeno presente in cellule in cui non è completamente depleto.
- una sequenza di residui di glucosio α1→4 sintetizzati da una proteina chiamata glicogenina.
- una ramificazione di almeno 8 residui di glucosio.
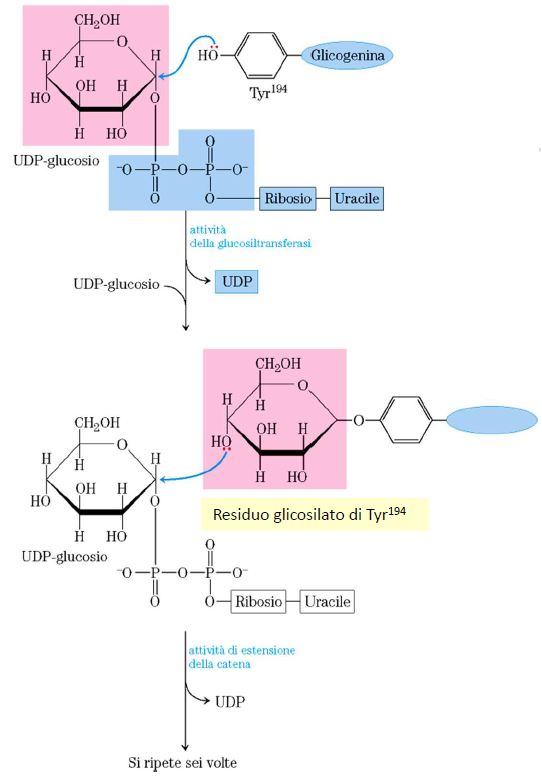
La proteina glicogenina catalizza la formazione del primer, sul quale poi potrà attaccarsi la glicogeno sintasi per continuare la sintesi del glicogeno. Il processo procede secondo le seguenti tappe:
- trasferimento di un residuo di glucosio dal UDP-Glu alla tirosina della glicogenina. Questa reazione è catalizzata dalla stessa glicogenina (attività della glucosiltransferasi).
- la catena nascente si estende per aggiunta successiva di altri 7 residui di glucosio, ciascuno derivante dall’UDP-Glu. Questa tappa è catalizzata sempre dalla glicogenina e si ripete 6 volte.
- interviene la glicogeno sintasi per proseguire l’allungamento della catena.
La glicogenina rimane intrappolata all’estremità riducente della catena di glicogeno.
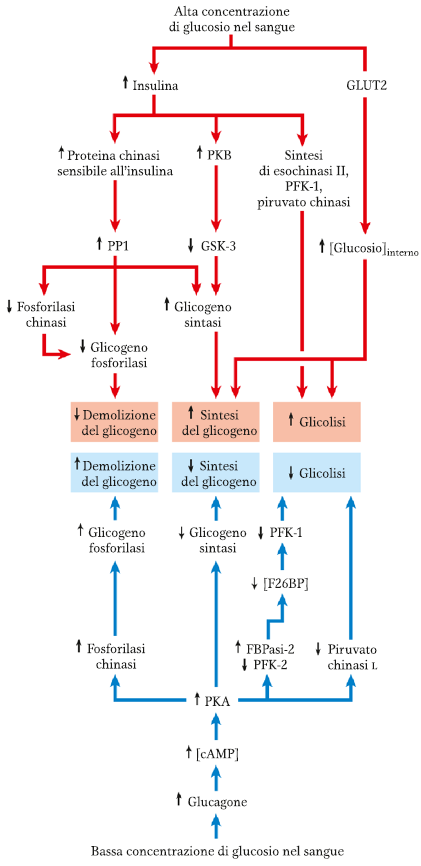
REGOLAZIONE COORDINATA DELLA SINTESI E DEMOLIZIONE DI GLICOGENO
Lo scopo della regolazione della glicogenosintesi e della glicogenolisi è quella di evitare un ciclo futile, impedendo che procedano contemporaneamente.
Per quanto riguarda la glicogeno fosforilasi è presente in due isoforme interconvertibili: glicogeno fosforilasi A (attiva, fosforilata) e B (meno attiva, defosforilata).
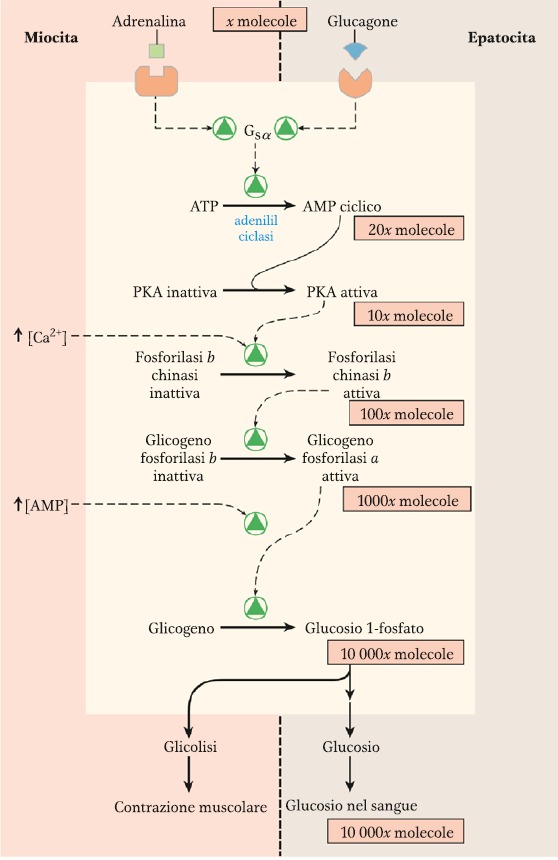
L’enzima fosforilasi B chinasi è responsabile della fosforilazione di una specifica serina della fosforilasi B per trasformarla in A. Questo enzima è stimolato dagli ormoni adrenalina (nel muscolo) e glucagone (nel fegato).
Nel muscolo, quando l’adrenalina si lega al proprio recettore, l’adenil ciclasi inizia a produrre cAMP. Questo secondo messaggero attiva la PKA cAMP-dipendente che a sua volta andrà a fosforilare la fosforilasi B chinasi. L’alta concentrazione di ione calcio intracellulare (dovuta alla contrazione del muscolo) promuove ancora di più la fosforilazione della fosforilasi B chinasi. Il Ca++ si andrà a legare alla fosforilasi B chinasi sulla calmodulina (subunità δ dell’enzima).
Questa chinasi andrà a catalizzare la fosforilazione della glicogeno fosforilasi B per trasformarla nella sua forma più attiva, la A. Quest’ultima poi provvederà alla degradazione del glicogeno per ottenere glucosio.
In seguito all’intenso sforzo muscolare ci sarà una alta concentrazione di AMP che fa da attivatore allosterico della glicogeno fosforilasi. Questo processo avviene quando il muscolo è in contrazione, in particolare durante il riflesso combatti o fuggi.
Nel muscolo a riposo la fosforilasi A fosfatasi (fosfoproteina fosfatasi 1, PP1) rimuove i gruppi P dalla fosforilasi A, convertendola nella sua forma meno attiva, B.
Nel fegato invece, la stessa cascata enzimatica è attivata dal glucagone, in seguito ad una condizione di scarsità di glucosio ematico. Gli enzimi della cascata epatica sono isozimi che rispondono a regolazioni allosteriche differenti. Quando la concentrazione ematica di glucosio torna normale, il glucosio penetra nell’epatocita e si lega alla fosforilasi A, fungendo da inibitore allosterico. Il legame col glucosio porta ad una modificazione conformazionale dell’enzima che esporrà i propri residui di serina fosforilati al PP1, per essere rimossi. La conseguenza finale quindi è l’inattivazione dell’enzima.
La glicogeno fosforilasi quindi fa da “sensore” per la concentrazione di glucosio e risponde adeguatamente alle variazioni.
Anche la glicogeno sintasi è presente in due isoforme: A (attiva, defosforilata) e B (inattiva, fosforilata).
La glicogeno sintasi (GYS) può essere fosforilata a livello di diversi residui da diversi enzimi. Tra questi il più importante è la glicogeno sintasi chinasi 3 (GSK3). Questo fosforila la GYS inattivandola (tranne se è presente G6P). La GSK3 però può agire solo dopo che la caseina chinasi II (CKII) ha fosforilato un’altra serina.
Nel fegato poi la conversione della GYS-B nella sua forma attiva è promossa dalla PP1. Questa rimuove i gruppi P dai residui di serina della GYS-B. Questo processo può avvenire però solo se è presente G6P legato ad un sito allosterico della GYS-B, in quanto lo zucchero espone i residui di serina fosforilati dell’enzima.
La glicogeno sintasi si comporta come un sensore per G6P, al contrario della glicogeno fosforilasi che agisce da sensore per il glucosio.
L’insulina è un attivatore della glicogeno sintasi, attiva la sintesi del glicogeno, ed è un inibitore della glicogeno fosforilasi, impedendo la demolizione di glicogeno. Il glucosio quindi entrerà nel fegato attraverso GLUT2 scatenando il rilascio della glucochinasi dal nucleo. A questo punto l’enzima convertirà il Glu in G6P per fornire precursori alle glicogenogenesi.
In condizioni di digiuno viene rilasciato glucagone. Questo si lega ai suoi recettori portando all’attivazione della PKA. Questa fosforila la fosforilasi chinasi (attivandola) e la glicogeno sintasi (inattivandola). La fosforilasi chinasi quindi andrà ad attivare la glicogeno fosforilasi che demolirà il glicogeno.
In una situazione di pericolo viene rilasciata adrenalina nel sangue. Questa attiva la PKA e fosforila la glicogeno fosforilasi chinasi, portando alla produzione di glucosio dal glicogeno. Lo ione Ca++ è un ulteriore stimolatore della glicogeno fosforilasi chinasi. Lo ione agisce ogni volta che avviene una contrazione muscolare, in maniera però più blanda rispetto all’adrenalina.
Ricapitolando, gli enzimi sono regolati allostericamente da:
- glicogeno fosforilasi (muscolare): ATP, AMP, G6P;
- glicogeno fosforilasi (epatica): ATP, GLU, G6P;
- glicogeno sintasi: G6P;
La glicogeno fosforilasi epatica è inibita dal Glu perché il compito del fegato è produrre glucosio che viene esportato ai vari tessuti quando la glicemia è bassa. Quindi se il glucosio è presente nel fegato, derivato da altre fonti come la dieta, non c’è necessità di mobilizzare il glicogeno. Diversamente dall’enzima muscolare, la fosforilasi epatica è insensibile alla regolazione da AMP perché il fegato non subisce quei cambiamenti drammatici in carica energetica che si verificano invece nel muscolo in contrazione.