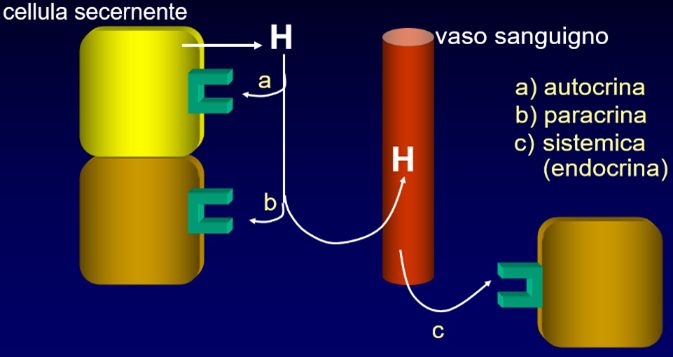
Gli ormoni sono gli “attori” del sistema endocrino, sostanze biologicamente attive, prodotte e secrete in circolo dalle cellule endocrine e capaci di regolare, attraverso l’interazione con specifici recettori, le funzioni di altre cellule, le cellule bersaglio. Queste ultime possono essere localizzate a distanza e raggiungibili tramite il circolo sanguigno (azione endocrina o sistemica), essere contigue alle cellule secernenti tramite il liquido interstiziale (azione paracrina) e/o coincidere con esse (azione autocrina).
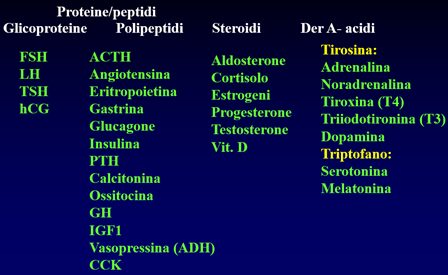
Gli ormoni possono avere diversa struttura chimica (possono essere glicoproteine, steroidi, derivati amminoacidici), la quale condiziona:
- la sede cellulare del recettore con cui interagiscono (recettori di membrana, citoplasmatici, nucleari);
- la loro modalità di sintesi e secrezione (ad es. gli ormoni polipeptidici come l’insulina vengono dapprima tradotti in pre-pro-ormoni, poi vengono clivati e concentrati in granuli secretori, da cui possono essere rilasciati sia per secrezione basale che stimolata).
La produzione ormonale e le caratteristiche chimiche degli ormoni stessi sono strettamente legate all’origine embrionale di una ghiandola o di un tessuto. Le ghiandole che derivano dal foglietto embrionale endo– ed ecto- dermico (quindi l’ipotalamo, l’ipofisi, la ghiandola pineale, la tiroide, il pancreas) producono amine ed ormoni proteici. Le ghiandole che derivano dal mesoderma (quindi la corteccia surrenalica, ovaio e testicoli) producono ormoni steroidei. Una volta che l’ormone ha raggiunto la cellula bersaglio, esso esplica la sua azione legandosi al proprio recettore specifico.
Tutti gli ormoni sono messaggeri chimici, quindi in quest’ottica, anche il sistema nervoso comunica attraverso le sinapsi nervose liberando particolari neurotrasmettitori, come acetilcolina e norepinefrina, che possono essere considerati neuro-ormoni (anche se i classici neuro-ormoni, proteici e steroidei, sono prodotti da specifiche cellule nervose).
Numerosi altri tessuti non endocrini possono produrre sostanze chimiche che si comportano come messaggeri chimici, influenzando altre cellule e tessuti, ma per queste sostanze è stato coniato il termine di paraormone (termine utilizzato per indicare il prodotto di ghiandole o tessuti che non sono annoverati tra i tessuti endocrini).
Gli ormoni agiscono a concentrazioni molto basse, e questo ha comportato notevoli difficoltà per la loro determinazione nei liquidi biologici come sangue e urine, ed ha per anni precluso sia studi di fisiologia che di fisiopatologia della loro secrezione. Grazie ai progressi compiuti nell’ambito della medicina di laboratorio, sono state scoperte delle metodiche di laboratorio capaci di dosare, seppur con modesta accuratezza, quegli ormoni che si trovano a più alte concentrazioni nei liquidi organici. Si tratta per lo più di metodiche colorimetriche, che sfruttando la reazione chimica dell’acido solforico, consentivano di determinare e quantificare alcuni ormoni steroidei nei liquidi biologici (per esempio nelle urine). Altre metodiche più complesse ed accurate sono state successivamente introdotte con il passare del tempo: si tratta di tecniche cromatografiche per purificare, estrarre, separare e dosare alcuni ormoni, di reazioni chimiche e colorimetriche per svelare la presenza e quantificare varie sostanze nei liquidi biologici (come le proteine, gli zuccheri o gli steroidi), e dunque sono stati riconosciuti i diversi ormoni che oggi possono essere classificati per la loro struttura biochimica.
Inoltre, gli ormoni si distinguono tra loro per:
- la diversa permanenza in circolo (emivita), variabile da pochi secondi a 6-7 giorni;
- il legame alle proteine di trasporto (specifiche come la globulina legante la tiroxina e aspecifiche come l’albumina) che influenzano i livelli plasmatici della frazione libera dell’ormone, biologicamente attiva;
- il metabolismo periferico: disattivante e/o attivante.
Gli ormoni proteici vengono prodotti dalla traduzione di specifici mRNA all’interno dei ribosomi del reticolo endoplasmatico. Successivamente le proteine ormonali migrano nell’apparato del Golgi, dove subiscono una serie di modifiche, come formazione di ponti solfuro e processi di glicosilazione, importanti per la funzione dell’ormone e per la sua emivita stessa. Vengono successivamente immagazzinati in granuli secretori e vanno incontro ad esocitosi solo a seguito di stimolazione (secrezione stimolata).
Gli ormoni steroidei vengono prodotti dalla corteccia della ghiandola surrenalica, che nella sua parte più superficiale, la glomerulare, è in grado di sintetizzare l’aldosterone (principale rappresentante degli ormoni mineral-attivi), mentre la parte fascicolata e la reticolare (della corteccia surrenalica), che si trovano subito al di sotto della glomerulare, producono il cortisolo (maggior rappresentante degli ormoni glucocorticoidi) e il deidroepiandrosterone (principale androgeno del surrene).
La produzione cortico-surrenalica è sotto il controllo dell’ormone ipofisario adrenocorticotropo (ACTH), fatta eccezione per l’aldosterone che invece viene regolato dall’angiotensina II.
Tra gli ormoni steroidei ci sono anche gli ormoni sessuali. Le gonadi maschili producono prevalentemente testosterone, mentre le gonadi femminili producono l’estradiolo. La secrezione ormonale gonadica è regolata prevalentemente dall’ormone Luteostimolante (LH).
Gli ormoni ipofisari regolano la produzione degli ormoni steroidei agendo su alcune esterasi delle ghiandole bersaglio (quindi gonadi e surrene), innescando dei meccanismi che portano ad un aumento della concentrazione del colesterolo libero disponibile per la sintesi degli ormoni. Il colesterolo, dopo essersi legato ad una proteina non specifica per il trasferimento lipidico (SCP2: proteina portatrice di sterolo 2), viene portato ai mitocondri, e mediante l’azione di una seconda proteina (proteina regolatrice acuta della steroidogenesi) raggiunge le membrane interne dei mitocondri, dove viene trasformato in prenienolone (primo step della catena steroido-genetica) mediante l’azione enzimatica del citocromo P450 SCC.
Tra gli ormoni steroidei c’è anche la vitamina D. Per vitamina D si intende un gruppo di pro-ormoni liposolubili costituito da 5 diverse vitamine: vitamina D1, D2, D3, D4 e D5. Le due più importanti forme nelle quali la vitamina D si può trovare sono la vitamina D2 (ergocalciferolo) e la vitamina D3 (colecalciferolo), entrambe le forme dall’attività biologica molto simile.
L’ergocalciferolo (D2) è di provenienza vegetale e si forma grazie all’azione fotolitica che i raggi ultravioletti esercitano sui vegetali, convertendo l’ergosterolo (forma pro-vitaminica di origine vegetale) nella vitamina D2.
Il colecalciferolo (D3), invece, viene assunto in parte con la dieta (in quanto contenuta in minima parte in alcuni prodotti di origine animale, come pesce e uova), ma in massima parte si forma a seguito della conversione del 7-deidrocolesterolo, presente a livello cutaneo, per azione delle radiazioni ultraviolette che determinano l’isomerizzazione del 7-deidrocolesterolo in colecalciferolo.
L’ergocalciferolo ed il colecalciferolo sono comunque delle forme inattive della vitamina D, e affinché possano svolgere le proprie azioni all’interno dell’organismo, è necessario che vadano incontro ad un processo di attivazione a livello di fegato e reni. Il ciclo della vitamina D inizia con l’assorbimento della vitamina D3 (colecalciferolo) e della vitamina D2 (ergocalciferolo) a livello intestinale e, tramite la circolazione linfatica, il loro depositarsi, in ragione dell’elevata lipofilia, nelle cellule del tessuto adiposo. La quota di vitamina D in eccesso, ovvero impossibilitata a legarsi al tessuto adiposo, entra nel circolo sanguigno e raggiunge il fegato grazie ad una proteina specifica di trasporto nota come vitamin D Binding Protein (DBP). Questa proteina è in grado di legare sia la vitamina D3 che la vitamina D2 ma con una differente “efficienza”, nel senso che lega più facilmente la vitamina D3 anziché la vitamina D2. Ciò spiega perché il fabbisogno di vitamina D deriva prevalentemente dal colecalciferolo.
A livello del fegato, la vitamina D trasportata dal circolo sanguigno è trasformata in idrossi-vitamina D grazie all’azione dell’enzima 25-idrossilasi, che media una idrossilazione in posizione 25. A questo punto l’idrossi-vitamina D rientra in circolo, si lega nuovamente alle DBP e raggiunge il rene. Qui può andare incontro a due diverse reazioni di idrossilazione, catalizzate da differenti idrossilasi (la 1α-idrossilasi e la 24-idrossilasi). Il risultato di queste due diverse reazioni di idrossilazione dà luogo, rispettivamente, alla produzione di 1,25-diidrossicolecalciferolo (calcitriolo), la vitamina D attiva, ed al 24,25-diidrossicolecalciferolo, una forma inattiva. L’azione dell’1α-idrossilasi è incrementata dal paratormone (PTH) e da una riduzione della fosforemia (ipofosforemia), mentre è diminuita dall’ipercalcemia, dall’iperfosforemia e dalla presenza di elevate concentrazioni di calcitriolo.
Come per tutti gli ormoni, la vitamina D attivata (calcitriolo), per esplicare la sua azione biologica nell’organismo, deve legarsi a recettori specifici, noti con l’acronimo VDR (Vitamin D receptor). Essa agisce principalmente sull’intestino, permettendo l’assorbimento di calcio, sull’osso, favorendo il deposito di calcio, e a livello renale favorendo il riassorbimento di calcio.
Gli eicosanoidi (prostaglandine, prostacicline, trombossani, leucotrieni) sono sintetizzati a partire dall’acido arachidonico tramite l’azione delle ciclossigenasi. Sono mediatori di processi infiammatori e comunque fungono loro stessi da ormoni. Le prostaglandine E, ad esempio, sono in grado di modulare a livello ipotalamo-ipofisario la secrezione di alcuni ormoni, quali GH e prolattina.
Attraverso l’azione di una trombossano-sintetasi, partendo da alcune prostaglandine, si formano trombossani e prostacicline mentre, i leucotrieni, derivano direttamente dall’acido arachidonico.
Gli antinfiammatori non steroidei (aspirina) hanno un effetto inibitorio sulle prostaglandine che derivano dall’acido arachidonico, quindi hanno una azione antinfiammatoria in questo senso, mentre i glucocorticoidi inibiscono la formazione dell’acido arachidonico a partire dai fosfolipidi.
Fonte: Manuale di endocrinologia.



