L’energia radiante può trasferire la sua energia agli atomi del mezzo attraversato, portandoli all’eccitazione o all’ionizzazione. Nell’eccitazione, l’energia radiante è sufficiente per spostare l’atomo da uno stato fondamentale a uno stato energetico eccitato. Al contrario, la radiazione ionizzante è capace di ionizzare gli atomi del mezzo attraversato, cioè di espellere elettroni dai loro orbitali.
Esistono due categorie principali di radiazioni: quelle direttamente ionizzanti e quelle indirettamente ionizzanti.
Le radiazioni direttamente ionizzanti sono costituite da particelle cariche come elettroni, protoni, particelle α e ioni, che hanno sufficiente energia cinetica per produrre ionizzazione attraverso collisioni.
D’altra parte, le radiazioni indirettamente ionizzanti comprendono particelle prive di carica elettrica, come neutroni e fotoni, che interagiscono con la materia in modi diversi, inducendo ionizzazione attraverso processi che coinvolgono altre particelle direttamente ionizzanti o reazioni nucleari.
Quando un mezzo biologicamente rilevante è esposto a un campo di radiazioni ionizzanti, si verificano una serie di processi dovuti al trasferimento di energia dalle radiazioni al mezzo. Questi processi si manifestano attraverso vari effetti. È fondamentale correlare questi effetti alle caratteristiche fisiche del campo di radiazione e del mezzo irradiato. Per fare ciò, è essenziale comprendere le caratteristiche dei diversi tipi di particelle e radiazioni, le loro interazioni con la materia attraversata e le grandezze fisiche e unità di misura utilizzate per descrivere le proprietà dei campi di radiazione e dei materiali coinvolti nelle interazioni con le radiazioni ionizzanti.
Radiazioni ed Onde: Il Trasporto di Energia
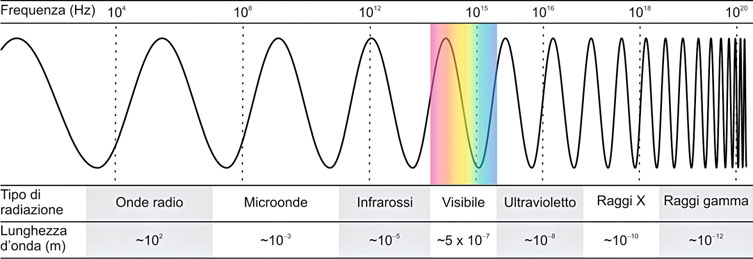
Il termine “radiazione” viene comunemente utilizzato per descrivere una vasta gamma di fenomeni apparentemente diversi tra loro. Questi includono l’emissione di luce da una lampada, la generazione di calore da una fiamma e la produzione di raggi X da una macchina per la diagnostica medica. Tuttavia, tutti questi fenomeni condividono una caratteristica fondamentale: il trasporto di energia nello spazio senza la necessità di un mezzo materiale per la propagazione. Questa energia può essere trasmessa sia nel vuoto che attraverso mezzi materiali tramite onde elettromagnetiche, che rappresentano oscillazioni dei campi elettrici e magnetici propagati nello spazio.
Le onde elettromagnetiche sono notevoli per la loro velocità costante nel vuoto, rappresentata da “c” e pari a 2,99729 · 108 m/s.
La frequenza di un’onda elettromagnetica, simboleggiata con “ν“, è definita come il numero di oscillazioni del campo elettrico o magnetico che si verificano in un’unità di tempo in una posizione specifica nello spazio.
La lunghezza d’onda, indicata come “λ“, rappresenta la distanza tra due posizioni consecutive in cui il campo raggiunge la massima intensità (picchi) in un dato istante. La relazione tra velocità, frequenza e lunghezza d’onda è data dalla seguente equazione: ν = c/λ.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Per illustrare il concetto di ionizzazione, consideriamo l’interazione di un’onda elettromagnetica con un atomo. Affinché l’onda possa ionizzare l’atomo durante l’interazione, è necessario che la lunghezza d’onda dell’onda sia approssimativamente simile alle dimensioni dell’atomo, ovvero λ ≈ 10-10 metri.
In tal caso, la frequenza di tale onda può essere calcolata utilizzando l’equazione precedente, risultando in ν = c/λ ≈ 3·1018 Hz. Dato che la frequenza della luce visibile è dell’ordine di 1014 Hz (circa 10.000 volte inferiore), si conclude che la ionizzazione degli atomi con la luce visibile non è possibile.
È significativo esprimere il concetto appena presentato in termini di energia trasportata dalla radiazione elettromagnetica. Le onde elettromagnetiche si propagano in “pacchetti” noti come fotoni, che possono essere considerati particelle di energia, con un valore rappresentato da: E = hν.
Dove “h” è la costante di Planck, con un valore di 6,62 · 10-34 J·s.
Questa relazione mette in risalto il dualismo onda-particella, un principio fondamentale della meccanica quantistica, che afferma che un fotone possiede sia caratteristiche ondulatorie che corpuscolari. Affinché un fotone sia in grado di ionizzare un atomo, è essenziale che la sua energia sia uguale o superiore all’energia di legame degli elettroni atomici coinvolti nell’interazione.
Per rappresentare numericamente le energie coinvolte nei processi di ionizzazione ed eccitazione, è conveniente utilizzare un’unità di misura apposita denominata elettronvolt (eV). L’elettronvolt è definito come l’energia cinetica acquisita da un elettrone che viene accelerato attraverso una differenza di potenziale elettrico di 1 Volt (Ec = q · ΔV). Ricordando che la carica dell’elettrone è approssimativamente 1,602 · 10-19 C, l’utilizzo dell’ultima equazione e la definizione di elettronvolt conducono al seguente valore di conversione:
1 eV = 1,602 ⋅10−19C ⋅1 V = 1,602 ⋅10−19 J
I Decadimenti Nucleari: Fenomeni di Radioattività
Gli elementi presenti in natura possono essere classificati in due categorie: stabili e instabili. Un atomo è considerato stabile quando il nucleo non subisce trasformazioni spontanee nel tempo. Questo implica che, in un atomo stabile, il numero di protoni e neutroni nel nucleo rimane costante nel tempo, a meno che non sia soggetto a bombardamenti da parte di radiazioni in grado di indurre trasformazioni nucleari. Dall’altra parte, ci sono atomi instabili in natura, in cui il nucleo subisce spontaneamente trasformazioni. Questi processi di trasformazione nucleare spontanea sono noti come “decadimenti nucleari“, e gli elementi instabili sono comunemente chiamati “radioattivi“. Dopo una o più trasformazioni, un nucleo radioattivo si trasforma sempre in un nucleo stabile, che può appartenere alla stessa specie chimica o a una diversa rispetto a quella iniziale.
Il decadimento nucleare è un fenomeno di natura probabilistica. Non è possibile prevedere l’istante esatto in cui un determinato nucleo instabile subirà una trasformazione. Tuttavia, è possibile descrivere quantitativamente l’evoluzione temporale di un insieme molto ampio di nuclei instabili utilizzando la seguente legge del decadimento radioattivo:
N(t) = N0⋅ e−λt
Nell’equazione precedente, alcune variabili chiave sono definite come segue:
- N0 rappresenta il numero di nuclei radioattivi contenuti nel campione (materiale) considerato al tempo iniziale t0=0.
- N(t) rappresenta il numero di nuclei radioattivi presenti nel campione dopo un tempo (t) dal tempo iniziale, ovvero il numero di nuclei che, al tempo t, non ha ancora subito alcuna trasformazione.
- λ è la costante di decadimento, che indica il numero medio di decadimenti nucleari che avvengono nell’unità di tempo. Questa costante è caratteristica di ogni isotopo radioattivo e non dipende dalla quantità di materiale contenuta nel campione radioattivo. λ ha le dimensioni dell’inverso del tempo e si misura in s-1.
L’equazione esprime quindi il seguente concetto in forma matematica: il numero di nuclei non trasformati presenti in un campione di materiale radioattivo diminuisce in modo esponenziale nel tempo.
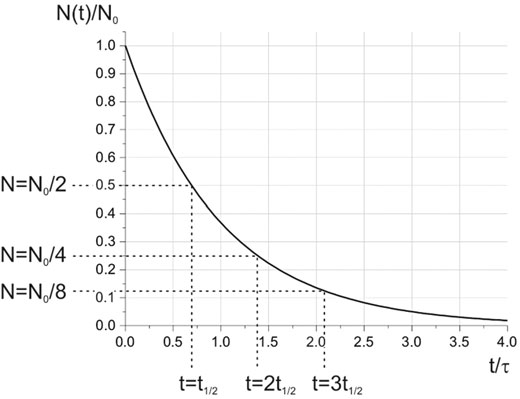
Si definisce “vita media” di una particolare specie nucleare l’inverso della costante di decadimento (τ=1/λ). La vita media rappresenta il tempo medio trascorso tra la produzione (naturale o artificiale) e il decadimento di un nucleo radioattivo specifico. Questo tempo può variare notevolmente da isotopo a isotopo e può essere compreso tra frazioni di secondo e miliardi di anni.
Un altro concetto strettamente correlato alla vita media è il “tempo di dimezzamento” o “emivita,” indicato con t1/2. Questo valore rappresenta il tempo necessario affinché il numero di nuclei radioattivi contenuti nel campione si dimezzi.. Dall’equazione si ricava:
t1/2 = τ ⋅ ln 2
Poiché il valore di ln(2) è circa 0,693, il tempo di dimezzamento è sempre inferiore alla vita media.
L’attività di un campione rappresenta il numero medio di decadimenti nucleari che avvengono in esso nell’unità di tempo. In accordo con questa definizione, l’attività coincide con il tasso di variazione (cioè la derivata) di N(t), cambiato di segno.
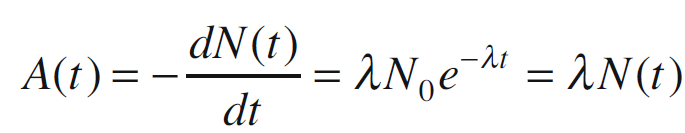
L’unità di misura dell’attività è il Becquerel (Bq), in cui 1 Bq corrisponde a una trasformazione nucleare (disintegrazione) al secondo. Un’altra unità di misura dell’attività, di interesse storico ma ancora utilizzata nella pratica, è il Curie (Ci), definito come l’attività di 1 grammo di Radio-226. La conversione tra Bq e Ci è ottenuta tramite la seguente equivalenza: 1 Ci = 3,7 × 1010 Bq.
Esistono vari tipi di decadimento nucleare:
- Decadimento Alpha (α): Questo tipo di decadimento coinvolge la spontanea emissione di particelle α da parte di nuclei pesanti che hanno un eccesso di protoni. La particella alfa è pesante e carica positivamente, composta da due protoni e due neutroni, simile a un nucleo di elio-4 (4He). Esempi di radionuclidi α-emettenti includono il Radio-226 (226Ra), il Radon-222 (222Rn) e il Polonio-210 (210Po).
- Decadimento Beta Minus (β–) e Beta Plus (β+): Questi decadimenti coinvolgono rispettivamente l’emissione di un elettrone (e–) e di un positrone (una particella carica positivamente, indicata come e+), da parte di un nucleo. Alcuni esempi di elementi che subiscono il decadimento β– includono lo Stronzio-89 (89Sr), mentre il Fluoro-18 (18F) è un esempio di un elemento che subisce il decadimento β+.
- Decadimento Gamma (γ): Questo tipo di decadimento comporta l’emissione di un fotone da parte del nucleo in uno stato eccitato. I fotoni emessi durante il decadimento γ sono fisicamente indistinguibili dai raggi X (o fotoni X), sebbene i raggi X siano prodotti da processi di diseccitazione degli elettroni atomici anziché nucleari. La distinzione tra fotoni di tipo X o γ è basata solo sul meccanismo di generazione (processi atomici o nucleari) e non sull’energia trasportata dai fotoni stessi.
Sorgenti Radioattive: Naturali ed Artificiali
Come precedentemente discusso, gli isotopi radioattivi raggiungono la stabilità mediante l’emissione di radiazioni. Questi isotopi possono essere trovati naturalmente nelle rocce, nell’atmosfera o nell’acqua, oppure possono essere prodotti artificialmente. Nel primo caso, vengono classificati come sorgenti naturali di radiazioni. Alcune di queste sorgenti naturali che rivestono particolare interesse nel campo della radioprotezione includono l’Uranio-238 (238U), il Potassio-40 (40K), il Radio-226 (226Ra) e il Radon-222 (222Rn). In particolare, il 222Rn costituisce una delle principali fonti di rischio da radiazioni per la popolazione, poiché è un gas inodore e insapore che, emettendo dal sottosuolo, può accumularsi in ambienti chiusi e scarsamente ventilati.
Gli isotopi radioattivi presenti nelle rocce sono chiamati sorgenti primordiali di radiazione, in quanto sono stati prodotti in eventi cosmici durante la formazione della Terra. Altre fonti di radiazione naturali includono le radiazioni cosmiche e le radiazioni cosmogeniche, principalmente il Trizio e il Carbonio-14, prodotte dall’interazione delle radiazioni cosmiche con i nuclei stabili presenti nell’atmosfera.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
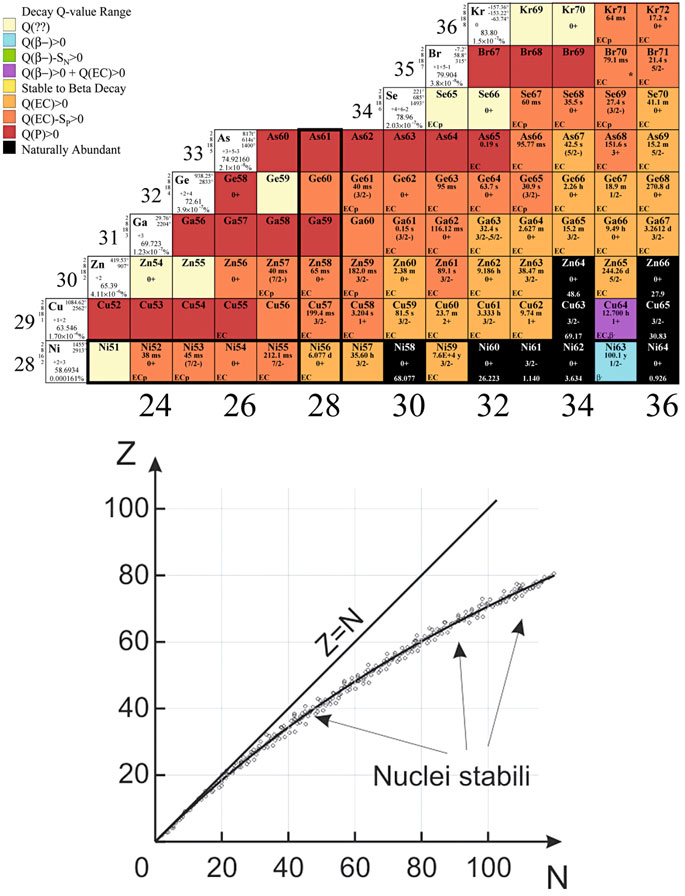
Le principali proprietà di tutti gli isotopi noti, indipendentemente dalla loro stabilità o instabilità, natura naturale o artificiale, sono organizzate nella “Tabella dei Nuclidi“. In questa tabella, i vari nuclidi sono disposti in una matrice in cui le righe hanno lo stesso numero di protoni e le colonne hanno lo stesso numero di neutroni. Avanzando da sinistra a destra, si osservano valori crescenti di N (numero di neutroni), mentre procedendo dall’alto verso il basso si ottengono valori crescenti di Z (numero atomico).
Gli isotopi stabili nella Tabella dei Nuclidi seguono la cosiddetta “curva di stabilità“. Osservando questa curva, si nota che per gli elementi leggeri (Z < 20), la maggior parte dei nuclei stabili contiene un numero uguale di protoni e neutroni, quindi si trovano vicino alla linea Z = N. Per gli elementi più pesanti, si verifica una deviazione da questa simmetria, e i nuclei stabili sono quelli con un eccesso di neutroni.
Le sorgenti naturali di radiazioni sono di scarso interesse nell’ambito medico. Questo perché i radioisotopi naturali hanno periodi di decadimento troppo lunghi per essere utilizzati in modo sicuro sia per scopi terapeutici che diagnostici. Inoltre, ottenere tali isotopi con il grado di purezza richiesto per tali applicazioni è una sfida complessa. Di conseguenza, la produzione artificiale dei radioisotopi desiderati attraverso l’uso di acceleratori di particelle, che consentono il controllo dell’attivazione dei nuclei all’interno di bersagli specifici, è preferibile.
Un’applicazione medica comune delle sorgenti artificiali di radiazioni è il tubo radiogeno, utilizzato nella radiodiagnostica per generare raggi X. In un tubo radiogeno, gli elettroni emessi dal catodo per effetto termoionico vengono prima accelerati attraverso un campo elettrico, tipicamente con tensioni comprese tra 40 e 140 kV, a seconda dell’uso previsto. Successivamente, questi elettroni vengono rapidamente frenati durante la collisione con un anodo composto da un metallo pesante.
Il catodo è solitamente realizzato con uno o due filamenti di tungsteno che vengono riscaldati per effetto Joule a temperature elevate, comprese tra 1500 e 2600 °C. L’anodo può essere costituito da tungsteno o molibdeno, con quest’ultimo utilizzato nei tubi destinati alla mammografia. L’anodo è progettato in modo da ottimizzare l’emissione di raggi X attraverso una finestra di uscita e massimizzare la dispersione del calore.
I raggi X sono emessi quando gli elettroni subiscono una rapida frenata sull’anodo. Lo spettro della radiazione emessa comprende una componente continua, nota come radiazione di frenamento, e una componente discreta o “a righe”, che è caratteristica del materiale dell’anodo.
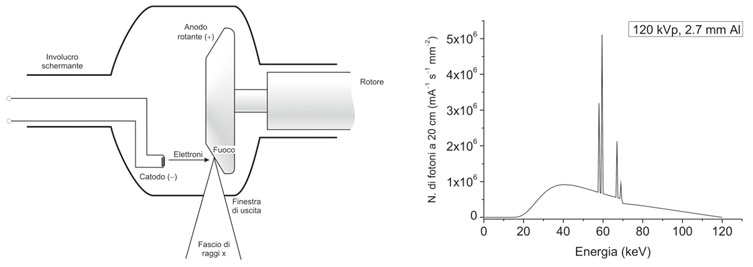
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Nel caso di sorgenti utilizzate nella Tomografia Computerizzata (TC), i tubi radiogeni devono essere in grado di sopportare carichi di lavoro significativi. In tali situazioni, l’anodo viene fatto ruotare ad alta velocità per garantire che il fascio di elettroni non colpisca sempre la stessa area del metallo. Questa rotazione evita il surriscaldamento di una sola regione del disco e favorisce la dissipazione del calore.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.


