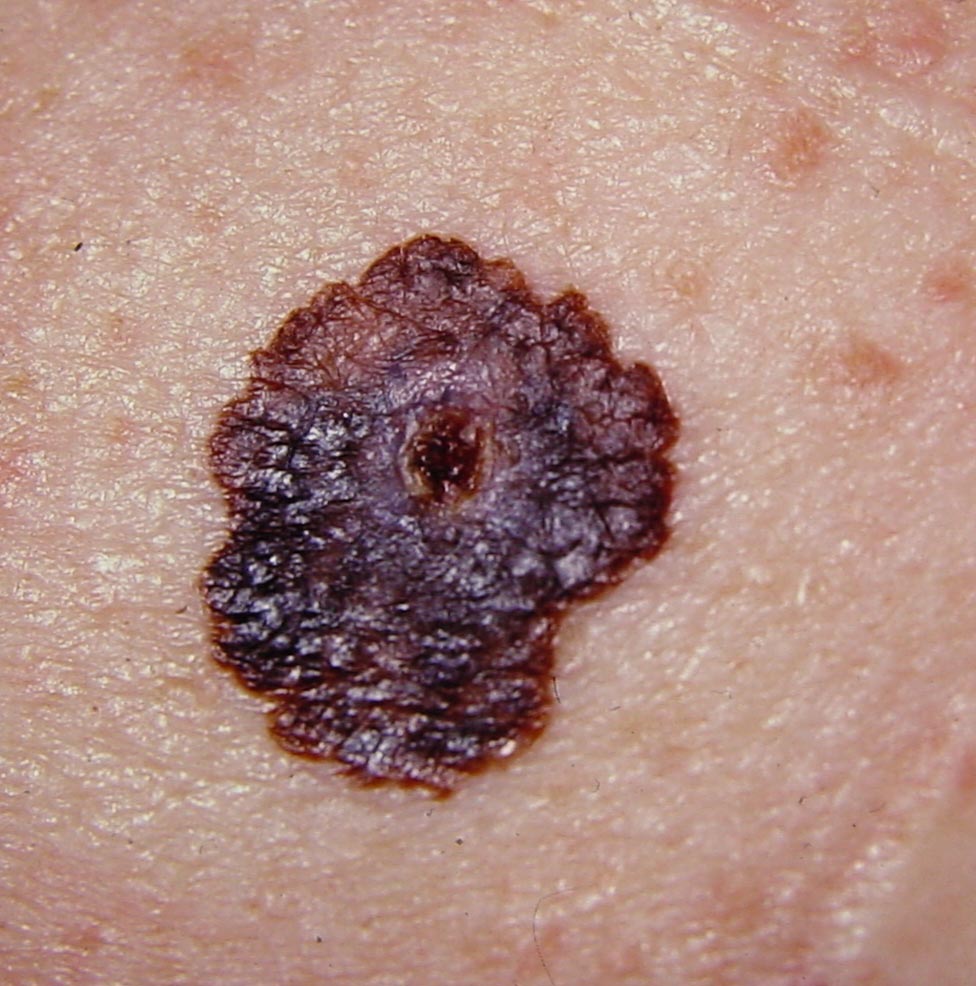
L’incidenza del melanoma è in crescita in tutto il mondo. Attualmente, l’incidenza stimata in Europa è di 9 casi su 100.000 abitanti, con una mortalità di 2,3 su 100.000. Ogni anno, il 4% in più di persone viene diagnosticato con la malattia, rendendo il melanoma il tumore con il maggiore aumento di incidenza.
I linfonodi regionali sono frequentemente il primo sito di metastasi prima della diffusione sistemica della malattia. La presenza o assenza di metastasi linfonodali, anche sotto forma di micrometastasi, è un importante fattore prognostico nei pazienti con melanoma in fase iniziale. Le metastasi occulte nei linfonodi regionali (clinicamente non palpabili e difficili da identificare anche con l’ecografia) si trovano in quasi il 20% dei pazienti che presentano un melanoma con uno spessore di Breslow >1 mm. Pertanto, è necessaria una valutazione istopatologica accurata per la rilevazione precoce delle metastasi.
In passato, la linfadenectomia regionale veniva eseguita di routine per stadiare i pazienti con melanoma clinicamente negativi ai linfonodi. Tuttavia, questa procedura spesso costituiva un chiaro eccesso di trattamento non necessario, poiché la maggior parte dei pazienti con melanomi di spessore Breslow <4 mm non presentava metastasi linfonodali. Pertanto, la linfadenectomia esponeva molti pazienti a complicanze chirurgiche immediate e a lungo termine non necessarie, come possibili infezioni della ferita e ritardi nella guarigione della ferita, linfedema, ematoma, sieroma, dolore, ecc.
Perciò, negli ultimi 20 anni la linfadenectomia è stata gradualmente sostituita dalla SLNB, un metodo minimamente invasivo basato sul concetto di progressione “ordinata” delle cellule metastatiche attraverso il sistema linfatico che consente una valutazione accurata dello stato dei linfonodi.
La pelle ha una rete molto densa di capillari e vasi linfatici. I percorsi seguiti dai vasi collettori nel loro cammino verso i bacini linfatici variano da paziente a paziente e da una posizione della pelle all’altra. Questi percorsi possono talvolta essere molto complessi e inaspettati. In generale, i vasi linfatici convergono per formare vasi più grandi o vasi multipli (ad esempio, nella parte superiore della coscia). Questi vasi collettori attraversano lo strato di grasso sottocutaneo e penetrano nella fascia profonda dopo aver raggiunto il bacino linfatico.
Poiché il drenaggio linfatico cutaneo è altamente variabile, la linfoscintigrafia è attualmente una componente obbligatoria della procedura di SLNB radioguidata. La prevedibilità del drenaggio linfatico nel melanoma cutaneo dipende dalla posizione delle lesioni primarie, essendo approssimativamente del 98% negli arti inferiori, dell’88% negli arti superiori, del 56% nel torace anteriore e del 39% nel tronco posteriore. Il drenaggio linfatico è quasi completamente imprevedibile nella regione della testa e del collo. Tuttavia, apprendere i pattern di drenaggio fisiologico e “linfoscintigrafico” costituisce almeno una prima stima dei bacini di drenaggio più probabili, a seconda della posizione del tumore primario.
Indicazioni e controindicazioni
La SLNB è indicata nei pazienti con melanoma invasivo localizzato:
- spessore di Breslow >1 mm e in alcuni casi selezionati con spessore tumorale <1 mm ma in presenza di ulcerazione (accertata istologicamente);
- >1 mitosi/mm2;
- regressione con spessore ≥1 mm o regressione di oltre il 50-75% di tutta la lesione pigmentata.
Alcuni istituti estendono l’indicazione anche ai tumori con spessore di Breslow compreso tra 0,75-1 mm.
La SLNB dovrebbe essere programmata dopo la conferma istologica della diagnosi di melanoma a seguito di un’escissione diagnostica della lesione primaria con un margine stretto e dovrebbe essere combinata con un’ampiamento dell’escissione.
La SLNB è inoltre indicata nei pazienti con carcinoma a cellule di Merkel.
Le potenziali controindicazioni sono:
- Stato generale di salute scadente, malattie concomitanti gravi, scarsa compliance e stato metastatico sistemico accertato.
- La SLNB è una procedura sicura anche durante la gravidanza.
- La SLNB è anche adatta e accurata nei bambini e negli adolescenti.
Procedura e radiofarmaci
Non è necessaria una preparazione speciale. Le seguenti informazioni devono essere disponibili: diagnosi clinica, trattamenti precedenti, referto istopatologico della biopsia escissionale, storia di interventi chirurgici o traumi nella regione di interesse, comorbidità, gravidanza/allattamento e somministrazione di radiofarmaci nei pochi giorni precedenti la linfoscintigrafia. È importante eseguire un accurato esame fisico della regione interessata. Tutti i vestiti e i gioielli nella regione interessata e lungo i vasi linfatici devono essere rimossi per evitare costrizioni e ostruzioni dei canali linfatici.
I radiofarmaci utilizzati sono gli stessi del carcinoma della mammella:
- 99mTc-colloide di zolfo (dimensione delle particelle, 15–5.000 nm se non filtrato, <100 o 220 nm secondo la dimensione dei pori dei filtri utilizzati);
- 99mTc-albumina nanocolloidale, o nanocoll (5–100 nm), la più utilizzata;
- 99mTc-trisolfuro di antimonio (3–30 nm);
- 99mTc-tilmanocept (un nuovo agente non colloidale basato su recettori con una dimensione equivalente a circa 5–7 nm).
Somministrazione del radiofarmaco
Dopo l’applicazione di un anestetico topico quando si usa il 99mTc-solfuro colloidale, il radiofarmaco viene somministrato tramite quattro iniezioni intradermiche separate di 1,8 MBq (0,05 mCi) in 0,1 mL (per la chirurgia nello stesso giorno, o circa tre volte di più se la chirurgia è programmata per il giorno successivo). Con il protocollo di un giorno, la linfoscintigrafia viene eseguita poche ore prima dell’intervento chirurgico, mentre con il protocollo di due giorni la linfoscintigrafia viene eseguita il giorno prima della chirurgia.
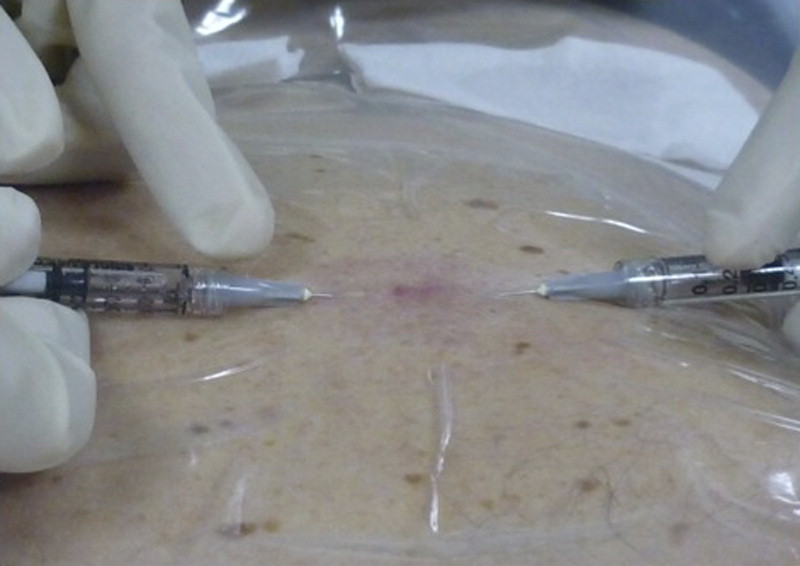
L’iniezione del radiofarmaco intraoperatoria e l’utilizzo della sonda intraoperatoria senza imaging preoperatorio devono essere evitati, poiché il drenaggio linfatico nel melanoma può essere anomalo, ritardato o interessare più di un bacino linfonodale, caratteristiche che verrebbero tutte perse senza la linfoscintigrafia preoperatoria.
L’iniezione intradermica del radiofarmaco deve essere effettuata in quattro o più dosi a circa 1 cm su ogni lato del centro della cicatrice chirurgica dalla biopsia escissionale precedente (l’occorrenza più comune). La distanza tra la cicatrice e l’iniezione del tracciante può essere aumentata se il sito di iniezione è indurito. Quando il melanoma è ancora presente (l’occorrenza più rara), il radiofarmaco viene iniettato vicino al tumore primario.
Il volume iniettato è circa 0,1-0,2 mL per aliquota (se il volume è troppo grande, i vasi linfatici possono collassare o la bolla sulla superficie della pelle può rompersi).
Generalmente vengono utilizzati aghi da 25 o 27 G montati su siringhe da tubercolina per l’iniezione.
La quantità di radioattività iniettata raggiunge i 37 MBq, a seconda del protocollo adottato (protocollo di un giorno o protocollo di due giorni).
Acquisizione delle immagini
Devono essere immaginati tutti i possibili bacini linfonodali. E’ preferibile utilizzare una gamma camera a doppia testa con rilevatori a grande campo visivo. Si raccomanda vivamente l’uso di un collimatore a bassa energia e alta risoluzione, utilizzando una finestra energetica tra il 15% e il 20% centrata sul picco fotoelettrico di 140 keV.
Il contorno del corpo mediante una scansione di trasmissione usando una sorgente di inondazione sotto il corpo del paziente (quando si utilizzano gamma camere a testa singola) facilita la localizzazione anatomica dei punti caldi.
Acquisizione dinamica
Il tracciante viene iniettato mentre il paziente è sdraiato in posizione supina o prona (a seconda della posizione del tumore primario) sul letto della gamma camera. L’acquisizione dinamica deve essere eseguita per 10–20 minuti (1 fotogramma/minuto, matrice 64 × 64) a partire dall’iniezione del tracciante. Questa acquisizione di immagini iniziale può visualizzare il pattern generale del drenaggio linfatico, consentire di rilevare linfonodi “in transito” e migliorare la localizzazione del linfonodo sentinella mediante immagini statiche successive. La procedura è fortemente raccomandata specialmente per i melanomi della mano/avambraccio o piede/gamba.
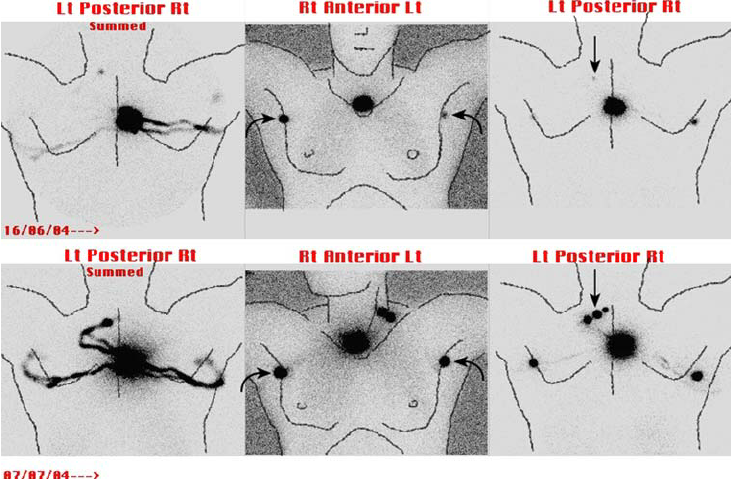
Immagini Statiche Precoci
Alla fine dell’acquisizione dinamica, devono essere acquisite immagini statiche planari di 5 minuti (antero-posteriore e laterale) con una matrice grande (meglio con una matrice 256 × 256) sui bacini linfonodali in cui si prevede si trovi il linfonodo sentinella, basandosi sull’acquisizione dinamica precedente.
Le immagini precoci aiutano a discriminare i veri linfonodi sentinella dai nodi del secondo livello. Nei melanomi del tronco, di solito sono necessarie immagini statiche bilaterali dell’ascella, del tronco e dell’inguine, oppure può essere eseguita una scansione dell’intero corpo dal collo all’inguine.
Immagini Statiche Tardive
Dopo aver registrato le immagini precoci, è utile che il paziente massaggi l’area dell’iniezione e muova la parte del corpo (ad esempio camminare se la lesione è agli arti inferiori, o muovere le braccia se la lesione è agli arti superiori, ecc.) durante l’intervallo tra le immagini precoci e quelle ritardate. Immagini statiche tardive antero-posteriore e laterali di 3-5 minuti vengono acquisite (1-3 ore dopo l’iniezione del tracciante) per identificare tutti i linfonodi sentinella rilevanti.
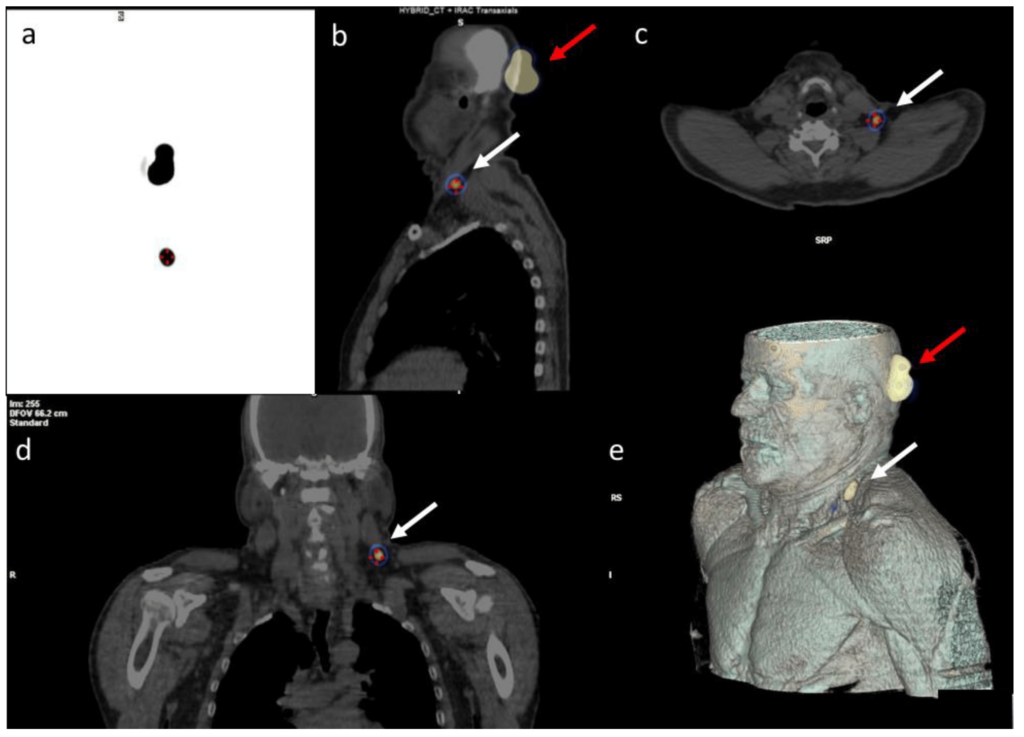
SPECT/CT
L’imaging SPECT/CT migliora notevolmente l’accuratezza nella localizzazione del linfonodo sentinella e riduce la possibilità di interpretazioni errate delle immagini. La SPECT/CT è estremamente preziosa per lesioni testa-collo. È anche utile per l’inguine o l’ascella.
Interpretazione delle immagini e refertazione
Le immagini dinamiche precoci, statiche precoci e statiche tardive identificano i linfonodi sentinella nella maggior parte dei pazienti. Il linfonodo sentinella è il linfonodo visualizzato per primo lungo un percorso di drenaggio linfatico; sebbene non sia sempre il linfonodo più vicino al sito di iniezione, è generalmente il linfonodo più captante lungo un determinato percorso di drenaggio linfatico. I linfonodi che appaiono nelle immagini successive possono anche essere linfonodi sentinella, a meno che non ricevano drenaggio linfatico da un linfonodo sentinella rilevato in precedenza, ad esempio durante l’acquisizione di immagini dinamiche.
Il referto deve includere il radiofarmaco utilizzato, la tecnica di iniezione, l’attività e il volume iniettati, i tempi di acquisizione e l’orientamento delle immagini. Le strutture visualizzate e la loro posizione devono essere descritte in dettaglio, in particolare il numero e la posizione dei linfonodi sentinella.
Insidie e possibili falsi negativi
Tra le possibili insidie rientrano:
- contaminazione della pelle;
- linfangioma o i inginocchiamenti linfatici possono essere interpretati erroneamente come linfonodi;
- linfonodi del secondo livello possono essere interpretati erroneamente come sentinella (se non vengono acquisite immagini dinamiche o statiche precoci);
- altri tessuti contenenti radioattività possono complicare l’interpretazione delle immagini.
Tra le possibili fonti di interpretazione di falsi negativi nelle immagini ci sono:
- due o più linfonodi radioattivi molto vicini tra loro che possono essere interpretati erroneamente come un unico linfonodo;
- il sito di iniezione che con la sua radioattività può mascherare il linfonodo sentinella;
- scarso drenaggio dal sito di iniezione. In questo caso può essere utile un massaggio delicato dell’area di iniezione, così come riscaldare l’area con una borsa di acqua calda o, per il melanoma delle braccia e delle gambe, l’esercizio fisico. Quando non viene localizzato alcun linfonodo, la procedura dovrebbe essere ripetuta con altre iniezioni.
Procedure in sala operatoria
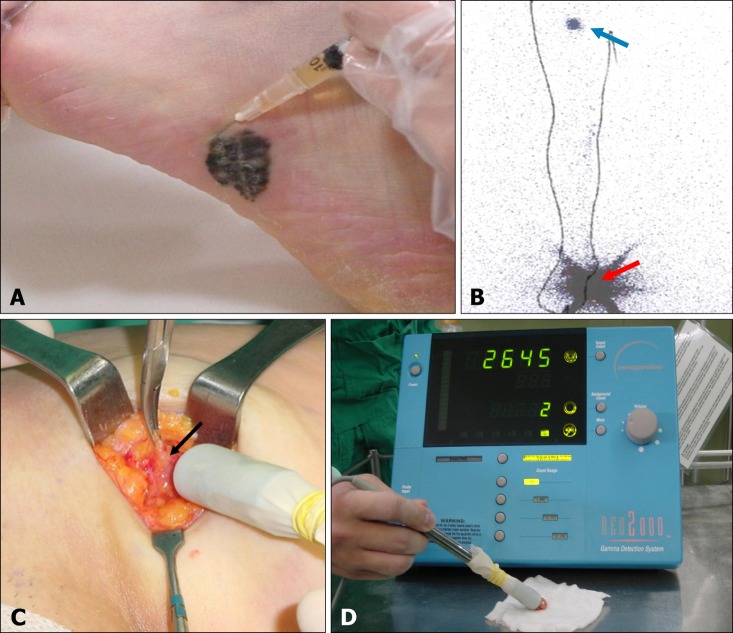
B. L’immagine della linfoscintigrafia ottenuta (tumore primario: freccia rossa, linfonodo: freccia blu).
C. Prelievo del/i linfonodi e misurazione della loro radioattività.
D. Conferma dei linfonodi asportati con alta radioattività.
La sonda gamma viene utilizzata per guidare l’esposizione dei tessuti sovrastanti, al fine di identificare la posizione del linfonodo sentinella nel letto chirurgico (misurazione in vivo). Dopo l’escissione del linfonodo sentinella, la sonda gamma viene utilizzata sul tessuto resecato, lontano dal paziente, per confermare che si tratti del linfonodo caldo corrispondente al linfonodo sentinella. Successivamente, il letto chirurgico viene esplorato nuovamente con la sonda gamma manuale per verificare la presenza di attività residua. Le politiche locali determinano quanti linfonodi devono essere rimossi per l’analisi istologica (ad esempio, basato su una soglia del 10% o 20% del tasso di conta ex vivo rispetto al SLN).
Il chirurgo deve anche controllare manualmente la regione di interesse per identificare eventuali linfonodi residui ingranditi senza captazione del tracciante. Infatti, un linfonodo in cui il tessuto linfatico è stato completamente sostituito da cellule metastatiche non sarà in grado di concentrare il radiofarmaco, ma deve essere rimosso per l’analisi istologica e per completare la stadiazione.
La sonda gamma utilizzata dovrebbe essere progettata per l’applicazione intraoperatoria e verificata regolarmente per garantire la qualità. Dovrebbe essere inserita in una guaina sterile e dovrebbe fornire conteggi istantanei e cumulativi. La conversione del tasso di conteggio in un segnale acustico con un tono variabile facilita la localizzazione del SLN.
Se l’intervallo di tempo tra la linfoscintigrafia e l’intervento chirurgico è troppo lungo e i linfonodi radioattivi non possono più essere rilevati, il paziente può essere reiniettato prima dell’intervento chirurgico.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.




