Sebbene la percentuale di utilizzo sia parzialmente ridotta rispetto a qualche anno fa, a causa dell’introduzione e della diffusione nella pratica clinica di un numero crescente di altri radio traccianti etichettati con emettitori di positroni, il F-18 fluorodeossiglucosio (FDG) rimane ancora il radiofarmaco più utilizzato per la PET. Oggi, oltre il 90% delle procedure PET a livello mondiale vengono eseguite con FDG, utilizzato principalmente per indicazioni oncologiche, sebbene il suo uso clinico stia diventando sempre più diffuso nella valutazione di altre condizioni patologiche come malattie neuropsichiatriche e cardiovascolari, infiammazioni e infezioni.
Questa predominanza è dovuta principalmente a ragioni pratiche: il Fluoro 18 è uno dei quattro emettitori di positroni più importanti, facilmente prodotto dai ciclotroni “standard”, con la capacità di radiomarcare molecole biologiche rilevanti. Grazie alla sua emivita favorevole (110 minuti) rispetto a quella più breve del C-11, N-13 e O-15, il F-18 è l’unico che può essere distribuito senza difficoltà anche ai centri PET non dotati di ciclotroni. Dal punto di vista chimico, il fluoro è un alogeno che consente un legame molto stabile senza influenzare la parte funzionale della molecola. Ma il vero valore “assoluto” del F-18 deriva dalla sua capacità di radiomarcare il deossiglucosio, producendo FDG, ovvero il tracciante del glucosio.
Meccanismi di trasporto del glucosio e dell’FDG
Il glucosio è una biomolecola essenziale negli organismi viventi, essendo il più importante fornitore di carbonio nei processi metabolici di produzione di energia, dipendendo in gran parte dalla sua disponibilità. A livello cerebrale, è l’unica fonte di energia.
Per una corretta lettura delle immagini PET-FDG, basata sull’interpretazione di tutti gli eventi molecolari coinvolti, dobbiamo prima analizzare la distribuzione normale del glucosio, partendo dalla conoscenza del suo comportamento fisiopatologico. E’ importante ricordare che l’assorbimento del glucosio nelle cellule umane può avvenire attraverso due meccanismi principali: diffusione facilitata e trasporto attivo.
Il primo è un trasferimento intracellulare mediato da carrier, quindi caratterizzato da saturazione (e influenzato dall’insulina). Ciò significa che può verificarsi un’inibizione competitiva del trasporto in presenza di un secondo ligando che si lega allo stesso carrier. Poiché l’FDG utilizza gli stessi trasportatori della molecola nativa, c’è una forte interferenza sull’assorbimento dell’FDG determinata dal diabete e, più in generale, dalle variazioni nei livelli di glucosio e insulina nel sangue.
Per questi motivi, per standardizzare l’analisi della distribuzione dell’FDG, è cruciale definire alcune questioni principali come il tempo di digiuno (almeno 4-6 ore), un intervallo di glucosio sierico e, nel diabete, il tempo dopo l’iniezione di insulina. Le scansioni PET devono essere preferibilmente eseguite con livelli di glucosio sierico nell’intervallo di 70-110 ng/dL. È meglio evitare esami in pazienti con livelli di glucosio superiori a 200 ng/dL. In alcuni casi con valori di glucosio elevati, quando possibile, gli studi devono essere riprogrammati cercando di raggiungere livelli di glucosio più bassi prima dell’iniezione dell’FDG. Allo stesso modo, deve essere definito un avviso in presenza di iperinsulinemia, riducendo l’accuratezza diagnostica a causa di una forte interferenza sulla biodistribuzione.
Il trasporto attivo del glucosio, che avviene contro un gradiente elettrochimico, è meno diffuso, funzionando solo in alcune cellule epiteliali speciali specificamente adattate per l’assorbimento attivo, come quelle presenti nelle membrane gastrointestinali o a livello dei tubuli renali. Solo in casi eccezionali l’assorbimento cellulare del glucosio può essere determinato anche da una diffusione passiva.
Intrappolamento dell’FDG
Anche se il glucosio e l’FDG vengono trasportati nella maggior parte delle cellule attraverso un meccanismo simile, il loro metabolismo intracellulare è significativamente diverso.
Il destino biochimico del glucosio inizia con la fosforilazione, che avviene immediatamente dopo il suo ingresso nelle cellule. La fosforilazione, sia per il glucosio che per l’FDG, è promossa dalla esochinasi nella maggior parte delle cellule, dipendendo dalla glucochinasi nel fegato. Dopo questo primo passo, il glucosio-6-fosfato progredisce rapidamente nel suo percorso metabolico, dopo una defosforilazione mediata dalla glucosio-6-fosfatasi, subendo glicolisi (e/o immagazzinamento di glicogeno e/o conversione in lipidi o proteine).
Al contrario, l’FDG-6-fosfato non viene ulteriormente metabolizzato nella via glicolitica, rimanendo “intrappolato intracellularemente”, a causa della mancanza di quantità significative di FDG-6-fosfatasi per invertire la sua fosforilazione. Questa è la differenza più significativa tra il glucosio nativo e l’FDG, che determina un grande vantaggio per l’imaging con FDG: mentre il glucosio “nativo” radiomarcato ha un metabolismo troppo rapido per consentire facilmente uno studio PET, l’FDG “intrappolato” può tracciare in modo affidabile la concentrazione di glucosio “in vivo” fino a due o più ore. Tuttavia, sebbene questo non sia strettamente corretto dal punto di vista metabolico, poiché il trasporto e il metabolismo del glucosio sono fortemente correlati, possiamo considerare l’FDG come un analogo del glucosio che traccia in modo affidabile il metabolismo del glucosio negli esseri umani.
L’FDG riflette il metabolismo del glucosio in tutti gli organi, tranne che nei reni. A questo livello, mentre gli individui normali non espellono glucosio attraverso il sistema urinario, si osserva un intenso assorbimento di FDG nei reni, negli ureteri e nella vescica. Infatti, mentre il glucosio normale viene liberamente filtrato dai glomeruli e rapidamente riassorbito dal nefrone, l’FDG viene scarsamente riassorbito dopo la filtrazione, essendo escreto in grande quantità nelle urine.
L’allattamento al seno è controindicato fino a 10 ore dopo l’iniezione endovenosa di FDG.
Preparazione all’iniezione e all’acquisizione
Il paziente viene iniettato per via endovenosa, a digiuno da almeno 4-6 ore, in presenza di una buona idratazione. Durante l’iniezione e la fase di assorbimento successiva che precede la scansione (circa 40 minuti dopo la somministrazione), l’individuo deve essere a riposo, in una stanza tranquilla, confortevole e rilassata. In particolare, deve cercare di evitare azioni come masticare, mangiare, correre e qualsiasi altro esercizio e/o attivazione sensoriale che influenzi la distribuzione dell’FDG, aumentando principalmente l’assorbimento muscolare o cerebrale regionale. Essendo impossibile evitare la deglutizione, principalmente per i pazienti sottoposti a una scansione PET per tumori della testa e del collo, l’effetto sull’assorbimento dell’FDG nelle corde vocali deve essere ricordato quando si parla. Successivamente, il paziente viene invitato a urinare e la scansione inizia generalmente 45-60 minuti dopo l’iniezione endovenosa.
Fisiologica distribuzione
In una condizione standard, l’attività più alta dell’FDG si osserva a livello cerebrale (principalmente nella materia grigia), con il cervello che è l’unico organo che utilizza esclusivamente il glucosio come carburante.
A digiuno, l’assorbimento cardiaco (ventricolo sinistro) è variabile, ma più frequentemente lieve e omogeneo. Occasionalmente, un’analisi difficile può essere determinata da un’elevata attività del pool sanguigno a livello dei grandi vasi, principalmente nel mediastino.
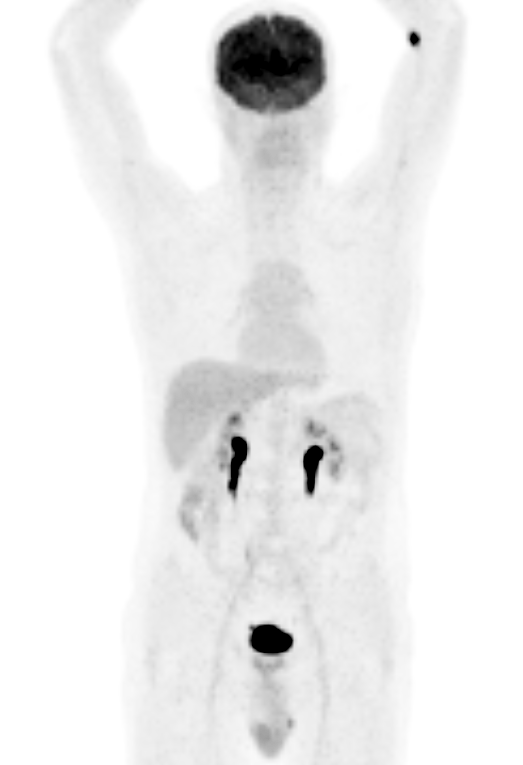
Mentre fegato e milza mostrano un’attività diffusa di basso grado, un assorbimento variabile si osserva nel sistema gastrointestinale, a volte creando difficoltà nell’analisi e problemi nella diagnosi differenziale. Questa attività può essere correlata sia all’assorbimento del muscolo liscio che al contenuto intraluminale.
Una concentrazione bassa e/o assente si osserva a livello del midollo osseo. Allo stesso modo, non si osserva attività a livello dei linfonodi normali, ma dopo l’extravasazione dell’FDG nel sito di iniezione, determinando un’elevata assunzione focale nelle ghiandole regionali di drenaggio.
Un’attività moderata può essere osservata nelle tonsille, nelle ghiandole salivari, nei muscoli mio-ioidei e, solo nei pazienti giovani, nel timo, nel tessuto adenoideo e nei testicoli.
Non si osserva normalmente assorbimento a livello dei polmoni, con una leggera attività che a volte è presente nei segmenti posteriori e inferiori.
L’assorbimento del muscolo scheletrico, essendo basso a riposo, aumenta come risposta specifica allo stress e/o all’esercizio nelle cellule muscolari coinvolte. Un aumento dell’assorbimento può essere determinato da molte condizioni come iperventilazione, singhiozzo, torcicollo e movimenti oculari intensi, come risultato di tensioni involontarie. L’assorbimento muscolare è generalmente bilaterale e simmetrico. Al contrario, una concentrazione patologica unilaterale apparente può essere osservata controlateralmente a una paralisi nervosa.
L’escrezione urinaria, determinando un elevato background a livello renale e vescicale, può creare difficoltà nella valutazione dell’assorbimento patologico dell’FDG principalmente nei reni, nella vescica e nella prostata. Piccole aree localizzate di stasi ureterale possono simulare linfoadenopatia. La presenza di posizioni anomale dei reni e degli ureteri deve essere conosciuta, per evitare errori nell’interpretazione delle immagini PET.
L’assorbimento tiroideo può essere occasionalmente osservato in pazienti clinicamente normali, essendo più frequentemente causato da tiroidite o ipertiroidismo, anche non clinicamente evidente.
Nelle donne in premenopausa (e/o nelle donne che assumono estrogeni) il tessuto mammario può spesso dimostrare una moderata concentrazione simmetrica dell’FDG. Un intenso assorbimento è mostrato dalle madri che allattano.
Un assorbimento uterino da lieve a moderato può essere osservato durante le mestruazioni.
Nel tessuto adiposo, un tipico assorbimento intenso simmetrico può essere determinato dal grasso bruno attivo, principalmente nei mesi invernali nei pazienti con un indice di massa corporea inferiore. Aumentando questo assorbimento quando il paziente viene iniettato e/o si trova in una stanza fredda, è importante garantire l’iniezione e la permanenza in un ambiente caldo.
Difficoltà nell’analisi
Con la rivelabilità delle lesioni in medicina nucleare dipendente dal rapporto lesione/sfondo, è evidente che le maggiori difficoltà nell’analisi della PET-FDG sono presenti a livello cerebrale e/o nel territorio addominale-pelvico, dove le attività derivanti dagli emuntori gastrointestinali e urinari possono disturbare.
Tuttavia, molti assorbimenti fisiologici e para-fisiologici possono essere facilmente distinti quando analizzati con l’aiuto delle informazioni morfostrutturali ottenute dalla TC. Per ridurre gli errori, alcuni autori suggeriscono anche la somministrazione di rilassanti muscolari, preparazioni per la pulizia intestinale e il posizionamento di un catetere di Foley. Tuttavia, a causa delle difficoltà nel standardizzare queste procedure e dell’impossibilità di evitare in modo affidabile possibili insidie, una strategia di “mantenere la semplicità” è più frequentemente adottata, ma in situazioni particolari individuali.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Fonte: Atlas of Pet-ct: A Quick Guide to Image Interpretation.