Negli ultimi 15 anni, la chirurgia radioguidata, insieme alla PET, ha rappresentato una delle applicazioni della medicina nucleare con crescita più rilevante. Il semplice termine “chirurgia radioguidata” in realtà costituisce una vasta gamma di procedure combinate basate sulla collaborazione sinergica tra almeno due diverse specialità, medicina nucleare e chirurgia, ma spesso coinvolge anche altre specialità. L’applicazione corretta di tali procedure comporta evidenti benefici immediati e a lungo termine per il paziente.
La chirurgia radioguidata include un insieme di tecniche e procedure pre-, intra- e post-operatorie progettate per ottimizzare la chirurgia oncologica tradizionale. Tutte queste tecnologie possono essere racchiuse nel concetto di “guided intraoperative scintigraphic tumor targeting” (GOSTT) che implica la somministrazione preoperatoria di un radiofarmaco che, sebbene con modalità diverse, si concentra preferenzialmente in un determinato tessuto bersaglio da rimuovere.
L’imaging preoperatorio (più comunemente con una gamma camera convenzionale, talvolta con PET) fornisce informazioni utili sull’approccio chirurgico ottimale da adottare per ogni singolo paziente, mentre l’uso intraoperatorio di una sonda portatile per il rilevamento della radioattività (la sonda gamma) guida ulteriormente il chirurgo nell’identificazione e rimozione del tessuto bersaglio che è stato preoperatoriamente “etichettato” con il radiofarmaco.
L’accumulo preferenziale di un radiofarmaco nella lesione bersaglio può essere ottenuto tramite tre meccanismi principali:
- somministrazione interstiziale di un radiofarmaco adeguato (tipicamente un radiocollide) che rappresenta il pattern di drenaggio linfatico dal sito di un tumore epiteliale solido, per identificare il/i linfonodo/i sentinella che drenano dal tumore primario;
- somministrazione sistemica di un radiofarmaco che si accumula preferenzialmente nella lesione bersaglio;
- somministrazione intralesionale diretta di un radiofarmaco che, in virtù di una dimensione relativamente grande, viene trattenuto virtualmente indefinitamente nel sito di iniezione per la cosiddetta localizzazione delle lesioni occulte radioguidata (ROLL).
La procedura del linfonodo sentinella (SLN) è una procedura di stadiazione diagnostica che viene applicata in una varietà di tipi di tumori. Essa mira a determinare lo stato tumorale del/i linfonodo/i sentinella, definito/i come qualsiasi linfonodo su un percorso di drenaggio diretto dal tumore primario. Il concetto si basa sul presupposto che il flusso linfatico dal tumore primario viaggia prima al linfonodo sentinella e poi sequenzialmente agli altri linfonodi regionali, un processo che sottende il concetto di “progressione ordinata” delle cellule tumorali metastatiche lungo un certo percorso di drenaggio linfatico. Pertanto, lo stato istopatologico di questo linfonodo dovrebbe riflettere lo stato istopatologico dell’intero bacino linfonodale.
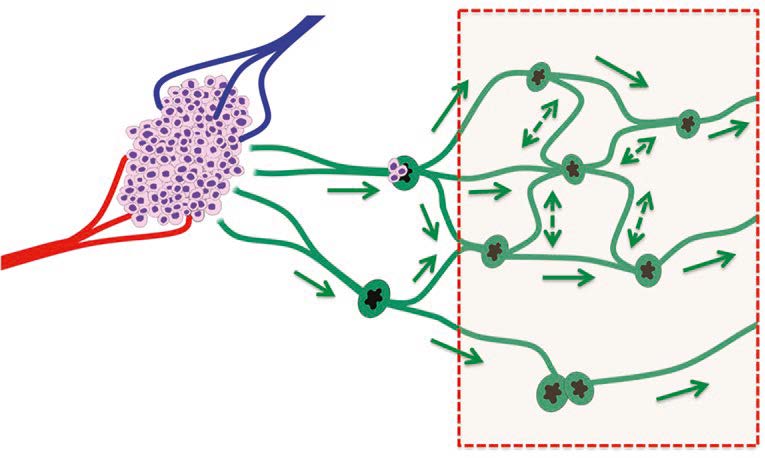
Il pattern del flusso linfatico è ancora più complesso se si considera che il drenaggio linfatico dal tumore può avvenire verso più di un bacino linfatico, ciascuno dei quali ripete il pattern di base rappresentato qui per un singolo bacino.
Questo concetto si traduce nella pratica clinica come segue:
- se si trovano metastasi nel/i linfonodo/i sentinella, vi è un’alta probabilità che anche altri linfonodi nello stesso bacino linfatico ospitino metastasi;
- le raccomandazioni attuali in caso di linfonodo/i sentinella metastatico/i prevedono di procedere alla linfadenectomia di completamento di quel particolare bacino (eccetto in alcuni casi specifici ancora in fase di studio);
- la linfadenectomia di un certo bacino linfatico comporta una probabilità relativamente alta di complicanze locali immediate e ritardate;
- la linfadenectomia di completamento in un bacino con linfonodo/i sentinella metastatico/i viene eseguita sia per scopi di stadiazione (come nei pazienti con cancro al seno) sia per scopi terapeutici (come nei pazienti con melanoma cutaneo);
- se non si trovano cellule tumorali metastatiche nel/i linfonodo/i sentinella, è molto improbabile che altri linfonodi di quel particolare bacino ospitino metastasi per cui la linfadenectomia di completamento può essere omessa in sicurezza, risparmiando a questi pazienti interventi chirurgici aggiuntivi non necessari, con le relative complicanze.
Il concetto di linfonodo sentinella assume un valore patofisiologico speciale piuttosto che un valore puramente anatomico. In particolare, il linfonodo sentinella non è sempre il linfonodo anatomicamente più vicino al tumore, ma piuttosto il primo linfonodo che le cellule tumorali migranti attraverso i canali linfatici che drenano il sito tumorale incontrano lungo un certo percorso di drenaggio.
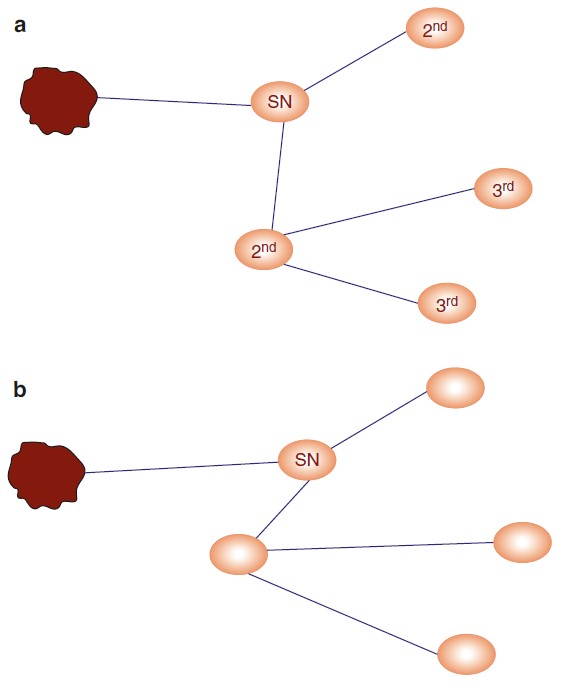
a) la mappatura linfatica per la biopsia del linfonodo sentinella presuppone che la linfa proveniente da un tumore primario (raffigurato qui con un colore rosso scuro) dreni verso un particolare linfonodo regionale prima di raggiungere i linfonodi di livello superiore lungo lo stesso percorso linfatico;
b) il linfonodo anatomicamente più vicino al tumore non è necessariamente a rischio diretto di ricevere cellule tumorali.
SN = linfonodo sentinella;
2nd = linfonodo di secondo livello;
3rd = linfonodo di terzo livello.
Oltre ad essere applicata di routine nei pazienti con cancro al seno e melanoma cutaneo, la biopsia radioguidata del linfonodo sentinella è in fase di validazione nei pazienti con una vasta gamma di altri tumori solidi epiteliali. In particolare, le neoplasie in cui la fattibilità e/o l’impatto clinico della biopsia radioguidata del linfonodo sentinella sono stati più approfonditamente studiati includono i tumori della testa e del collo e i tumori ginecologici (vulvari, cervicali ed endometriali). Altre applicazioni cliniche meno validate includono il cancro alla prostata, i tumori del tratto gastrointestinale (esofago, stomaco, colon-retto, ano), il carcinoma polmonare non a piccole cellule, il carcinoma tiroideo differenziato e altri.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.



