Il glucosio è un substrato energetico fondamentale, particolarmente importante per alcune cellule e tessuti vitali come il sistema nervoso, i globuli rossi e i leucociti. La sua capacità di fornire energia rapidamente e, entro certi limiti, anche in condizioni di carenza di ossigeno, gli conferisce un ruolo chiave che trascende i suoi limiti in termini di calorie prodotte per molecola e deposito nell’organismo sotto forma di glicogeno in quantità relativamente limitate.
Nei tessuti vitali, l’accesso al glucosio prescinde da regolazioni ormonali ed è condizionato solo dai suoi livelli in circolo. Negli altri tessuti, invece, l’accesso al glucosio è variabile e strettamente dipendente dalla regolazione ormonale. Pertanto, una fine regolazione omeostatica della glicemia è di importanza cruciale.
La rilevanza del ruolo e i limiti di disponibilità del glucosio spiegano perché esista una gerarchia nel suo utilizzo. Le sue uniche proprietà permettono di fornire energia in tempi rapidissimi, che è essenziale per le funzioni dei tessuti vitali, garantendo un apporto costante nonostante le limitazioni di deposito e produzione di energia meno efficiente rispetto ad altri substrati.
Fattori endocrini per il controllo della glicemia
La glicemia è soggetta a un fine controllo omeostatico multifattoriale a feed-back, integrato a livelli superiori. I fattori endocrini che concorrono a mantenere costante la glicemia sono molteplici.
L’insulina svolge una funzione centrale in questa regolazione, attraverso il suo potente effetto ipoglicemizzante. La secrezione di questo ormone è strettamente regolata a feed-back positivo dalle variazioni glicemiche. Quando la glicemia tende a salire, la secrezione di insulina aumenta prontamente, mentre si riduce in caso di calo, anche lieve, dei livelli circolanti di glucosio.
Gli ormoni controinsulari, che contrastano la caduta glicemica, includono adrenalina, glucagone, cortisolo e GH (ormone della crescita). Questi ormoni hanno molti altri effetti oltre a quello sulla glicemia, e spesso tali effetti sono di segno opposto rispetto a quelli dell’insulina.
Il nucleo ventro-mediale dell’ipotalamo sembra essere l’area di maggiore importanza nell’integrazione della risposta ormonale all’ipoglicemia, coinvolgendo probabilmente diversi altri siti del sistema nervoso centrale.
Meccanismi di azione
- Insulina: la sua azione ipoglicemizzante risulta da uno stimolo alla captazione e al metabolismo del glucosio nei tessuti sensibili, principalmente nei muscoli, e da un’inibizione della produzione endogena di glucosio, soprattutto da parte del fegato. Sotto l’azione ormonale, il glucosio può essere immediatamente utilizzato per produrre energia nelle cellule insulino-dipendenti. Inoltre, l’insulina inibisce la lipolisi e la chetogenesi, modula il metabolismo proteico con un’azione anabolica complessiva e ha importanti effetti sul sistema cardiovascolare.
- Glucagone: ha un effetto anti-insulinico a livello epatico, incrementando la produzione endogena di glucosio attraverso la stimolazione della glicogenolisi e della gluconeogenesi, e favorendo la conversione degli acidi grassi in corpi chetonici. È fondamentale nella risposta all’ipoglicemia acuta.
- Catecolamine: agiscono a svariati livelli, modulando anche la secrezione di tutti gli altri ormoni coinvolti nella glicoregolazione. I loro effetti sono rapidissimi e includono la riduzione della sensibilità tessutale all’insulina e un potente stimolo alla lipolisi. I loro effetti metabolici e emodinamici sono cruciali per l’adattamento dell’organismo alle perturbazioni dell’omeostasi.
- Cortisolo: esplica i suoi effetti metabolici principalmente a livello muscolare, stimolando il catabolismo proteico con rilascio di amminoacidi che costituiscono un substrato per la gluconeogenesi epatica. Favorisce inoltre la lipolisi, sebbene in modo differenziato a seconda della sede corporea.
- GH: contrasta l’azione dell’insulina riducendo la captazione e il metabolismo del glucosio nei tessuti periferici e stimolando la lipolisi. Favorisce inoltre la sintesi proteica e la proliferazione cellulare.
L’apparente ridondanza del sistema endocrino controregolatore è espressione dell’importanza per la sopravvivenza dei meccanismi che impediscono la caduta della glicemia. Il difetto di uno degli ormoni controinsulari può essere compensato dagli altri ormoni iperglicemizzanti, sebbene tale capacità di compenso non sia assoluta.
L’effetto lipolitico di molti ormoni controinsulari ha importanti riflessi sul metabolismo glucidico. Esiste infatti una competizione per i processi ossidativi tra glucosio e acidi grassi liberi (FFA), e l’aumentata disponibilità di questi ultimi induce un ridotto utilizzo del glucosio e una ridotta sensibilità tessutale all’azione insulinica. Questo meccanismo è particolarmente rilevante nelle condizioni di insulino-resistenza.
Il trasporto del glucosio
Il trasporto transmembrana del glucosio è un processo altamente regolato. L’utilizzo cellulare del glucosio richiede il suo passaggio preliminare attraverso la membrana plasmatica.
Il passaggio del glucosio contro gradiente di concentrazione avviene nella parte apicale delle cellule epiteliali responsabili dei processi di assorbimento intestinale e riassorbimento renale. Questo processo attivo è operato da un gruppo di almeno 6 trasportatori Na-dipendenti, denominati SGLT.
Il passaggio transmembrana del glucosio con finalità metaboliche avviene secondo gradiente, attraverso un processo di trasferimento bidirezionale facilitato del substrato (energia-indipendente). Questo è mediato da una numerosa famiglia di proteine glicosilate, denominati GLUT (GLUT1-14) e HMIT1 (H+-myo-inositol cotransporter o GLUT 13), raggruppati in 3 classi sulla base delle loro caratteristiche molecolari.
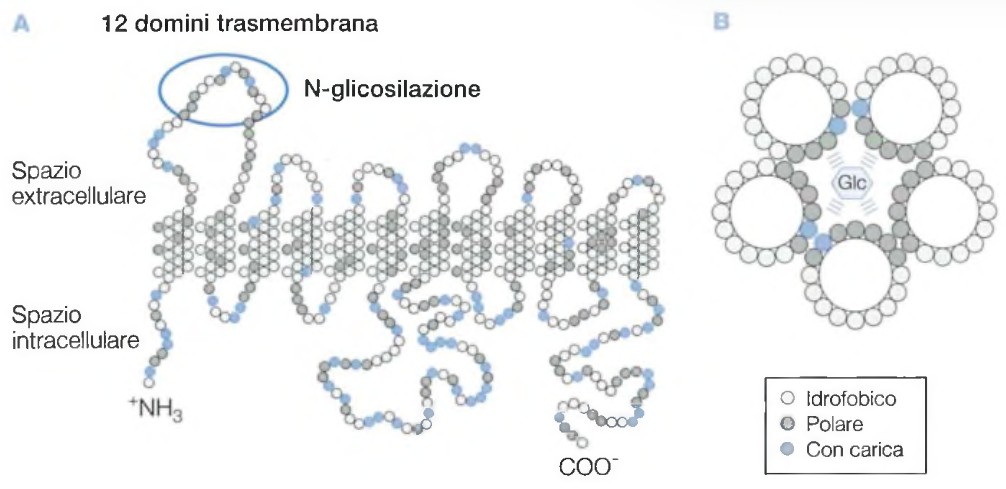
B. Rappresentazione della configurazione spaziale del trasportatore, con associazione di 5 eliche anfipatiche. La parte polare è orientata verso la cavità interna. Il glucosio può interagire con la proteina mediante ponti idrogeno.
Queste proteine, di circa 500 amminoacidi, appartengono alla superfamiglia dei facilitatori maggiori (MFS, Major Facilitator Superfamily) e sono tutte caratterizzate da 12 domini transmembrana, con entrambi gli estremi, amminoterminale e carbossiterminale, sul lato interno della membrana e una catena oligosaccaridica extracellulare.
Le strutture differiscono per specificità di substrato, proprietà cinetiche e distribuzione tessutale:
- GLUT1: espresso soprattutto negli eritrociti e nell’endotelio della barriera ematoencefalica.
- GLUT3: il principale trasportatore nei neuroni, presente sia nei dendriti che negli assoni, e nelle cellule del sistema immunitario (linfociti, monociti/macrofagi). È fondamentale per il trasporto del glucosio nei tessuti vitali.
- GLUT2: presente nella cellula β-pancreatica e nel fegato. Permette di ottenere l’equilibrio tra il glucosio extra- e intracellulare in un ampio range di glicemia. In tessuti che esplicano neoglucogenesi, il trasporto può avvenire anche in senso opposto. Nella cellula β-pancreatica partecipa alla regolazione glucosio-dipendente della funzione insulinica, consentendo una relazione proporzionale fra glicemia e rilascio di insulina fino a valori glicemici intorno a 10-12 mM.
- GLUT4: trasportatore modulato dall’insulina e dalla contrazione muscolare.
Questi trasportatori sono essenziali per il mantenimento delle funzioni metaboliche vitali, contribuendo a una regolazione precisa e dinamica dei livelli di glucosio nei vari tessuti.
| Trasportatore | Distribuzione tessutale | Caratteristiche |
|---|---|---|
| GLUT 1 | SNC (microcircolo), eritrociti | Alta capacità, affinità relativamente alta |
| GLUT 2 | β-cellula, fegato | Alta capacità, bassa affinità; trasporta anche fruttosio |
| GLUT 3 | SNC (neuroni) | Alta capacità, alta affinità |
| GLUT 4 | Muscolo, tessuto adiposo, miocardio | Traslocazione alla superficie cellulare e attività modulate da insulina/esercizio fisico |
| GLUT 5 | Intestino, rene, testicolo | Trasporta selettivamente fruttosio |
| GLUT 6 | SNC, leucociti | Traslocazione alla superficie cellulare non modulata da insulina |
| GLUT 7 | ?? | |
| GLUT 8 | SNC, testicolo | Modulato nel testicolo da hCG, IGF e citochine; responsivo a insulina e glicemia (?) |
| GLUT 9 | Fegato, rene, placenta, leucociti | Bassa affinità |
| GLUT 10 | Fegato, pancreas | Polimorfismo genetico assodato a insulinemia |
| GLUT 11 | Muscolo, miocardio | Trasporto del glucosio inibito dal fruttosio; espresso selettivamente in fibre lente |
| GLUT 12 | Prostata, miocardio, placenta, ghiandola mammaria | |
| HMIT 1 | SNC | Trasporta selettivamente mioinositolo |
Il sistema dell’insulina
Il rilascio di insulina viene modulato fisiologicamente attraverso un processo calcio-dipendente, attivato dal metabolismo del glucosio nella β-cellula.
Lo stimolo glicemico al rilascio di insulina è un processo complesso che include:
- fosforilazione e metabolizzazione del glucosio: all’interno della β-cellula, porta alla formazione di ATP e a un aumento del rapporto ATP/ADP;
- inibizione dei canali del potassio ATP-dipendenti: causa la depolarizzazione della membrana;
- apertura dei canali del calcio voltaggio-dipendenti: porta a un aumento della concentrazione di calcio intracellulare ([Ca2+]i) e alla fusione dei granuli di deposito intracellulari contenenti l’insulina preformata con la membrana citoplasmatica.
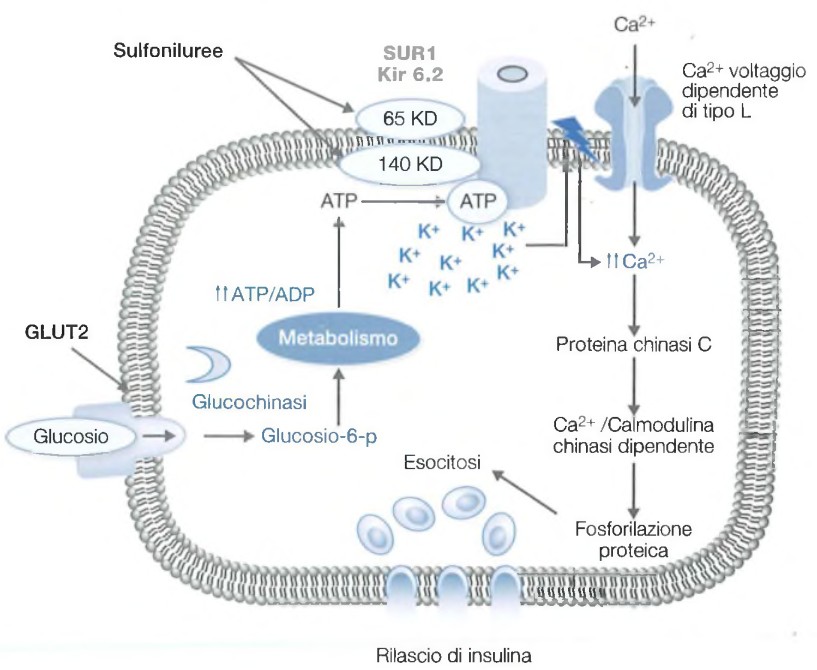
Sono riportate la via metabolica che media la risposta al glucosio e il meccanismo d’azione delle sulfoniluree, classe di farmaci che stimola la liberazione di insulina legandosi a un recettore posto sulla membrana della β-cellula, denominato recettore per le sulfoniluree (SUR1/ABCC8) e che corrisponde a una subunità dei canali del potassio ATP-sensibili. Le sulfoniluree esercitano i loro effetti sulla β-cellula mimando l’aumento del rapporto ATP/ADP indotto fisiologicamente dagli stimoli metabolici. Anche le glinidi agiscono con un meccanismo analogo, ma si legano a un sito di SURI distinto da quello delle sulfoniluree.
La fosforilazione del glucosio da parte della glucochinasi è considerata la tappa limitante e il vero sensore del glucosio.
L’insulina viene secreta in maniera pulsatile con picchi ad alta frequenza ogni 10-15 minuti. Gli stimoli secretagoghi aumentano l’ampiezza dei singoli picchi secretori, ma i meccanismi alla base di questo pattern secretorio sono ancora in gran parte sconosciuti. La degradazione dell’insulina è molto rapida (emivita circa 4 minuti) e avviene principalmente a livello epatico, spesso attraverso endocitosi dei complessi ormone-recettore.
L’aumento dell’AMP ciclico, indotto dal glucagone e da altri ormoni gastrointestinali, favorisce l’esocitosi dell’insulina. Questo spiega perché la risposta β-cellulare al glucosio sia più marcata quando somministrato per via orale rispetto alla somministrazione endovenosa, un fenomeno noto come effetto incretinico.
Le incretine includono:
- GIP (polipeptide insulinotropico glucosio-dipendente): prodotto dalle cellule K del digiuno e del duodeno, stimola il rilascio di insulina e la proliferazione delle β-cellule, contribuendo al mantenimento della massa β-cellulare.
- GLP-1 (peptide glucagone simile): prodotto dalle cellule enteroendocrine L nell’intestino tenue e nel colon. Stimola la secrezione di insulina, inibisce la secrezione di glucagone e ha un effetto trofico e antiapoptotico sulle β-cellule. È coinvolto nel controllo dei meccanismi della fame e della sazietà a livello cerebrale.
Regolazione del GLUT4
Il trasportatore del glucosio GLUT4 è modulato dall’insulina e dall’esercizio fisico attraverso meccanismi diversi. Nei tessuti insulino-dipendenti, l’insulina stimola la traslocazione di GLUT4 dalle vescicole di deposito intracellulari alla superficie della cellula, aumentando l’attività intrinseca del trasportatore.
L’attivazione della PI3K porta alla liberazione di GLUT4 dalle membrane intracellulari, con un segnale che si biforca seguendo due assi principali:
- AKT→AS160→Rab: fosforilazione del substrato di 160 kDa di AKT, inibendo l’attività delle proteine Rab-GTPasi.
- Rac→actina→α-actinina4: promuove la fusione delle vescicole contenenti GLUT4 con la membrana plasmatica.
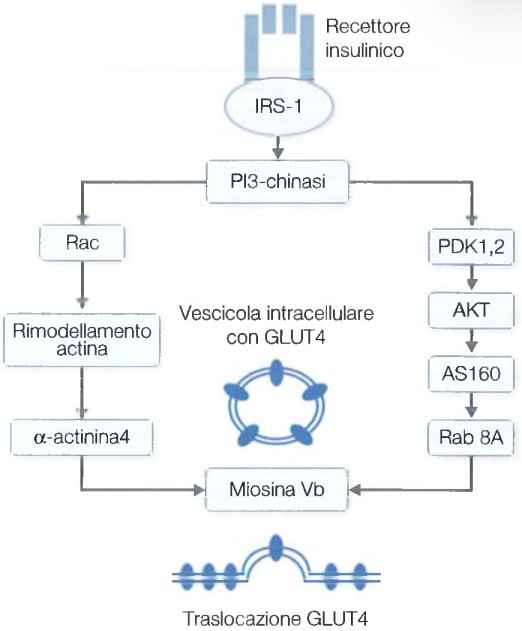
L’insulina, attraverso vari meccanismi, induce la traslocazione dei GLUT4 dai depositi intracellulari alla membrana citoplasmatica, aumentando parallelamente l’attività di tali trasportatori.
A valle della fosfatidilinositolo 3-chinasi, il segnale insulinico si biforca seguendo due assi principali:
- AKT→AS160→Rab
- Rac→actina→α-actinina4
Le due vie convergono infine in un processo che libera GLUT4 dal legame con una proteina che lo ancora e determina la fusione delle vescicole intracellulari contenenti il trasportatore con la membrana plasmatica.
Anche la contrazione muscolare induce la traslocazione di GLUT4, ma attraverso meccanismi indipendenti dall’insulina, suggerendo un ruolo dell’enzima proteinchinasi AMP-dipendente (AMPK) nell’incremento della captazione del glucosio indotto dall’esercizio fisico.
Questi processi spiegano l’effetto additivo che insulina e attività fisica hanno sul trasporto del glucosio nel muscolo, con implicazioni pratiche nell’interazione tra insulina o farmaci antidiabetici secretagoghi ed esercizio fisico.
Il recettore per l’insulina e il suo sistema di trasduzione
L’insulina esplica i suoi effetti modulando l’attività di un recettore specifico di membrana, strutturalmente molto simile al recettore per l’IGF-1 (Insulin-like Growth Factor-1) e ad attività tirosinchinasica.
Esistono due isoforme del recettore insulinico, denominate A e B, prodotte dallo stesso gene tramite splicing alternativo:
- Isoforma A: prevalente nello sviluppo embrionale e nei tessuti tumorali, media principalmente effetti mitogeni e di crescita, e mostra alta affinità sia per l’insulina che per l’IGF-II.
- Isoforma B: prevalente nella vita post-natale, induce effetti più spiccatamente metabolici e ha alta affinità solo per l’insulina.
Nonostante la simile affinità per l’insulina e l’IGF-II, la isoforma A presenta risposte biologiche almeno in parte diverse quando stimolata dai due ormoni:
- Isoforma A: induce una risposta metabolica all’insulina attenuata. Una disregolazione dello splicing recettoriale può causare alterata sensibilità all’insulina e diabete. Ad esempio, nella distrofia miotonica, caratterizzata da severa insulinoresistenza, è stata osservata una aumentata espressione di una proteina (CUG-BP) che modula questo splicing.
- Isoforma B: in β-cellule, l’insulina induce l’espressione del proprio gene tramite l’isoforma A e della glucochinasi tramite l’isoforma B, elemento chiave nella risposta secretoria agli stimoli metabolici.
L’iperglicemia cronica induce una riduzione dell’espressione del recettore nelle β-cellule e aumenta la quota relativa della isoforma B, associandosi a una riduzione della secrezione insulinica. Al momento, non ci sono strumenti farmacologici in grado di influenzare direttamente questi processi.
Il recettore per l’insulina è una tirosinchinasi capace di fosforilare vari substrati. Il legame con l’ormone determina la dimerizzazione del recettore e la autofosforilazione dei residui tirosinici sulla subunità β, con attivazione della tirosinchinasi. I siti di autofosforilazione fungono da punto di attracco per proteine denominate IRSs (Insulin Receptor Substrates), che rappresentano substrati per la tirosinchinasi. Finora sono stati identificati almeno 6 diversi IRS (IRS-1/IRS-6).
La fosforilazione degli IRS è indispensabile per l’attivazione delle reazioni a cascata, che mediano le differenti risposte biologiche all’ormone. Gli IRS non hanno attività catalitica propria ma possiedono multipli siti di legame per varie molecole, localizzati intorno a residui tirosinici attivati dal processo di fosforilazione. Fungono da elementi critici per l’accoppiamento spaziale fra il recettore insulinico e le molecole coinvolte nella trasmissione del segnale.
La fosforilazione in serina degli IRS inibisce la trasmissione del segnale insulinico. Alterazioni metaboliche, come eccesso cronico di glucosio o di FFA, e citochine adipocitarie, come il TNF-α, determinano questo risultato.
Le diverse risposte all’insulina variano a seconda del tessuto esaminato e della sensibilità alla regolazione ormonale:
- IRS-1: media gli effetti dell’insulina principalmente a livello muscolare e adiposo.
- IRS-2: ha un ruolo rilevante anche a livello epatico e delle β-cellule.
La riduzione della capacità secretoria delle β-cellule, che accompagna e determina il passaggio dall’insulinoresistenza compensata al diabete tipo 2, è influenzata da una combinazione di fattori genetici e acquisiti, fra cui alterazioni metaboliche come iperinsulinemia, iperglicemia e iperlipidemia.






