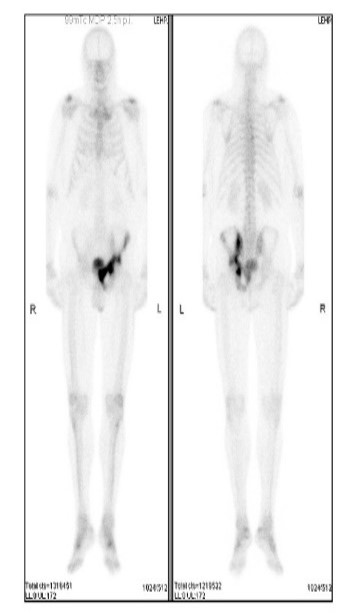
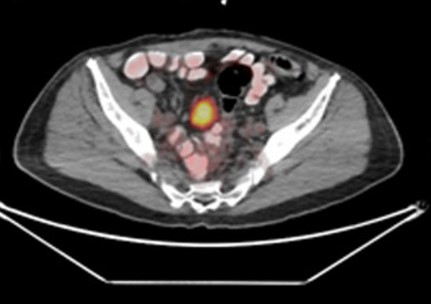
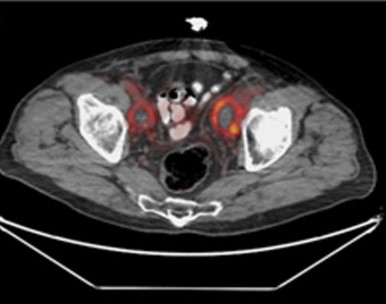
La PET PSMA (Positron Emission Tomography con il radiotracciante PSMA) è una tecnica diagnostica avanzata utilizzata principalmente nel contesto del tumore prostatico per valutare la presenza e la diffusione della malattia, particolarmente nelle fasi di diagnosi precoce, stadiazione e monitoraggio delle recidive.
Il tumore prostatico è uno dei tumori più comuni tra gli uomini, specialmente nelle popolazioni anziane. La crescita del tumore prostatico è generalmente lenta, e molti casi non presentano sintomi nelle fasi iniziali. Il rischio di sviluppare il tumore aumenta con l’età, con una prevalenza maggiore nei soggetti con storia familiare di cancro alla prostata e in quelli di etnia africana. Altri fattori di rischio includono livelli elevati di testosterone, dieta ricca di grassi animali, e alcune mutazioni genetiche.
Il segno più comune in fase avanzata è l’aumento del PSA (Antigene Prostatico Specifico) nel sangue, che può essere usato come indicatore di malattia, anche se non è specifico. La diagnosi definitiva viene effettuata attraverso biopsia prostatiche, in cui un campione di tessuto della prostata viene esaminato per rilevare la presenza di cellule tumorali.
Il PSMA (Prostate-Specific Membrane Antigen) è una proteina di membrana presente in quantità elevate nelle cellule tumorali prostatiche, rendendola un obiettivo ideale per l’imaging PET.
Il trattamento del tumore prostatico dipende dal grado di aggressività e dallo stadio della malattia, e può includere chirurgia, radioterapia, ormonoterapia, o una combinazione di questi. La prognosi è generalmente favorevole, con molte forme di tumore prostatico che progrediscono lentamente, ma ciò dipende anche dal grado di rischio della malattia.
Stadiazione TNM
La stadiazione TNM valuta l’estensione della neoplasia nel corpo:
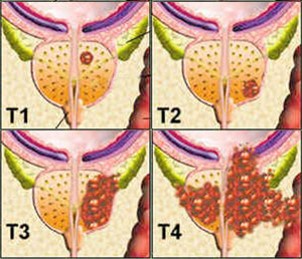
- T1: Tumore clinicamente non apprezzabile (molto circoscritto, ER negativa, ECO negativa)
- T1a: riscontro incidentale (<5%) dopo intervento disostruttivo;
- T1b: riscontro incidentale (>5%) dopo intervento disostruttivo;
- T1c: tumore diagnosticato mediante biopsia prostatica.
- T2: Tumore limitato alla prostata (tumore circoscritto, ER positiva o tumore visibile in ECO)
- T2a: tumore che interessa la metà o meno di un lobo;
- T2b: tumore che interessa più della metà di un lobo;
- T2c: tumore che interessa entrambi i lobi (bilaterale);
- T3: Tumore esteso al di fuori della prostata (extracapsulare)
- T3a: tumore con estensione extraprostatica con invasione della capsula (unilaterale o bilaterale);
- T3b: tumore che invade una o entrambe le vescichette seminali;
- T4: Tumore fisso o infiltrante organi vicini (invasione periprostatica)
- N: Linfonodi regionali
- N0: assenza di infiltrazione dei linfonodi regionali;
- N1: presenza di infiltrazione dei linfonodi regionali;
- M: Metastasi a distanza
- M0: non metastasi a distanza;
- M1: presenza di metastasi a distanza;
- M1a: metastasi in linfonodi non regionali;
- M1b: metastasi ossee;
- M1c: metastasi in altre sedi.
La scala di Gleason
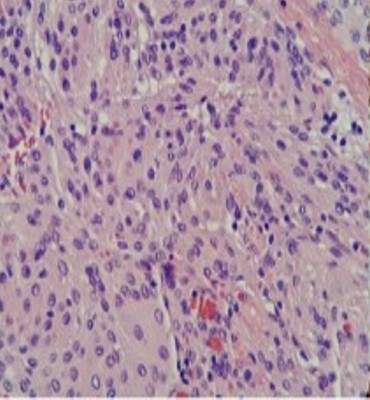
La scala di Gleason è un sistema di classificazione utilizzato per descrivere l’aggressività del carcinoma prostatico. Si basa sull’aspetto delle cellule tumorali osservate al microscopio e sull’analisi della loro somiglianza con il tessuto prostatico normale. Più il tumore è diverso dal tessuto sano, più è aggressivo.
La scala di Gleason assegna un punteggio da 1 a 5 a ciascuna delle due aree più prominenti del tumore, basandosi su quanto le cellule tumorali siano differenziate:
- Gleason 1: le cellule tumorali sono molto simili alle cellule normali, quindi meno aggressive.
- Gleason 2: le cellule tumorali sono un po’ più disorganizzate, ma ancora abbastanza simili alle cellule normali.
- Gleason 3: le cellule tumorali sono più irregolari e meno simili al normale tessuto prostatico.
- Gleason 4: le cellule tumorali sono chiaramente disorganizzate e sembrano molto diverse dal normale tessuto.
- Gleason 5: le cellule tumorali sono estremamente irregolari, con una struttura molto anomala e disorganizzata.
Si scelgono i due punteggi più comuni per il tumore: uno per l’area principale e uno per l’area secondaria.
I due punteggi vengono sommati per ottenere un punteggio Gleason finale che va da 2 a 10.
- Basso punteggio (≤6): tumore meno aggressivo, con una prognosi generalmente migliore.
- Punteggio intermedio (7): tumore moderatamente aggressivo, con una prognosi intermedia.
- Alto punteggio (≥8): tumore molto aggressivo, con una prognosi meno favorevole.
Esempio di punteggio:
- Gleason 6 (3+3): Tumore meno aggressivo, a crescita lenta.
- Gleason 7 (3+4 o 4+3): Tumore di aggressività intermedia.
- Gleason 9 (4+5 o 5+4): Tumore ad alta aggressività, con una crescita rapida e maggiore probabilità di diffusione.
Classi di rischio
In base allo stadio TNM, al grading secondo il Gleason Score e i valori di PSA ematici è possibile distinguere i pazienti con adenocarcinoma prostatico in diverse categorie di rischio.
| RISCHIO | STADIO | GRADO | PSA (ng/ml) | ||
|---|---|---|---|---|---|
| Molto basso | T1c | + | ≤ 3+3 | + | < 10 |
| Basso | T2a | + | ≤ 3+3 | + | < 10 |
| Intermedio favorevole | T2b | e/o | 3+4 | e/o | Tra 10 e 20 |
| Intermedio sfavorevole | T2c | e/o | 4+3 | e/o | Tra 10 e 20 |
| Alto | T3a | e/o | 4+4 | e/o | Qualsiasi |
| Molto alto | T3b – T4 | e/o | ≥ 4+4 | e/o | Qualsiasi |
| Metastasi | N+ e/o M+ | Qualsiasi | Qualsiasi |
In base a queste classi di rischio viene deciso l’approccio terapeutico
| Classe di rischio | Osservazione | Intento curativo | Cronicizzazione/Palliazione |
|---|---|---|---|
| Molto basso | Sorveglianza attiva | Chirurgia/RTH | |
| Basso | Vigile attesa* | Chirurgia/RTH | |
| Intermedio | Vigile attesa* | Chirurgia/RTH esclusiva o con associata OT | OT* |
| Alto | NO | RTH + OT o Chirurgia* | OT* |
| Molto alto | NO | RTH + OT/Chirurgia* | OT |
| Metastasi | NO | NO | OT / CTH / RTH palliativa / Radiofarmaci |
OT: ormonoterapia
CTH: chemioterapia
RTH: radioterapia
Indicazioni e controindicazioni cliniche attuali alla PSMA PET
Secondo le linee guida AIMN, EAU, SIU, AIOM, la PET con PSMA è indicata in caso di:
- stadiazione pre-chirurgica del carcinoma prostatico intermedio-sfavorevole o ad alto rischio (PSA ≥ 20 ng/ml e/o GS ≥ 4+3 e/o stadio clinico T2c–3a);
- ristadiazione per ripresa biochimica (BRC) dopo prostatectomia radicale se PSA > 0,2 ng/ml misurato tra 6 e 13 settimane dopo l’intervento;
- ristadiazione per ripresa biochimica (BRC) dopo radioterapia ad intento radicale se PSA > 2 ng/ml al di sopra del PSA nadir post-radioterapia, con o senza terapia di deprivazione androgenica (ADT);
- ristadiazione in paziente con persistenza biochimica (BCP), definita come un PSA persistentemente elevato ≥ 0,1 ng/mL oltre 6 settimane dopo prostatectomia;
- ristadiazione in paziente con carcinoma prostatico resistente alla castrazione non metastatico (nmCRPC) nonostante una terapia di deprivazione androgenica (ADT) efficace. Condizioni necessarie sono l’aumento progressivo del PSA (tre incrementi consecutivi, con due aumenti del 50% rispetto al nadir), un PSA > 2 ng/mL e assenza di metastasi all’imaging convenzionale (TC o scintigrafia ossea);
- stadiazione pre-terapia con RLT PSMA per il carcinoma prostatico metastatico (confermare l’idoneità alla RLT attraverso la documentazione dell’espressione di PSMA nelle sedi metastatiche e valutare la probabilità di risposta alla terapia radioligante).
Oltre a queste indicazioni la PET con PSMA è utile come:
- guida per la biopsia prostatica (migliora la localizzazione del tumore e guida le biopsie ripetute nei pazienti con sospetto elevato di carcinoma prostatico e biopsie precedenti negative);
- imaging del carcinoma prostatico metastatico (migliore accuratezza diagnostica rispetto alla scintigrafia ossea e all’imaging convenzionale);
- monitoraggio del trattamento sistemico nel carcinoma prostatico metastatico.
L’unica controindicazione relativa è la claustrofobia o ridotta compliance del paziente a mantenere l’immobilità.
Controindicazione assoluta è uno stato di gravidanza nei casi in cui l’indagine sia richiesta nelle patologie oncologiche non prostata correlate.
Evidenze scientifiche fanno emergere un incremento della espressione recettoriale nel carcinoma prostatico in corso di terapia di deprivazione androgenica nei pazienti ormono-resistenti (mentre non si evidenzia negli ormono-sensibili)
E’ un fenomeno transitorio che fa riferimento alle prime 3-4 settimane dall’avvio dell’ADT.
Allo stato attuale la concomitante somministrazione di terapie sistemiche non rappresenta una controindicazione assoluta alla esecuzione della PSMA-PET in paziente con recidiva biochimica né si ritiene necessaria la sospensione della terapia. Bisogna tuttavia tener conto del timing dall’inizio del trattamento ADT per prevenire erronee interpretazioni tipo progressione di malattia se la PET viene eseguita a breve distanza dall’inizio della cura.
Interpretazione delle immagini (F- vs Ga-PSMA)
Per quanto riguarda i vantaggi dei PSMA fluorati vi sono: elevata emivita, elevata disponibilità di dosi se si possiede un ciclotrone, scarsa escrezione con le urine (consente miglior accuratezza diagnostica sulla recidiva locale, miglior identificazione dell’infiltrazione retto-vescicale e delle vescichette seminali).
Le tempistiche di acquisizione:
- PSMA legati al 68Ga: dopo 50-60 minuti dalla iniezione;
- PSMA florurati: in genere vengono consigliati 120 minuti dopo l’iniezione ma la lunga tempistica di attesa diventa mal tollerata dal paziente. La maggior parte dei Centri acquisiscono dopo 90 minuti per ragioni pratiche, tuttavia alcuni recenti lavori suggeriscono una acquisizione precoce a 60 minuti e poi eseguire una seconda rilevazione tardiva dopo 30 minuti nelle sedi di interesse per incrementare la specificità dell’esame (un incremento del SUVmax > 10% rispetto a stazionarietà o riduzione è maggiormente predittivo di lesione neoplastica).
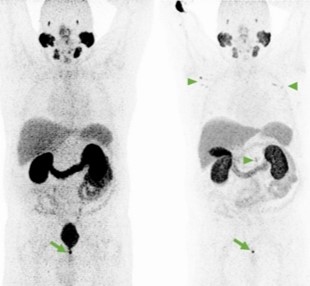
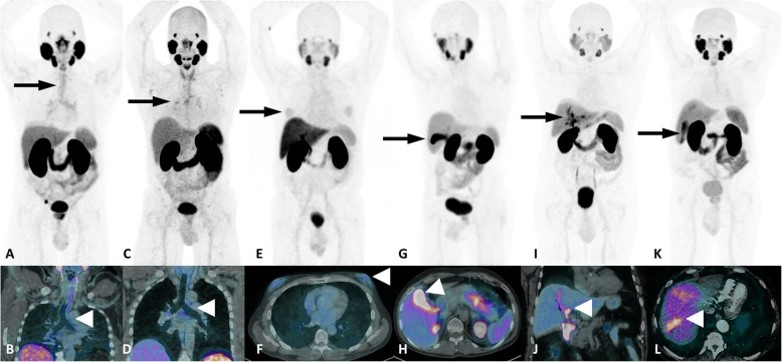
Entrambi i traccianti presentano siti di fisiologica captazione:
- intensa: in corrispondenza di ghiandole salivari maggiori e minori, ghiandole lacrimali, milza, interstizio renale da riassorbimento al tubulo contorto distale, colecisti, vie biliari, intestino tenue;
- moderata: a livello del fegato, pancreas, gangli e paragangli del sistema ortosimpatico.
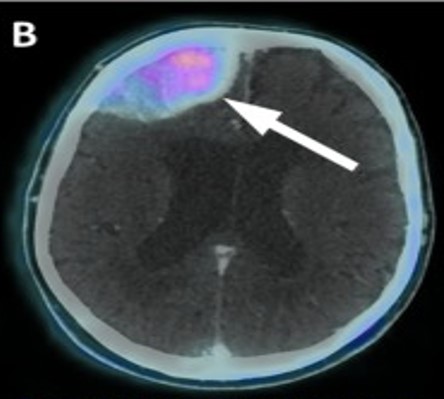
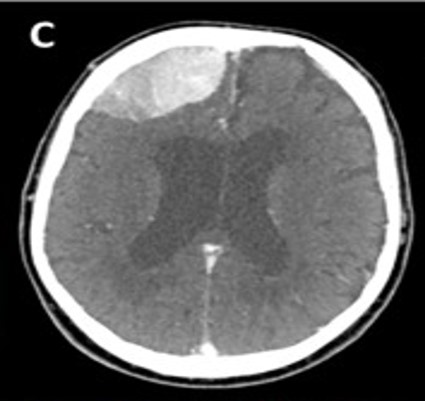
Ulteriori siti di accumulo del radiofarmaco, al di fuori della fisiologica distribuzione corporea, sono:
- reperti neoplastici;
- reperti non neoplastici: flogosi, ad esempio captazione a livello di trachea e bronchi o captazioni del tutto aspecifiche e non correlate a processi infiammatori.
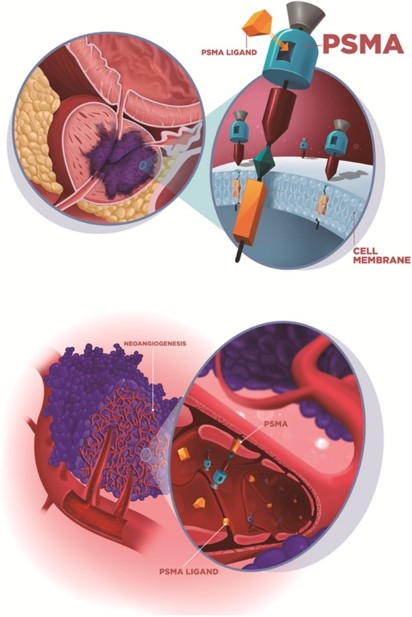
La spiegazione di questa captazione è determinata dal fatto che la molecola di PSMA non è espressa solo dalla prostata ma è presente anche in condizioni di benignità riconducibili all’attività osteoblastica (osteoartrite, displasia fibrosa, riparazione delle fratture, dopo radioterapia e nella malattia di Paget).
L’accumulo non specifico è invece correlato all’elevata espressione di recettori nelle cellule endoteliali della neovascolarizzazione dell’angiogenesi e alla elevata permeabilità delle cellule infiammatorie nei siti di flogosi (legame con il recettore beta del folato presente nei macrofagi) che perciò rappresentano falsi positivi.
Per tali motivi la captazione del PSMA è molto specifica ma non esclusiva del tumore della prostata.
| Altre neoplasie benigne/maligne | Situazioni non neoplastiche |
|---|---|
| Carcinoma a «cellule chiare» del rene (rara) Carcinoma uroteliale (rara) HCC (frequente) Gliomi e meningiomi (rara) Neoplasie polmonari (rara) Tumore desmoide o fibromatosi aggressiva (comune) Morbo di Paget (rara) Angiolipoma (comune) LNH follicolare (rara) Mieloma multiplo (comune) Carcinoma mammario (rara) Schwannoma (rara) Timoma (rara) | Splenosi (comune) Gangli e paragangli stellati, celiaci, ipogastrici e presacrali (frequente) Sarcoidosi (comune) Siti di flogosi reattiva linfonodale (frequente) Displasia fibrosa ossea (frequente) Artrite (frequente) Neurofibromatosi (rara) Esiti di fratture (frequente) Esiti di radioterapia (comune) Angioma osseo (comune) Poliangite eosinofila con granulomatosi (rara) Infezioni polmonari (comune) Ginecomastia (comune) Fascite nodulare (rara) |
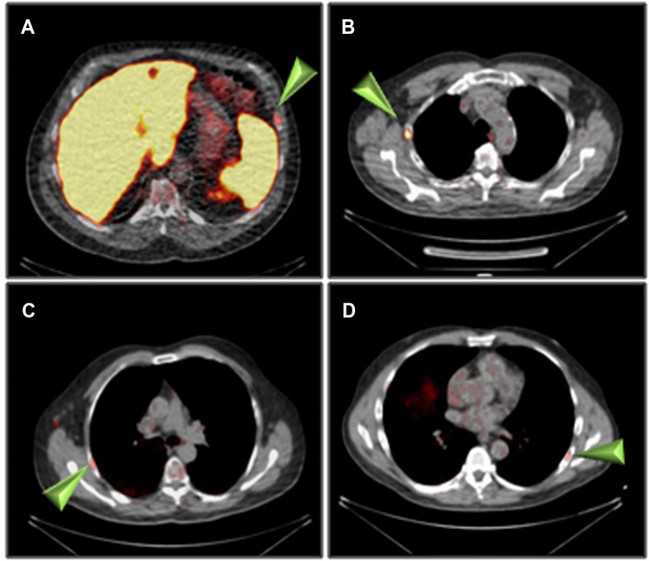
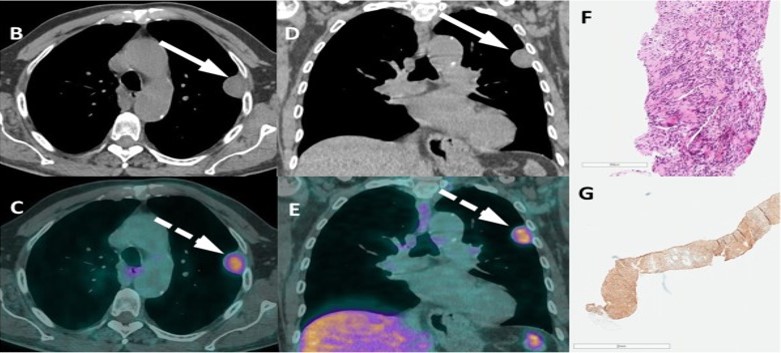
Ulteriori captazioni aspecifiche, anche se focali, si possono avere a livello scheletrico, specie con F-PSMA. La causa non è stata ancora identificata, ma alcuni studi hanno dimostrato che il valore del SUVmax può contribuire ad orientare verso una maggiore o minore probabilità di lesione neoplastica rispetto a sito di captazione aspecifica. E’ stato stabilito un cut-off di SUVmax pari 7. Tuttavia vi è l’eccezione del tumore desmoide che può avere SUVmax > 10.
La probabilità di descrivere veri positivi è funzione dei valori della biochimica:
- 38% per valori di PSA < 0,5 ng/ml;
- 57% per valori di PSA tra 0,5 e 1 ng/ml;
- 84% per valori di PSA tra 1 e 2 ng/ml;
- 86% per valori di PSA tra 2 e 5 ng/ml;
- 97% per valori di PSA > 5 ng/ml.
Non tutti i tumori della prostata esprimono elevata densità di recettori per il PSMA. Fino al 5% degli ADK della prostata non è rilevabile con la metodica, in particolare le forme aggressive o con sdifferenziazione neuroendocrina. In corso di terapie sistemiche i pazienti metastatici resistenti alla castrazione potrebbero presentare lesioni con ridotta espressione recettoriale. In genere sono forme PET FDG positive (indicatore prognostico sfavorevole).

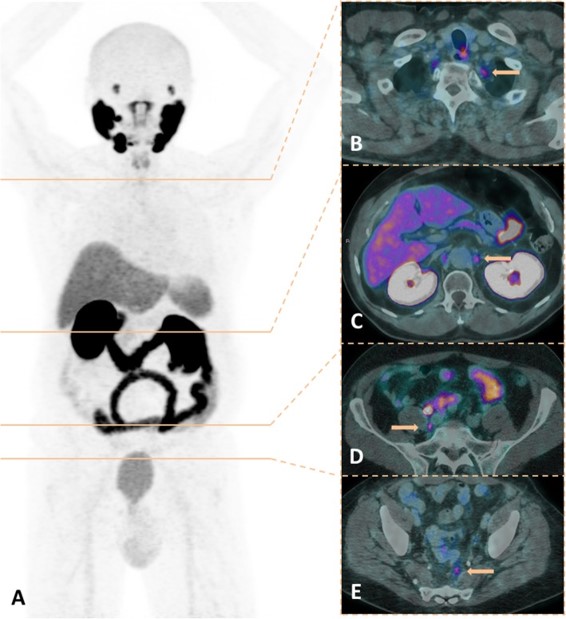
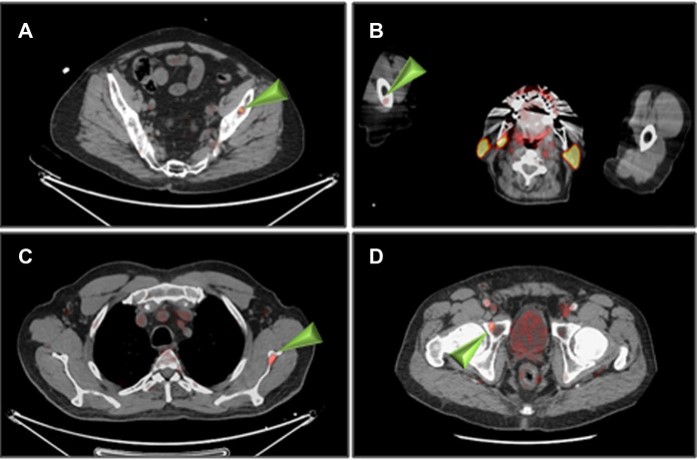
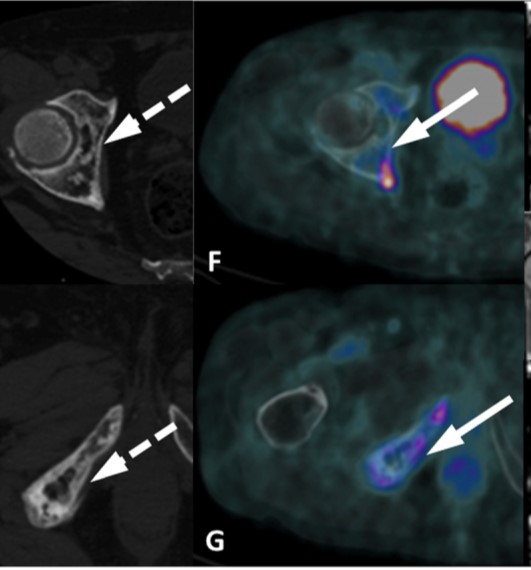
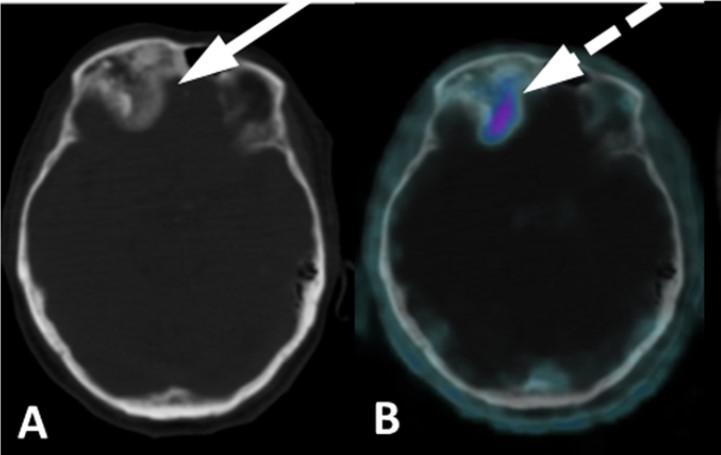
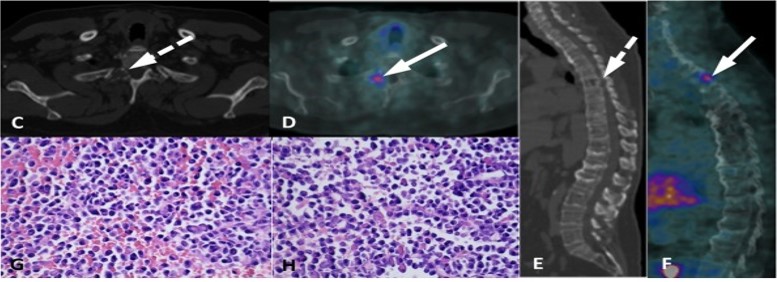
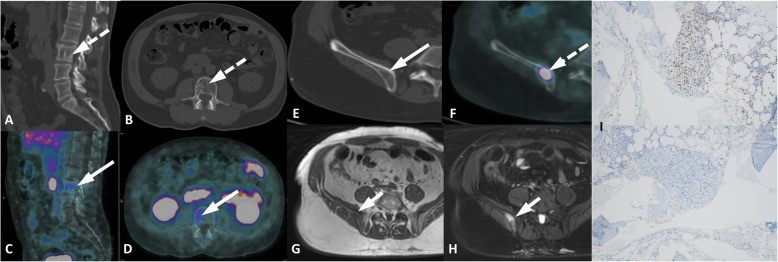
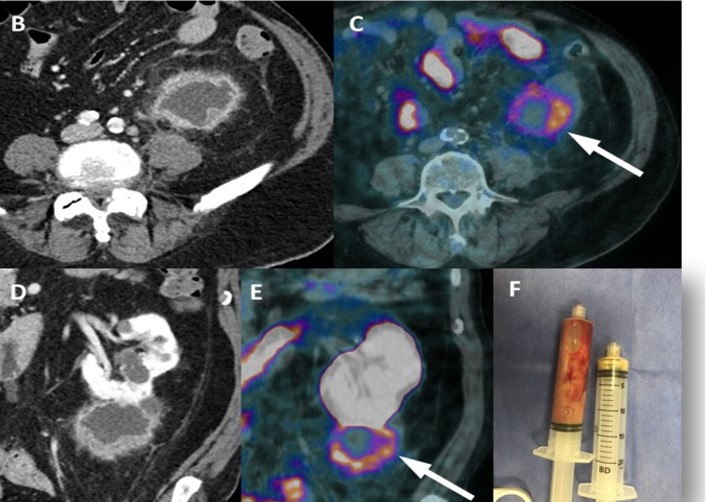
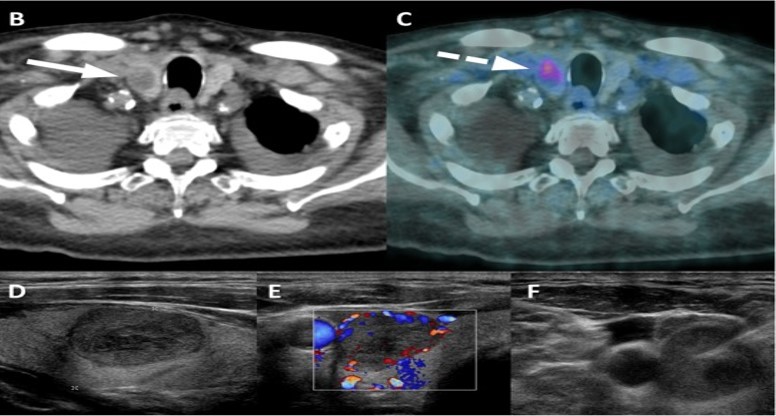
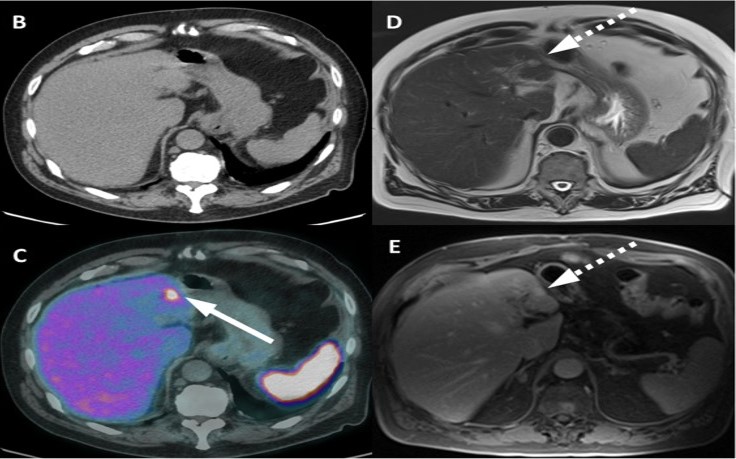
Esempi di captazioni fisiologiche/parafisiologiche e patologiche
Il tumore prostatico nella maggior parte dei casi è un tumore poco aggressivo e che garantisce una discreta prognosi sul paziente.
Il falso negativo rappresenta un “problema minore” poiché il follow-up del paziente prevede controlli clinici e strumentali ogni 3-4 mesi e questo consente nel tempo di recuperare l’errore diagnostico.
Il falso positivo può determinare un viraggio della terapia da intenti curativi verso intenti di cronicizzazione della malattia o palliativi; inoltre gli effetti collaterali dei trattamenti di cura (castrazione chimica, mielodisplasia, danno d’organo o funzionale da chemio o radioterapia) sono importanti.
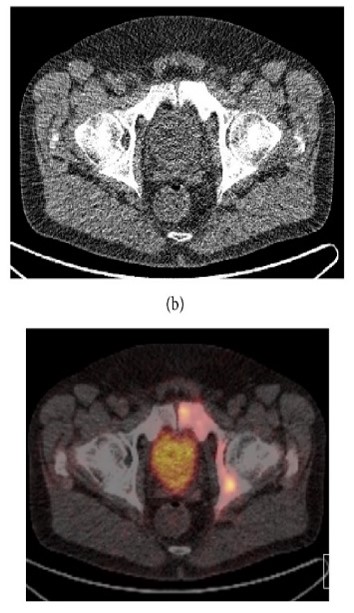
Un sito di incrementato accumulo del radiofarmaco deve essere considerato sospetto per lesione maligna se:
- maggiore del background circostante;
- non riconducibile a siti di captazione fisiologica;
- situato a carico di distretti anatomici compatibili con localizzazioni del carcinoma della prostata.