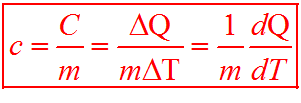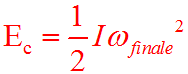Due corpi a temperatura diversa, messi in contatto tra loro, dopo un certo intervallo di tempo, sono in equilibrio termico, ovvero hanno la stessa temperatura (secondo il principio zero della termodinamica). Questo fenomeno avviene perché qualcosa si è trasferito dal corpo più caldo a quello più freddo. Questo qualcosa è il calore.
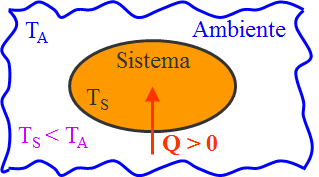
Il passaggio di calore tra due corpi implica un aumento o una diminuzione di energia interna di ciascuno di essi. Questo passaggio di calore viene considerato positivo quando l’energia termica (o energia interna) del sistema aumenta a spese dell’energie dell’ambiente circostante ed avviene quando la temperatura dell’ambiente è maggiore di quella del sistema: TS < TA. In questo caso si dice che il calore Q è assorbito dal sistema.
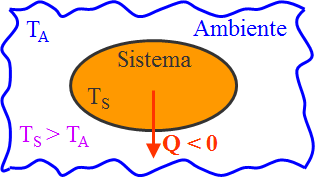
Se invece l’energia termica del sistema diminuisce, e quindi il passaggio di calore è negativo, l’energia viene ceduta all’ambiente circostante.
Il calore non è una forma di energia, come l’energia cinetica o quella potenziale, ma è un mezzo utilizzato per trasferire l’energia fra un sistema e l’ambiente circostante a causa della differenza di temperatura che esiste tra di loro. In meccanica il modo utilizzato per trasferire l’energia tra un sistema e l’ambiente circostante è il lavoro di una forza agente sul sistema durante il suo moto.
Calore e lavoro, a differenza della temperatura, della pressione, del volume e dell’energia meccanica che sono proprietà intrinseche di un sistema, descrivono il trasferimento di energia interna tra un sistema e l’ambiente circostante. Quindi non ha senso dire che un sistema o un corpo contiene una quantità di calore o una quantità di lavoro, ma bisogna dire che due sistemi possono scambiare calore se possiedono temperature diverse, oppure una certa energia tramite il lavoro.
Prima che i fisici sapessero che il calore è un’energia trasferita e non una forma di energia, il calore Q veniva misurato in funzione della sua capacità di elevare la temperatura dell’acqua.
Venne definita caloria la quantità di calore necessaria per far aumentare la temperatura di 1 grammo di acqua da 14,5 °C a 15,5 °C. Nel 1948 si decise che, essendo il calore una forma di energia trasferita, l’unità nel sistema internazionale dovesse essere il joule.
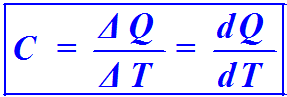
La quantità di calore necessaria per avere uno stesso aumento di temperatura per una massa varia da sostanza a sostanza. Ciò può essere rappresentato dalla formula: ΔQ = C⋅ΔT, in cui la C corrisponde alla capacità termica che dipende dalla massa di una sostanza ed è il rapporto tra la variazione di calore e la variazione di temperatura. L’unità di misura della capacità termica è il J/K.
Siccome la capacità termica dipende comunque dalla massa di una sostanza, occorre introdurre una nuova grandezza fisica: il calore specifico.
Abbiamo detto che la quantità di calore necessaria per far variare la temperatura di un corpo dipende anche dalla massa del corpo, oltre che dalla sua natura: ΔQ = c⋅m⋅ΔT.
La c è il calore specifico ed è definito come capacità termica per unità di massa. L’unità di misura è il J/(kg⋅K).
Il calore specifico dipende dalla temperatura, tuttavia per variazioni poco elevate può essere considerato costante. Nei gas esso dipende anche dalla modalità con cui il gas si riscalda o si raffredda. Più è basso il calore specifico, più velocemente assorbe calore la sostanza.
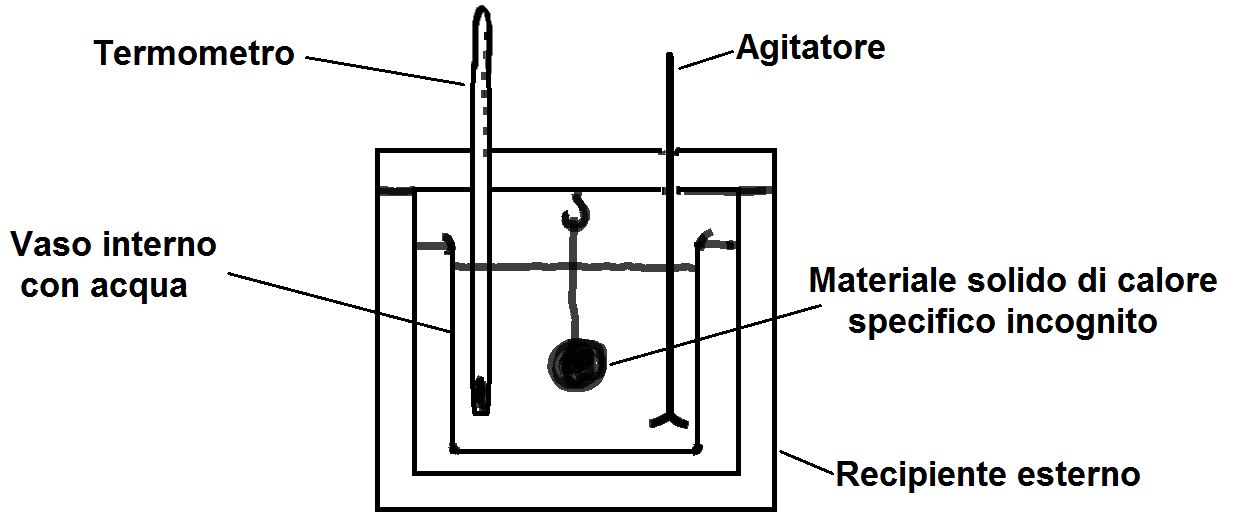
Il calore specifico di un solido può essere misurato utilizzando un calorimetro ad acqua, fatto di un sistema isolato in cui l’energia non può entrare o uscire. Per calcolare il calore specifico del materiale solido basta fare un bilancio termico utilizzando la variazione di temperatura misurata dal termometro sapendo che il calore ceduto dal campione è uguale al calore assorbito dall’acqua e dal calore assorbito dal calorimetro e quindi:
mcamp⋅ccamp⋅ΔTcamp = macq⋅cacq⋅ΔTacq + mcal⋅ccal⋅ΔTcal
Se andiamo ad isolare ccamp otteniamo:

Now loading…
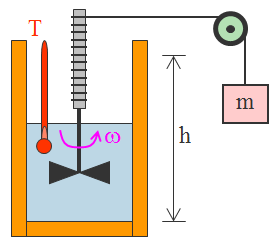
L’equivalenza tra calore e lavoro venne dimostrata per la prima volta da Joule nel 1850. L’energia meccanica da lui sfruttata è l’energia potenziale di una massa m che compie un lavoro lungo l’altezza h (ovvero il lavoro svolto dalla forza peso su m). Quindi: Em = m⋅g⋅h = WFp
Quando l’oggetto di massa m scende di altezza, il lavoro fatto dalla forza peso trasforma l’energia potenziale in energia cinetica di rotazione Ec che fa ruotare la ventola in acqua che, a sua volta, a causa dell’attrito tra l’elica e l’acqua, si trasforma in energia termica per cui si ha un aumento di temperatura.
Tutta l’energia cinetica, e quindi tutta l’energia meccanica del sistema dovuta all’energia potenziale, si è trasformata in energia interna dell’acqua. In questo esperimento l’energia meccanica non si conserva, ma, vale il principio di conservazione dell’energia totale.
L’attrito tra elica e acqua ha trasformato tutta l’energia meccanica in energia interna per cui è aumentata la temperatura. Lo stesso aumento di temperatura si può avere trasferendo una quantità di calore dall’ambiente esterno all’acqua, cioè riscaldando l’acqua.
Con questo esperimento, Joule ha dimostrato che eseguendo un lavoro sul sistema di acqua, o fornendo un calore al sistema dall’esterno, si dà luogo allo stesso aumento di temperatura. Per questo motivo calore e lavoro sono due forme diverse, ma equivalenti, per trasferire energia ad un sistema.
Nei suoi esperimenti Joule trovo che per uno stesso aumento di temperatura dell’acqua: ΔQ = cost⋅W. Questa costante era quasi sempre uguale a 4,186 a cui attribuì il nome di caloria. 1 caloria = 4,186 joule
Joule non aveva la possibilità di misurare la temperatura con la stessa precisione di oggi, né poteva valutare la quantità di calore persa attraverso le pareti del recipiente, come si può fare oggi. Ciò malgrado, i suoi esperimenti furono notevoli per l’abilità operativa e per l’influenza che essi ebbero nel convincere il mondo scientifico di metà 800 dell’equivalenza tra calore e lavoro.
Fonte: Fisica biomedica.