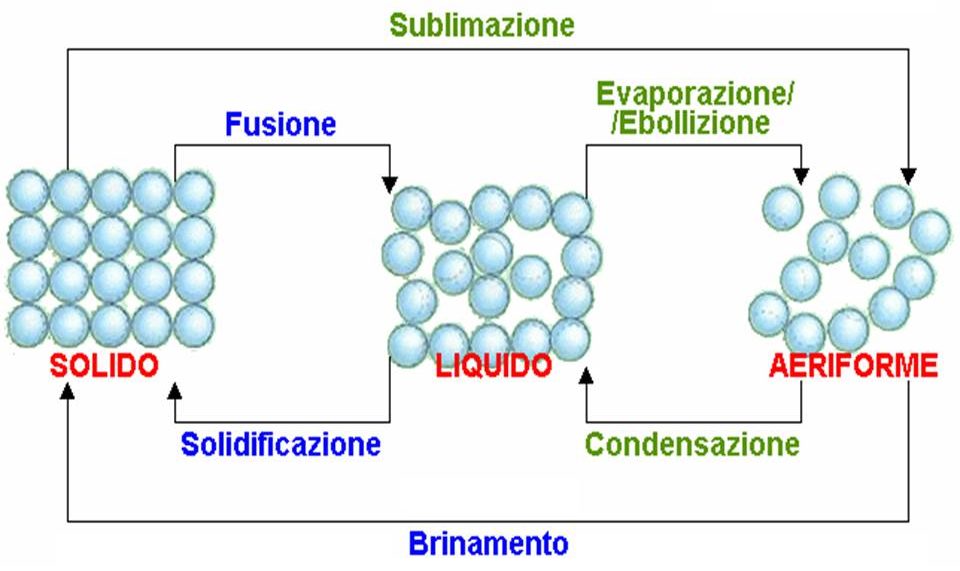
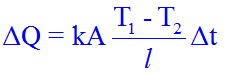Facendo variare la temperatura o la pressione, la materia può passare da uno stato di aggregazione ad un altro, con un processo durante il quale le molecole modificano la loro distanza relativa.
Una sostanza può esistere in quattro diversi stati: solido, liquido, gassoso e plasma.
E’ possibile passare da uno stato ad un altro fornendo o sottraendo calore alla sostanza.
I passaggi di stato che assorbono energia sono: la fusione (da solido a liquido), l’evaporazione o ebollizione (da liquido a vapore) e la sublimazione (da solido a vapore).
I passaggi di stato che cedono energia sono: la solidificazione (da liquido a solido), la condensazione (da vapore a liquido), il brinamento (da vapore a solido).
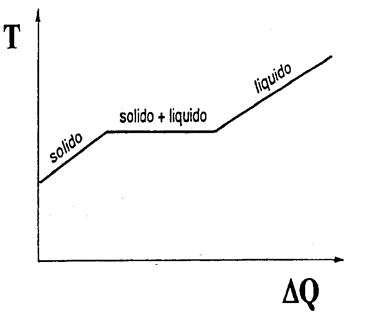
Durante il processo di fusione e di ebollizione le temperature restano costanti finché non si completa il passaggio di stato. Durante un cambiamento di fase, la quantità di calore trasferita per unità di massa si chiama calore latente λ. ΔQ = m⋅λ
Il calore latente varia da sostanza a sostanza e dal tipo di passaggio di stato.
Quando un solido raggiunge una temperatura sufficientemente elevata, l’agitazione termica delle molecole tende ad alterare la struttura cristallina. Una piccola variazione della distanza intermolecolare origina un grande indebolimento delle forze di legame e quindi si ha il passaggio dallo stato solido allo stato liquido (fusione).
Quando invece si riduce la temperatura di un liquido, il moto delle molecole diviene sempre più limitato. Alla temperatura di solidificazione, il movimento delle molecole si riduce ad una vibrazione periodica intorno a punti di equilibrio regolarmente disposti con formazione di un reticolo cristallino per cui si ha il passaggio allo stato solido (solidificazione).
Ad una determinata pressione, ogni sostanza cristallina presenta una caratteristica temperatura di fusione Tf, che coincide con la temperatura di solidificazione Ts. Sia durante la fusione che la solidificazione la temperatura resta costante e la sostanza è presente sia in fase liquida che solida.
La quantità di calore che occorre fornire a pressione costante alla massa unitaria di un solido portato alla temperatura di fusione per ottenere il suo passaggio completo allo stato liquido si chiama calore latente di fusione, mentre la quantità di calore che un liquido deve cedere per ottenere il passaggio completo allo stato solido è chiamato calore latente di solidificazione. Nel caso dell’acqua λf = 80 cal/gr.
In generale aumentando la pressione di una sostanza aumenta la sua temperatura di fusione, fatta eccezione per la temperatura di fusione del ghiaccio che diminuisce se si aumenta la pressione (questo spiega il movimento dei ghiacciai).
Caricamento….
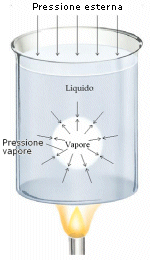
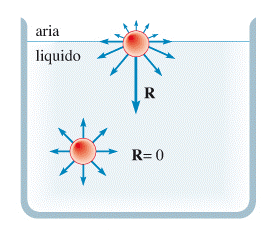
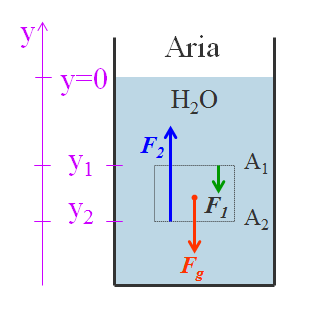
Il passaggio dallo stato liquido a quello aeriforme (evaporazione). Le molecole che sono vicine alla superficie del liquido e hanno velocità sufficientemente elevata possono sfuggire dal liquido e passare alla fase gassosa generando una pressione sul liquido chiamata tensione di vapore.
L’evaporazione avviene a qualsiasi temperatura, ma diventa più probabile se la temperatura aumenta perché aumentano i movimenti delle molecole.
L’evaporazione causa un raffreddamento del liquido in quanto perde le molecole che hanno maggiore energia cinetica, per questo motivo il nostro corpo utilizza il sudore come sistema di raffreddamento.
Allo stesso modo, le molecole evaporate da un liquido e vicine alla superficie del liquido, possono essere catturate con il fenomeno della condensazione.
Se il contenitore del liquido è chiuso, si raggiunge una situazione di equilibrio in cui il numero di molecole che tornano nel liquido è pari al numero di quelle che lo lasciano nello stesso intervallo di tempo. In queste condizioni, la pressione del vapore è detta tensione di vapor saturo ed aumenta con la temperatura, ma non dipende dalla presenza dell’aria. La tensione di vapore saturo è la pressione delle molecole che agiscono sul liquido.
Se il contenitore del liquido è aperto, il liquido può evaporare completamente prima che sia raggiunto l’equilibrio con il vapore.
L’ebollizione, invece, non è altro che un evaporazione tumultuosa che si manifesta in tutta la massa del liquido ad una determinata temperatura. Se la temperatura di un liquido diventa sufficientemente elevata si ha la formazione di bollicine di vapore. Se la tensione di vapore delle bolle è minore della pressione esterna, le bolle si frantumano. Quando si aumenta la temperatura del liquido, la tensione di vapor saturo all’interno delle bolle diventa uguale o maggiore della pressione esterna dell’aria e le bolle iniziano a salire in superficie dove si rompono per liberare vapore. Un liquido bolle per quel particolare valore di temperatura per cui la tensione del proprio vapor saturo eguaglia la pressione esterna. Abbassando la pressione esterna, diminuisce la temperatura di ebollizione, per questo motivo in montagna l’acqua bolle ad una temperatura più bassa.
Come accadeva per la fusione e la solidificazione, anche durante l’ebollizione la temperatura rimane costante finché tutto il liquido non si trasforma in vapore.
L’evaporazione diretta di un solido, senza passare dalla fase liquida, dovuta al passaggio alla fase vapore delle molecole più energetiche sulla superficie limite del solido è chiamata sublimazione.
Questo passaggio di stato è favorito dalle basse pressioni e dalle alte temperature.
Le sostanze che sublimano facilmente a temperature e pressioni ordinarie sono: la naftalina, lo iodio, la canfora e il ghiaccio secco (CO2 solida).
Il passaggio diretto dallo stato di vapore a quello solido, senza passare dalla fase liquida, è chiamato invece brinamento.
Questo passaggio di stato è favorito da un abbassamento brusco di temperatura. Un esempio è la formazione di brina nelle fredde giornate invernali in seguito alla solidificazione del vapore acqueo presente nell’aria.
La trasmissione del calore
La trasmissione di calore si ha quando si trasferisce energia da un sistema ad un altro. Essa può avvenire in tre modi: conduzione, convezione e irraggiamento.
La conduzione è il primo meccanismo di trasmissione di energia dovuto alle collisioni molecolari, senza che vi sia spostamento di materia o alterazione macroscopica dei mezzi.
La quantità di calore ΔQ che si propaga nel tempo Δt attraverso un oggetto di sezione trasversale A avente le estremità a distanza l e mantenute alle temperature T1 e T2 è uguale, secondo la relazione di Fourier a:
dove k è la conducibilità termica e dipende dal materiale. La sua unità di misura è J/(s⋅m⋅K). Quando la k è molto grande vuol dire che il materiale è un buon conduttore (in genere i metalli sono buoni conduttori), quando la k è piccola il materiale è isolante.
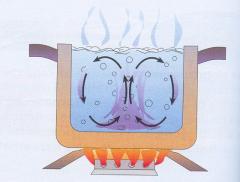
La convezione è un altro meccanismo di trasmissione dell’energia mediante il movimento di molecole da una regione ad un’altra ed è presente nei fluidi. Per avere dei moti convettivi, la sorgente di calore deve essere situata in basso. Prendiamo l’esempio della pentola: se il liquido è riscaldato dalla parte superiore non si ha convezione ma si riscalda solo per conduzione in un processo molto più lento.
Oltre alla pentola riscaldata dal fondo, altri esempi di trasmissione del calore per convezione sono il riscaldamento dei termosifoni, le correnti oceaniche e le brezze marine.
L’ultimo meccanismo di trasmissione del calore è l’irraggiamento che sfrutta le onde elettromagnetiche. Questo meccanismo, a differenza degli altir, non ha bisogno di materia per il trasporto dell’energia. Un esempio di irraggiamento è quello dell’energia trasmessa dal Sole alla Terra.
La quantità di energia Q emessa per irraggiamento nel tempo Δt da un oggetto avente area A e temperatura assoluta T è, secondo la legge di Stefan-Boltzmann:
Q = e⋅σ⋅A⋅T4⋅Δt
dove σ è la costante di Stefan-Boltzmann ed è uguale a 5,67⋅10-8 W/(m2⋅K4), mentre e è l’emissività che dipende dalla natura del corpo ed ha un valore compreso tra 0 e 1. Le superfici nere si avvicinano ad un’emissività di 1, mentre le superfici lucide hanno un’emissività prossima allo 0.
Qualsiasi oggetto emette energia per irraggiamento e assorbe quella irraggiata dagli altri corpi. Un oggetto a temperatura T1, circondato da un ambiente a temperatura T2, emette calore radiante ΔQ nel tempo Δt:
ΔQ = e⋅σ⋅A⋅(T14-T24)⋅Δt
Se la T1 è maggiore della T2 il calore radiante fluisce dal corpo all’ambiente, mentre il corpo si raffredda. Se la T1 è minore della T2 il calore radiante fluisce dall’ambiente al corpo, mentre il corpo si riscalda.
Fonte: Fisica biomedica.