
La cromatografia, è una tecnica di tipo separativo che si basa sull’utilizzazione di colonne e si sfrutta come principio di separazione la forza di gravità, che richiede un certo tempo abbastanza lungo. Per aumentare la velocità di discesa del campione la colonna può essere collegata ad una pompa peristaltica che applica una certa pressione e quindi aumenta di una certa velocità il deflusso dell’analita.
Ogni sistema cromatografico è costituito da una fase stazionaria (fase fissa) e una fase mobile (eluente). La fase stazionaria è il materiale con cui è riempita la nostra colonna e, a seconda del tipo di cromatografia, presenta diverse tipologie che stabiliscono il principio che viene utilizzato per separare quella determinata proteina dalle altre. Ci sono diversi tipi di cromatografia e un diverso grado di risoluzione per le diverse tecniche cromatografiche. La fase mobile è la soluzione in cui si trova disciolto il nostro analita che dobbiamo determinare.
Il principio di separazione delle proteine può essere la massa oppure la carica elettrica, dipende dal tipo di materiale con cui è costituita la fase stazionaria.
Caricamento…
Cromatografia a scambio ionico
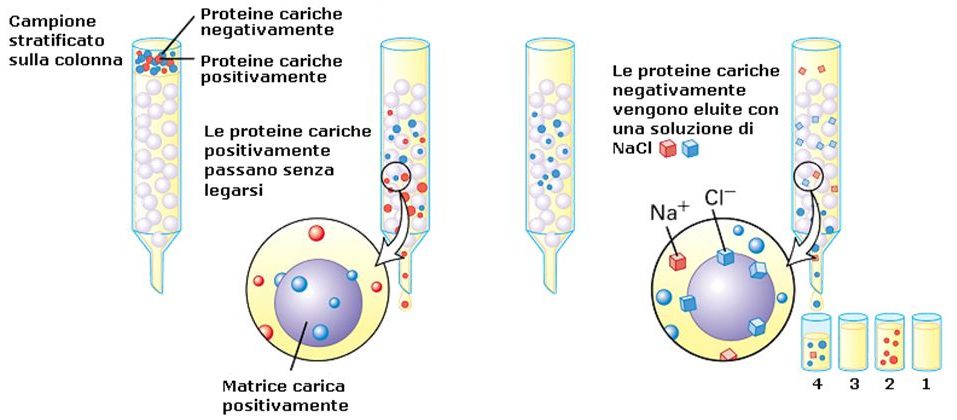
Un esempio classico di cromatografia utilizzata in molti laboratori è la cromatografia a scambio ionico in cui la fase stazionaria è costituita da una resina che può essere policationica o polianionica, formata da delle biglie con cariche negative oppure positive a seconda di quello che vogliamo andare a separare. Se per esempio noi vogliamo separare una proteina basica dalle altre (basica vuol dire che a pH fisiologico presenta una o più cariche nette di tipo positivo) prepareremo la nostra provetta con uno scambiatore anionico con delle cariche negative in maniera tale che la nostra proteina carica positivamente si lega mentre tutte le altre fuoriescono, ossia faremo una sorta di filtrazione, quindi le proteine che sono acide, cariche negativamente, si respingono con le biglie di resina e fuoriescono, mentre invece la nostra proteina basica rimarrà legata. Per poter recuperare la nostra proteina, cambiamo le condizioni di pH, di forza ionica all’interno della resina e otteniamo in un secondo passaggio la nostra proteina purificata. Questo è il principio generale su cui si basa la cromatografia a scambio ionico (che può essere cationico oppure anionico).
Cromatografia per esclusione molecolare (filtrazione su gel)
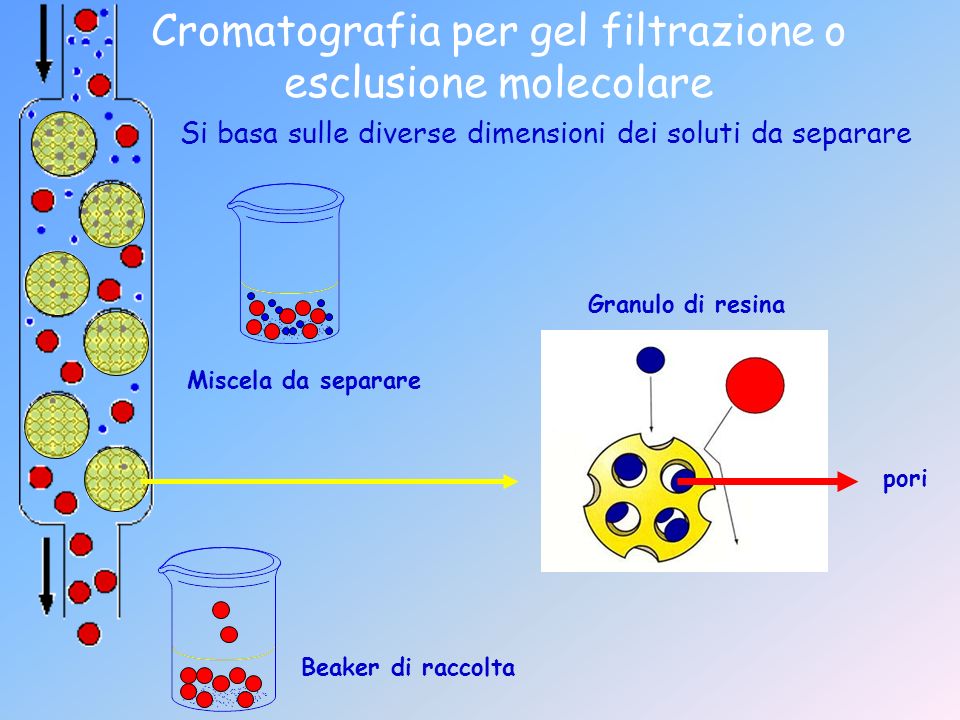
Un altro tipo di cromatografia molto utilizzata è la cromatografia per esclusione molecolare, anche chiamata cromatografia per filtrazione su gel. Ciò che sta nella colonna è formato da una resina costituita da biglie, che non si vedono a occhio nudo, che costituiscono la fase stazionaria. Esse sono forate e permettono il passaggio di molecole. Sono disponibili commercialmente delle resine con determinati cut-off. Più grande è la proteina, prima esce, perché le molecole più piccole del cut-off sono quelle che avranno un percorso arzigogolato all’interno delle singole palline che entrano e poi escono, mentre tutto ciò che è al di sopra del valore di cut-off, non può andare all’interno di questi fori e quindi fuoriesce prima. Questa è generalmente l’applicazione che viene utilizzata. Ovviamente il sistema cromatografico è collegato a un sistema collettore che servirà per raccogliere l’analita da separare.
Cromatografia per affinità
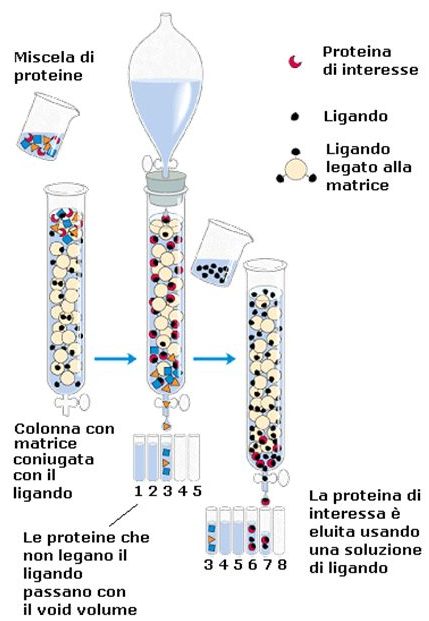
Un terzo tipo di cromatografia è quella per affinità. Questo tipo di cromatografia offre un grado di risoluzione maggiore perché utilizza un legame specifico del ligando, della proteina, con un antigene specifico legato sulla resina. Viene utilizzato un particolare epitopo della nostra proteina, cioè una particolare regione della proteina. Viene costruito un ligando e montato sulla resina in maniera tale che sia altamente specifico per la proteina di interesse, quindi viene applicato il nostro campione su un sistema cromatografico che contiene un certo numero di proteine, però il ligando che è presente nella resina è specifico soltanto per la nostra proteina, quindi solo la nostra proteina si andrà a legare con questo ligando che si trova nella resina e poi alla fine per poter recuperare la nostra proteina di interesse possiamo aggiungere una soluzione molto concentrata di una specie chimica che compete con lo stesso ligando, però in maniera più specifica tanto che spiazza la proteina e si va a legare al ligando, in modo tale da recuperare la proteina, oppure possiamo variare notevolmente la concentrazione ionica, aumentare notevolmente la forza ionica determinando una rottura del legame tra la resina della nostra proteina in maniera tale da poterla recuperare.
Now loading…





