Per poter capire l’esistenza della forza di coesione in un liquido bisogna considerare uno strato di acqua compresso fra due lamine di vetro. Per separare le due lamine bisogna bisogna esercitare una enorme forza. Ciò è dovuto alle forze di attrazione intermolecolare esistenti nei liquidi, dette forze di coesione. È a causa di queste forze di coesione che i liquidi hanno delle superfici libere ben definite che, come delle membrane tese, tendono ad occupare una superficie minima, come accade per esempio ad una goccia d’acqua che assume la forma sferica quando cade.
Oltre alle forze di coesione, le molecole di un liquido sono sottoposte ad interazioni attrattive o repulsive con le molecole di altre sostanze con cui i liquidi sono in contatto e sono dette forze di adesione.
Tensione superficiale
Cerchiamo di capire perché le forze di coesione in un liquido si manifestano come forze agenti sulla superficie del liquido stesso.
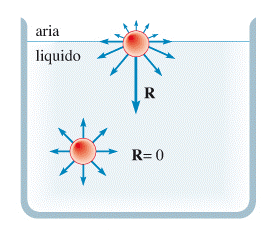
Si consideri una molecola all’interno di un liquido. Essa è sottoposta a forze di coesione aventi risultante R=0.
Invece, le molecole che si trovano nei pressi della superficie sono sottoposte a forze di coesione che hanno una risultante R≠0 diretta verso l’interno del liquido.
Quindi, per aumentare la superficie libera di un liquido occorre compiere lavoro per portare delle molecole dall’interno verso la superficie del liquido, contrastando la forza di coesione. Ciò spiega la tendenza dei liquidi a minimizzare la superficie libera, allo scopo di raggiungere uno stato di equilibrio stabile, raggiunto quando la sua energia potenziale è minima.
La superficie di un liquido si comporta come una membrana tesa, nel senso che al suo interno agiscono forze che tendono a contrarla. Queste forze F sono tangenziali alla superficie del liquido ed agiscono perpendicolarmente al contorno.
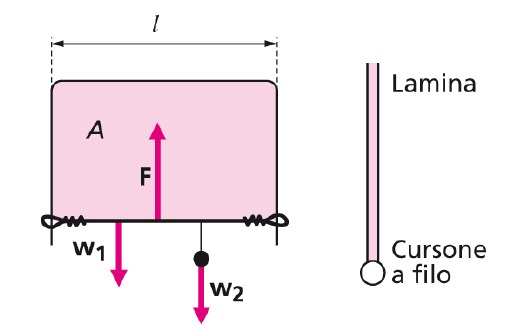
Infatti, considerando un telaio di filo metallico a forma di U (con un lato scorrevole di peso w1 a cui è appeso un oggetto di peso w2) che racchiude un film di liquido la cui superficie cresce mentre il lato mobile scorre verso il basso, ad un certo punto si ha equilibrio fra la forza peso w = w1 + w2 e forza di coesione F (tensione superficiale) del film verso l’alto, quindi:
F = w1+w2
Sperimentalmente si osserva che a parità di lato l, il peso w, e quindi forza F, è indipendente dalla superficie del film di liquido nel telaio, perché il numero di molecole aderenti al lato mobile è lo stesso. Se invece si raddoppia il lato l, è necessario raddoppiare w per mantenere l’equilibrio.
Quindi si definisce tenzione superficiale γ la forza per unità di lunghezza del contorno di una superficie, che agisce lungo il bordo di una lamina liquida:
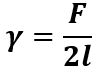
Dove F è detta forza di tensione superficiale.
Nella definizione di γ c’è 2l perché si tratta di una lamina che ha 2 superfici libere mentre nel caso di 1 sola superficie libera figura solo l (come per la superficie sferica di una goccia d’acqua).
L’unità di misura della tensione superficiale γ è N/m (Sistema Internazionale) e dyne/cm (Gauss).
Fisicamente, la tensione superficiale esprime la tendenza dei liquidi a rendere minima la loro energia potenziale, tramite la diminuzione dell’area superficiale. Infatti, per una lamina di liquido di superficie S, l’Energia Potenziale Superficiale U è: U = -γS
In realtà, il film di liquido non si comporta come una vera membrana tesa. L’equilibrio delle forze raggiunto dal telaio col lato mobile si mantiene per qualsiasi posizione del lato mobile, indipendentemente dall’area della superficie S.
Quindi, la superficie di un liquido si comporta in modo diverso dalla membrana di un solido elastico, la cui tensione cresce con l’aumento di superficie.
Inoltre, lo spessore della lamina non è presente nell’espressione di γ. Ciò è dovuto al fatto che quando il film si estende le molecole dall’interno del liquido risalgono alla superficie e l’area della superficie aumenta. Poiché la forza resta costante al variare dello spessore del film, si intuisce che essa è attribuita alla superficie della lamina liquida e non al suo spessore.
Caricamento….
Dipendenza della tensione superficiale dalla temperatura
La tensione superficiale γ dipende dalla temperatura T, in quanto aumentando la T si ha una maggiore agitazione termica che tende a ridurre gli effetti delle forze di coesione fra le molecole:
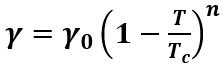
dove γ0 è la tensione superficiale a 0o C e TC è la temperatura critica del liquido, cioè quella temperatura a cui si ha la transizione da liquido a gas, ovvero la temperatura di ebollizione. In generale n ≈ 1.2.
Questa dipendenza della tensione superficiale dalla temperatura spiega perché l’acqua calda lava meglio di quella fredda.
Forze di adesione superficiale
Se un liquido è a contatto con un gas, un altro liquido o un solido, oltre alle forze di coesione fra le molecole dello stesso liquido, esistono anche delle forze di attrazione fra le molecole del liquido e quelle delle sostanze con cui il liquido è a contatto. Tali forze sono dette: forze di adesione superficiali, chiamate anche forze di adesione di Wan der Waals.
Sono forze deboli di natura dipolo elettrico che uniscono le molecole di un liquido a quelle di alcuni solidi o altri liquidi. La loro natura è determinata dalla distribuzione di cariche elettriche in atomi e molecole neutre.
La carica positiva (nuclei) e quella negativa (elettroni) di una molecola tendono ad alterare la distribuzione delle cariche elettriche delle molecole vicine, creando dei dipoli elettrici (indotti). Polarità opposte dei dipoli tendono ad unirsi generando un legame di Van der Waals (legami di dipolo fluttuanti).
Quindi, la tensione superficiale γ di un liquido dipende sia dalle forze di coesione che dalle forze di adesione all’interfaccia di due mezzi.
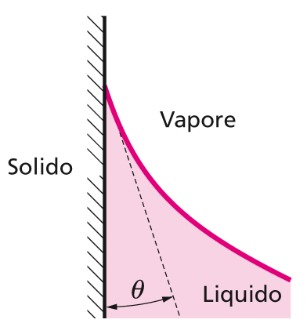 Angolo di contatto
Angolo di contatto
La superficie libera di un liquido risulta incurvata (forma un menisco) in contatto con una superficie solida e forma un angolo θ detto angolo di contatto.
L’angolo di contatto θ è il risultato della competizione fra le forze molecolari di coesione liquido-liquido e quelle di adesione liquido-solido e dipende dalla natura del solido e del liquido, nonché da temperatura T e dallo stato di pulizia e levigatezza della superficie solida.
- Se θ < π/2, il menisco è concavo verso l’alto (acqua-vetro) ed il liquido bagna la superficie solida.
- Se θ > π/2, il menisco è convesso verso l’alto (Hg-vetro) ed il liquido non bagna la superficie solida.
- Se θ = π/2, la superficie è orizzontale e le forze di coesione sono pari a quelle di adesione.
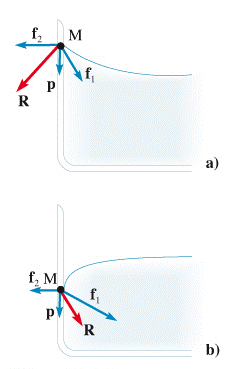
Per capire, perché si forma un menisco, si consideri una molecola M di liquido in contatto con la parete. Su M agisce la forza peso p, la forza di coesione f1 tangente alla superficie e diretta verso l’interno del liquido e la forza di adesione f2 diretta perpendicolarmente alla parete del recipiente.
Come si ha per le superfici orizzontali e per ragioni di equilibrio, in prossimità della parete la superficie curva deve essere perpendicolare alla risultante R delle forze applicate alla molecola M. Se le forze di adesione prevalgono su quelle di coesione, la curvatura del menisco è concava (acqua-vetro). Se le forze di coesione prevalgono su quelle di adesione, la curvatura del menisco è convessa (Hg-vetro).
Applicazioni della Tensione Superficiale
Le proprietà detergenti di un liquido dipendono molto dalla tensione superficiale γ del liquido stesso. Liquidi con bassi valori di γ tendono a distribuirsi sulla superficie da lavare, cioè “bagnano” meglio la superficie. L’aggiunta di un sapone o detersivo in acqua serve ad abbassare il valore di γ dell’acqua e quindi l’acqua aderisce meglio alla superficie, diluendo meglio le particelle di sporco da dissolvere.
Anche l’efficacia antisettica dei disinfettanti è correlata alla loro tensione superficiale. A parità di altre proprietà, un disinfettante è tanto più efficace, quanto più è bassa la sua γ.
Fonte: Fisica biomedica.