Fonte: Fisica biomedica.
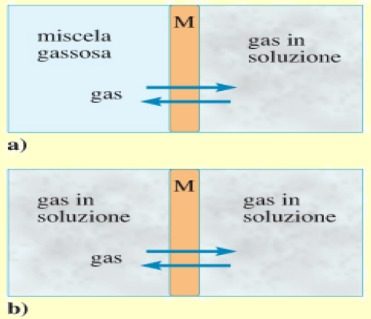
Negli organismi viventi e in particolare nel corpo umano, le miscele di gas diffondono in soluzione tramite membrane composte essenzialmente da liquidi.
Un esempio di membrana che permette la diffusione gas-liquido, è la membrana alveolare dei polmoni; mentre, la membrana dei capillari permette la diffusione di gas tra soluzione e soluzione (ad esempio tra sangue e liquido interstiziale).
Legge di Graham
Il coefficiente di diffusione di un gas attraverso una membrana (DM) dipende in modo specifico dal tipo di gas e dalla sua massa molecolare M:
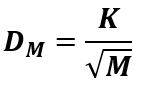
Dove K è una costante che dipende dal tipo di membrana e dalla temperatura assoluta T. Dalla legge di Graham si deduce che una membrana può agire in modo selettivo tra i diversi tipi di gas.
Legge di Henry
Per la diffusione dei gas vale anche la legge di Henry, secondo cui ad una certa temperatura T, la solubilità di un gas i-esimo in un liquido è proporzionale alla pressione parziale pi che il gas esercita sul liquido:
Vi= Si⋅pi
Dove Vi è il volume in cm3 di gas in condizioni Standard di pressione e temperatura (NPT→ 273 K e 1 atm.) che si scioglie in 100 cm3 di liquido e pi è espressa in atm. Il coefficiente Si è detto coefficiente di solubilità e dipende dalla temperatura, dal tipo di gas e dal tipo di liquido.
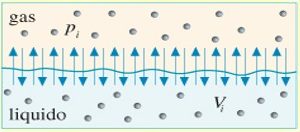
La legge di Henry si spiega osservando che in condizioni di equilibrio il numero di molecole di gas che escono dal liquido deve essere uguale al numero di molecole di gas che vi entrano a causa del moto di agitazione termica. Ma il numero di molecole che vi entrano è proporzionale al numero di molecole presenti nel gas e quindi alla pi, dove:
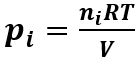
Fonte: Fisica biomedica.
Analogamente, il numero di molecole di gas uscenti dal liquido è proporzionale al numero di molecole presenti in esso, cioè al Vi.
Come si può vedere nella figura accanto, tra gas sciolti nel liquido e gas esterni al liquido si genera un equilibrio dinamico, di cui è espressione la legge di Henry.
Si ricordi che per poter applicare l’equazione dei gas perfetti a un gas reale, è necessario che si comporti come un gas perfetto e quindi si trovi ad una T>TC dove TC è la temperatura critica al di sopra della quale il gas non può passare in fase liquida, qualunque sia la pressione.
Per i gas biologici ciò è vero per l’O2 e N2 e al limite anche per la CO2 (T= 37 °C è di poco superiore alla TC della CO2 la cui TC = 31 °C). Ciò non si verifica per il vapor d’H2O la cui TC = 374 °C. Infatti, a T=RT il vapor d’H2O può condensare.
Fonte: Fisica biomedica.
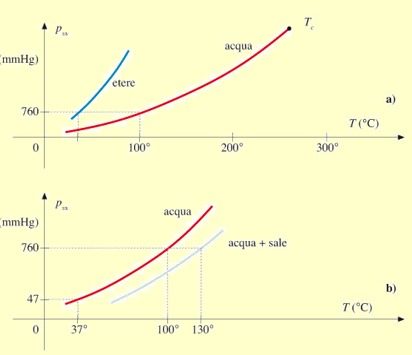
Il processo di condensazione avviene quando la densità delle molecole di vapore è tale per cui queste iniziano a mostrare effetti di forza coesiva e quindi condensano. Il vapore in queste condizioni si dice saturo e la sua pressione parziale pi è detta «Pressione di vapore saturo» oppure «Tensione di vapore saturo» pvs. La tensione di vapore saturo pvs cresce con la T fino alla TC.
Per T>TC, il moto di agitazione termica è tale da vincere le forze di coesione, qualunque sia la pi del gas e la fase liquida non può più esistere.
N.B.: Quando la pi (tensione di vapore) diventa superiore alla p ambiente (760 mmHg) la T del liquido diventa tale che anche le molecole non superficiali tendono a passare dalla fase liquida alla fase gassosa e si ha l’ebollizione.
Nell’aria contenuta negli alveoli polmonari, a 37 °C la pi parziale del vapore d’H2O è pari alla pressione di vapore saturo pvs (47 mm Hg). Ciò perché la fase gassosa dell’H2O coesiste in equilibrio con la sua fase liquida, costituita da un film di liquido che ricopre l’interno della membrana alveolare.
Legge di Raoult
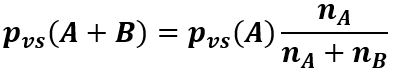
Se nel liquido è disciolto un soluto, la pvs del liquido puro (il solvente) si riduce in proporzione alla frazione molare del solvente. Infatti, se con A e B si indicano rispettivamente il solvente ed il soluto, con nA e nB il loro numero di moli:
dove pvs (A+B) è la tensione di vapore della soluzione e pvs (A) è quella del solvente puro. L’abbassamento della tensione di vapore è dovuto al fatto che le molecole di soluto esercitano delle forze di coesione sulle molecole del solvente, per cui la quantità di vapore in equilibrio con il liquido viene ridotta rispetto al caso del solvente puro.
Fonte: Fisica biomedica.
Caricamento…