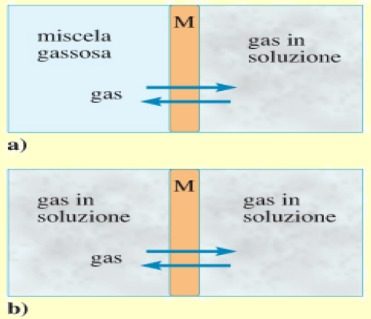
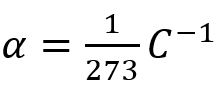Il fenomeno dell’osmosi è un meccanismo di trasporto passivo attraverso membrane impermeabili o parzialmente impermeabili (membrane semipermeabili) al soluto.
Considerando una membrana che separa 2 comparti, di cui uno con il solvente puro e l’altro con una soluzione, se i pori della membrana hanno dimensioni tali da lasciar passare solo le molecole di solvente, il soluto non potrà diffondere da 2 →1 ed il flusso di soluto (JsM) attraverso la membrana Semipermeabile è: JsM = 0
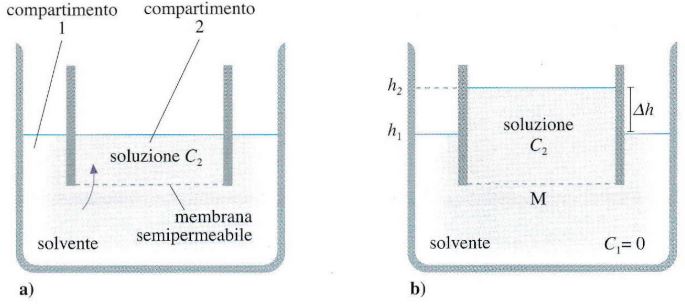
All’inizio il livello del liquido nei 2 comparti è lo stesso e sulla membrana non agisce alcun gradiente di pressione idrostatica.
Ciononostante, dopo un po’ si osserva che il livello della soluzione si alza fino a raggiungere un’altezza di equilibrio. Lo stesso effetto si osserva se la concentrazione di soluto nel comparto 2 è maggiore della concentrazione di soluto nel comparto 1.
Il fenomeno è dovuto al passaggio di solvente da 1 → 2, a causa di un’azione di richiamo della soluzione dovuto alla differenza di concentrazione tra i 2 lati sulla membrana: fenomeno dell’osmosi.
Il fenomeno dell’Osmosi si può spiegare in termini fisici, con le forze che agiscono sulle molecole di soluto e di solvente.
All’inizio, le pressioni idrostatiche p1 e p2 ai lati della membrana sono uguali: p1 ═ p2
Poiché le molecole di soluto in 2 non riescono ad attraversare i pori di membrana (essendo di dimensioni maggiori dei pori), esse sono respinte dai bordi dei pori.
Quindi, nell’urto le molecole di soluto subiscono una variazione di quantità di moto (rimbalzano contro la membrana) e quindi nasce una forza che le allontana dalla membrana. Questa forza tende a farle muovere in senso opposto al gradiente di concentrazione.
Quindi, in prossimità dei pori questa forza repulsiva verso l’alto origina nel comparto 2 una diminuzione di pressione rispetto alla pressione idrostatica p2 presente nel comparto 2. Allora, il solvente nel poro è soggetto ad una Δp = p1 − p2* (con p2* < p2) che spinge le molecole di solvente da 1 → 2.
Questo flusso di solvente si evidenzia tramite una «Pressione Efficace», che alla fine del processo causa un aumento di livello della soluzione da h1 → h2 fino a raggiungere un equilibrio idrostatico determinato dal dislivello Δh.
Questa pressione di richiamo del solvente (Δp), che migra da concentrazioni [C] di soluto minori a concentrazioni di soluto maggiori è detta «PRESSIONE OSMOTICA» (π).
La pressione idrostatica tra h1 e h2 dovuta all’osmosi, permette di misurare la pressione osmotica π della soluzione 2. La pressione osmotica π del comparto 1 (solvente) è zero. All’equilibrio per la legge di Stevino:
π = ρ g Δh = ρ g (h2− h1)
dove ρ è la densità della soluzione.
Now loading…
Leggi della pressione osmotica
La pressione osmotica (π) dipende dalle caratteristiche della soluzione.
Il fenomeno dell’osmosi procede nel senso di uniformare le concentrazioni, simile a quello che si ha nella diffusione di molecole di soluto attraverso membrane permeabili, secondo la 1a legge di Fick.
Infatti, il flusso di solvente dovuto a π, tende a diluire la concentrazione C nel comparto 2.
1a legge di Van’t Hoff: per soluzioni diluite e a temperatura costante si ha:
π = K C
dove C è la concentrazione della soluzione e K è una costante che dipende dalla temperatura T e dalla natura della soluzione.
2a legge di Van’t Hoff: a concentrazione costante si osserva che π cresce linearmente con T:
π(T)=π0(1+αΔT) con
dove π0 è la pressione osmotica a T = 0 °C.
3a legge di Van’t Hoff (detta anche di Avogadro): a temperatura costante, soluzioni contenenti lo stesso numero di molecole di soluto nello stesso volume di solvente hanno uguali pressioni osmotiche.
Queste 3 leggi di Van’t Hoff sono valide solo per soluzioni diluite, in modo da trascurare le interazioni tra le molecole di soluto.
Unità di misura della pressione osmotica
In aggiunta alle unità di misura della pressione nel sistema S.I. e nel sistema di Gauss, si usa anche l’osmole che è la pressione osmotica esercitata da una soluzione contenente 1 mole di soluto non elettrolita (δ = 1) disciolta in 1 litro di H2O a T = 0 °C.
Si noti che 1 osmole equivale ad una pressione osmotica π = 22.4 atm.
Un’altra unità di misura della pressione osmotica è la Molarità NaCl: cioè la pressione osmotica prodotta da 1 mole di NaCl (δ = 2) in 1 litro di H2O a T = 0 °C.
Quindi 1 molarità NaCl equivale ad una π di 2 osmoli.
Fonte: Fisica biomedica.