Il mitocondrio è un organello cellulare di fondamentale importanza, la cui funzione trascende la nota definizione di “centrale energetica“. Sebbene la sua attività principale sia la produzione di ATP attraverso la respirazione cellulare, il mitocondrio agisce come un hub metabolico e regolatorio integrato, orchestrando processi vitali che vanno dalla biosintesi molecolare alla determinazione del destino cellulare. La sua complessa architettura e il suo genoma unico sono intrinsecamente legati a questa multifunzionalità.
L’anatomia del mitocondrio è finemente organizzata per supportare le sue diverse attività biochimiche. È possibile distinguere quattro compartimenti strutturali principali:
- membrana esterna: caratterizzata da un’elevata permeabilità, consente il passaggio di molecole con una massa molecolare fino a 5000 Dalton, facilitando lo scambio di metaboliti tra il mitocondrio e il citosol;
- spazio intermembrana: è la regione localizzata tra la membrana esterna e quella interna;
- membrana interna: a differenza di quella esterna, è altamente selettiva e si ripiega in numerose introflessioni, definite creste, che ne aumentano notevolmente la superficie. La sua composizione è unica: presenta un elevato contenuto proteico, è priva di colesterolo e contiene cardiolipine, un fosfolipide tipico anche delle membrane batteriche. Questa membrana ospita componenti essenziali come i complessi della catena respiratoria, i traslocatori di metaboliti e l’enzima ATP sintetasi;
- matrice mitocondriale: è lo spazio racchiuso dalla membrana interna e ha una consistenza gelatinosa dovuta a un’altissima concentrazione di proteine idrosolubili (circa 500 mg/ml). Al suo interno si trovano numerosi enzimi metabolici, ribosomi di tipo 70S (simili a quelli procariotici) e il DNA mitocondriale.
Genoma Mitocondriale (mtDNA)
Le caratteristiche uniche del DNA mitocondriale (mtDNA) forniscono preziose informazioni sull’origine e la funzione dell’organello.
La presenza di un DNA simile a quello procariotico e di ribosomi 70S avvalora l’ipotesi endosimbiotica, secondo cui i mitocondri deriverebbero da antichi procarioti fagocitati da una cellula eucariotica ancestrale. Il mtDNA viene trasmesso quasi esclusivamente per via materna, poiché i mitocondri presenti nello zigote derivano dalla cellula uovo.
Il genoma mitocondriale umano è una molecola di DNA circolare a doppio filamento che contiene 37 geni. La loro funzione è altamente specializzata:
- 13 geni codificano per subunità proteiche dei complessi della catena di trasporto degli elettroni;
- 24 geni codificano per molecole di RNA (tRNA e rRNA) indispensabili per la sintesi proteica all’interno del mitocondrio. Va notato che la maggior parte delle proteine mitocondriali è codificata dal DNA nucleare, sintetizzata nel citosol e successivamente importata nell’organello, sottolineando la stretta interdipendenza e co-evoluzione tra l’organello e il nucleo della cellula ospite.
Il mtDNA è particolarmente suscettibile al danno. La sua prossimità alla catena di trasporto degli elettroni, una fonte primaria di radicali liberi, combinata con l’assenza di proteine protettive come gli istoni e sistemi di riparazione del DNA meno efficienti, lo rende estremamente vulnerabile. Di conseguenza, il suo tasso di mutazione è stimato essere circa dieci volte maggiore rispetto a quello del DNA nucleare.
La complessa struttura e il genoma semi-autonomo del mitocondrio sono la base delle sue molteplici e vitali funzioni cellulari, che verranno ora esaminate in dettaglio.
Funzioni metaboliche centrali
Il mitocondrio rappresenta un crocevia strategico del metabolismo cellulare. I processi che si svolgono al suo interno non solo forniscono l’energia necessaria per la vita, ma producono anche intermedi essenziali per numerose altre vie biosintetiche, rendendolo un organello indispensabile per l’omeostasi cellulare.
Produzione di energia
Now loading…
Il ruolo primario del mitocondrio è la respirazione cellulare, il processo che converte l’energia chimica dei nutrienti in ATP. Le fasi finali di questo processo si svolgono interamente all’interno dell’organello e includono:
- ciclo di Krebs (o ciclo dell’acido citrico): avviene nella matrice mitocondriale e completa l’ossidazione dei substrati energetici;
- fosforilazione ossidativa: si svolge sulla membrana mitocondriale interna e utilizza gli elettroni trasportati dalla catena respiratoria per generare la stragrande maggioranza dell’ATP cellulare;
- beta-ossidazione: il processo di degradazione degli acidi grassi, che avviene nella matrice, produce acetil-CoA da convogliare nel ciclo di Krebs;
- sintesi parziale dell’urea: alcune reazioni del ciclo dell’urea, fondamentali per l’eliminazione dell’azoto, avvengono nel mitocondrio.
Sintesi del colesterolo
Il mitocondrio contribuisce anche a vie anaboliche cruciali. La sintesi del colesterolo, ad esempio, inizia a partire dall’acetil-CoA prodotto a livello mitocondriale. Questo precursore viene poi esportato nel citoplasma, dove la via biosintetica prosegue fino alla formazione della molecola di colesterolo.
Questa incessante attività metabolica, pur essendo vitale, impone un costo biochimico: il flusso di elettroni, non essendo mai perfettamente efficiente, genera inevitabilmente specie reattive che mettono a repentaglio l’omeostasi redox cellulare.
Regolazione dello stato redox e difese antiossidanti
L’utilizzo dell’ossigeno come accettore finale di elettroni nella respirazione cellulare presenta un paradosso fondamentale: se da un lato è essenziale per la produzione efficiente di ATP, dall’altro è la fonte primaria delle specie reattive dell’ossigeno (ROS). Mantenere un delicato equilibrio redox è quindi una priorità critica per la sopravvivenza della cellula.
Formazione delle Specie Reattive dell’Ossigeno (ROS)
Durante il trasferimento di elettroni lungo la catena respiratoria, una piccola percentuale di ossigeno molecolare (O₂) subisce una riduzione parziale, generando una serie di intermedi altamente reattivi:
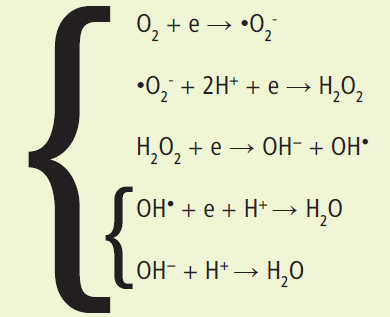
- la riduzione con un singolo elettrone forma l’anione superossido (•O₂⁻);
- l’aggiunta di un secondo elettrone e due protoni genera il perossido di idrogeno (H₂O₂);
- l’acquisizione di un terzo elettrone scinde il perossido, formando il radicale ossidrilico (•OH) e uno ione idrossido (OH⁻).
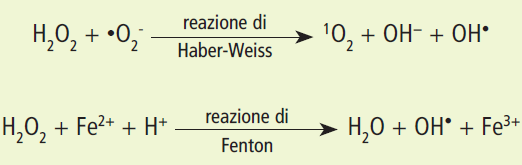
Il radicale ossidrilico, la specie più reattiva e dannosa, può essere generato anche attraverso reazioni specifiche che coinvolgono ioni metallici, come la reazione di Haber-Weiss (tra superossido e perossido di idrogeno) e la reazione di Fenton (tra perossido di idrogeno e ioni ferrosi Fe²⁺).
Danno cellulare da radicali liberi
L’elevata reattività dei radicali liberi causa danni diffusi alle principali macromolecole biologiche:
- lipidi di membrana: inducono una reazione a catena di perossidazione lipidica che compromette l’integrità delle membrane e può portare a morte cellulare;
- acidi nucleici: possono causare danni ossidativi alle basi azotate, portando a eventi mutageni;
- proteine: l’ossidazione di residui sensibili, come i gruppi tiolici della cisteina o l’apertura degli anelli di istidina e triptofano, ne altera la struttura e la funzione;
- carboidrati: i radicali possono sottrarre atomi di idrogeno, alterando la struttura dei glucidi.
Meccanismi di difesa antiossidante
Per contrastare i danni da ROS, le cellule hanno evoluto sofisticati sistemi di difesa endogeni, classificabili come enzimatici e chimici.
| Tipo di difesa | Esempi e meccanismo d’azione |
|---|---|
| Enzimatica | Superossido dismutasi (SOD): catalizza la conversione del radicale superossido in ossigeno e perossido di idrogeno (2 O₂⁻ + 2 H⁺ → O₂ + H₂O₂). Catalasi: neutralizza il perossido di idrogeno convertendolo in acqua e ossigeno (2 H₂O₂ → O₂ + 2 H₂O). Glutatione perossidasi: utilizza il glutatione per ridurre il perossido di idrogeno e altri perossidi. |
| Chimica | Glutatione (GSH): nella sua forma ridotta, agisce come un potente scavenger di radicali liberi, donando un elettrone per neutralizzarli (es. H₂O₂ + 2 GSH → GSSG + 2 H₂O). |
Superata però una certa soglia può essere necessario un apporto di antiossidanti con la dieta. I principali antiossidanti presenti negli alimenti sono:

- pigmenti vegetali, come polifenoli e bioflavonoidi;
- vitamine, in particolare la vitamina C, la vitamina E e i carotenoidi;
- micronutrienti e coenzimi, tra cui selenio, rame, zinco, glutatione e coenzima Q.
L’importanza fisiologica delle SOD è evidenziata da studi su modelli animali. Topi geneticamente privi dell’enzima mitocondriale SOD2 muoiono pochi giorni dopo la nascita a causa di un massiccio stress ossidativo, mentre quelli privi di SOD1 sviluppano gravi patologie, tra cui carcinomi e una senescenza accelerata.
La gestione dello stato redox rappresenta un meccanismo di difesa endogeno fondamentale; parallelamente, il mitocondrio impiega altri sofisticati sistemi enzimatici, come la famiglia del citocromo p-450, per neutralizzare composti esogeni e modulare vie biosintetiche cruciali.
Ruoli biosintetici e detossificanti specialistici
Le capacità enzimatiche del mitocondrio si estendono ben oltre il metabolismo energetico, includendo funzioni altamente specialistiche di biosintesi e di biotrasformazione di composti endogeni ed esogeni. Questa versatilità evidenzia ulteriormente il suo ruolo centrale nell’omeostasi cellulare.
Sistema del Citocromo p-450
Il sistema del citocromo p-450 è una vasta famiglia di flavoproteine monossigenasi, localizzate prevalentemente a livello microsomiale ma con importanti rappresentanti anche nel mitocondrio. Questi enzimi catalizzano reazioni di idrossilazione grazie alla presenza di un gruppo eme, che permette di inserire un atomo di ossigeno in un substrato. Le loro funzioni sono molteplici e vitali:
- ossidazione ed eliminazione di sostanze endogene (es. bilirubina) ed esogene (es. farmaci, inquinanti);
- partecipazione alla biosintesi del colesterolo.
- metabolismo della vitamina D.
Sintesi dell’Eme

L’eme è il gruppo prostetico non proteico di cromoproteine fondamentali come l’emoglobina. La sua struttura chimica è composta da una protoporfirina IX che coordina al suo centro uno ione ferroso (Fe²⁺). Questo ione è in grado di legare reversibilmente l’ossigeno. Quando lo ione ferroso viene ossidato a ione ferrico (Fe³⁺), l’eme si trasforma in emina (o ferriemo), forma presente nella metemoglobina che è incapace di legare ossigeno.
Il processo di sintesi dell’eme è complesso e si svolge in parte nel mitocondrio e in parte nel citoplasma. La via biosintetica parte dai precursori glicina e succinilcoenzima A (un intermedio del ciclo di Krebs) e la sua tappa iniziale, catalizzata dall’enzima ALA sintetasi, avviene proprio nella membrana interna mitocondriale. La regolazione di questa via è finemente controllata: l’eme stesso agisce da inibitore, sia reprimendo la sintesi dell’ALA sintetasi sia inibendola allostericamente. Anche la pressione parziale di ossigeno funge da regolatore, stimolandone la biosintesi in condizioni di ipossia.
L’emoglobina, la proteina responsabile del trasporto di ossigeno nel sangue, è una cromoproteina tetramerica (la forma adulta HbA è composta da 2 catene α e 2 catene β), in cui ogni subunità lega una molecola di eme. La sua funzione è un esempio paradigmatico di regolazione allosterica:
- l’ossigeno agisce sia da substrato che da effettore allosterico positivo. Il legame della prima molecola di O₂ a un sito dell’eme induce un cambiamento conformazionale che aumenta l’affinità degli altri siti di legame, facilitando il carico di ossigeno a livello polmonare;
- il 2,3-bisfosfoglicerato (2,3-BPG), una molecola presente nei globuli rossi, agisce come effettore allosterico negativo. Legandosi a una cavità specifica della deossiemoglobina, ne stabilizza la struttura a bassa affinità per l’ossigeno. Questo meccanismo è cruciale per favorire il rilascio efficiente di O₂ nei tessuti periferici.
Questa vasta rete di funzioni biosintetiche e detossificanti, che assicura l’integrità operativa della cellula, è in ultima analisi governata dalla capacità del mitocondrio di agire come arbitro supremo del destino cellulare, orchestrando il processo di apoptosi.
Il mitocondrio come regolatore centrale dell’apoptosi
L’apoptosi, o “morte cellulare programmata”, è un processo fisiologico essenziale per l’omeostasi dei tessuti, che permette di eliminare cellule danneggiate, invecchiate o non più necessarie. Si distingue nettamente dalla necrosi, una morte cellulare passiva e patologica.
| Caratteristiche | Apoptosi | Necrosi |
|---|---|---|
| Estensione | Individuale: una cellula | Di gruppo: molte cellule |
| Membrana cellulare | Integra | Rotta |
| Infiammazione | No | Sì |
| Reperti morfologici | Picnosi, corpi apoptotici | Eosinofilia, cariolisi, carioressi, smerigliato |
Il processo apoptotico si svolge attraverso fasi distinte: una fase di induzione in cui la cellula riceve segnali di morte, una fase di esecuzione caratterizzata da eventi come la condensazione della cromatina e l’attivazione delle caspasi, e una fase finale con la formazione di corpi apoptotici, che vengono eliminati dai fagociti senza innescare una risposta infiammatoria.
L’apoptosi può essere innescata da una varietà di stimoli, tra cui segnali da recettori di morte (famiglia TNF), mancanza di fattori di crescita, danno al DNA (mediato dalla proteina p53), farmaci chemioterapici o agenti fisici come le radiazioni.

Gli esecutori molecolari dell’apoptosi sono una famiglia di proteasi a cisteina note come caspasi. Esse sono prodotte come proenzimi inattivi e vengono attivate tramite un clivaggio proteolitico. Si distinguono in:
- caspasi regolatrici (es. caspasi-8, -9), che iniziano la cascata di attivazione;
- caspasi esecutrici (es. caspasi-3, -7), che degradano substrati cellulari chiave, portando alla morte della cellula.
Esistono due principali vie di attivazione delle caspasi, che convergono sulle caspasi esecutrici.
- Via estrinseca: è mediata da “death receptors” di membrana (es. recettori per TNF e FAS-L). Il legame del ligando induce la trimerizzazione del recettore e l’attivazione a cascata delle caspasi, a partire dalla caspasi-8.
- Via intrinseca (o mitocondriale): in questa via, il mitocondrio svolge un ruolo centrale. In risposta a stimoli pro-apoptotici, si verifica un aumento della permeabilità della membrana mitocondriale. Questo evento porta al rilascio nel citoplasma di molecole chiave, tra cui il citocromo C. Una volta nel citoplasma, il citocromo C si lega al fattore Apaf-1 e alla pro-caspasi-9, formando un complesso multiproteico chiamato apoptosoma. L’apoptosoma attiva la caspasi-9, che a sua volta attiva le caspasi esecutrici. Il mitocondrio può anche rilasciare l’AIF (apoptosis inducing factor), che promuove la morte cellulare attraverso un meccanismo indipendente dalle caspasi.
Il processo apoptotico è finemente regolato da un equilibrio tra proteine pro- e anti-apoptotiche appartenenti alla famiglia di geni Bcl-2:
- inibitori dell’apoptosi: proteine come Bcl-2 e Bcl-xL prevengono l’aumento della permeabilità mitocondriale e il rilascio del citocromo C;
- regolatori pro-apoptotici: proteine come Bax, Bak e Bad promuovono l’apoptosi, spesso agendo tramite dimerizzazione e inibizione delle proteine anti-apoptotiche.
In conclusione, la natura del mitocondrio è profondamente poliedrica. Lungi dall’essere un semplice fornitore di energia, esso si rivela un organello di integrazione e regolazione di importanza capitale. Il suo corretto funzionamento è indispensabile non solo per il metabolismo energetico, ma anche per la biosintesi, la detossificazione e, in ultima analisi, per la determinazione del destino cellulare.
Now loading…