I radiofarmaci ottenuti tramite la radiomarcatura con 99mTc costituiscono la maggior parte delle indagini diagnostiche in medicina nucleare, coprendo circa l’85% degli esami. Questo radionuclide è ampiamente utilizzato per diverse ragioni:
Caricamento…
- Nonostante la sua breve emivita (6 ore), il 99mTc è prodotto in loco da un generatore disponibile in commercio (generatore Molibdeno/Tecnezio, 99Mo/99mTc). Questo permette a qualsiasi servizio di medicina nucleare di gestire facilmente la radiomarcatura nel laboratorio di radiofarmacia, poiché l’emivita fisica del progenitore (99Mo) è di 66 ore.
- Il 99mTc ha una chimica standardizzata che consente una marcatura rapida e stabile nel tempo di molti radiofarmaci.
- La sua emissione gamma è ottimale per la rivelazione tramite una gamma camera, uno strumento ampiamente utilizzato in medicina nucleare, con cristalli di NaI(Tl) che hanno un’efficienza di rivelazione ottimale per energie γ comprese tra 100 e 200 KeV.
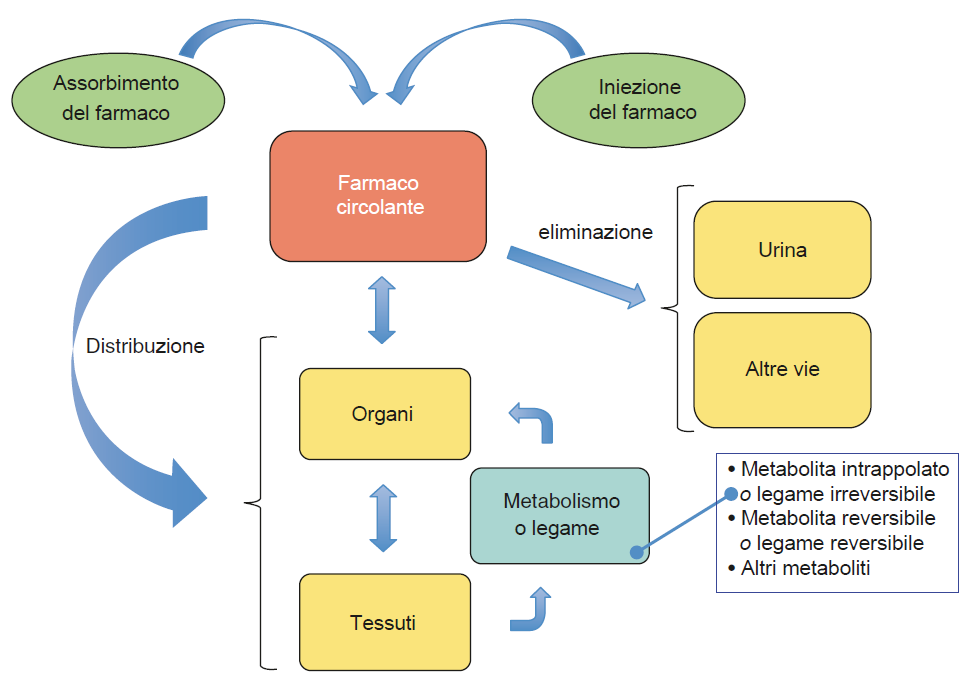
Le informazioni diagnostiche fornite dalle immagini scintigrafiche dipendono dalla distribuzione specifica di un radiofarmaco all’interno del corpo, solitamente somministrato per via endovenosa, anche se a volte la somministrazione può avvenire per via orale o interstiziale. I principali parametri che determinano queste informazioni includono la velocità di scomparsa dal circolo, l’accumulo, la ritenzione e la clearance (o washout) in un tessuto specifico di interesse. Le alterazioni nella funzione fisiologica dei tessuti o degli organi si riflettono in variazioni di questi parametri, in particolare nell’accumulo e/o nella dismissione del radiofarmaco.
Ad esempio, un aumento dell’accumulo di radioiodio in un nodulo tiroideo può indicare un’elevata produzione di ormoni tiroidei da parte di quel nodulo. Al contrario, un ridotto accumulo di un radiofarmaco di flusso in una regione miocardica può suggerire una necrosi dovuta a un precedente infarto o a un’ischemia critica.
Caricamento….
La medicina nucleare ha una notevole sensibilità per rilevare alterazioni precoci della malattia, spesso prima che si manifestino cambiamenti nella forma, nelle dimensioni o nella struttura dei tessuti o degli organi. Tuttavia, va notato che questa sensibilità spesso non è accompagnata da una specificità altrettanto elevata. Ad esempio, l’incremento del metabolismo del glucosio in una regione del corpo (valutato tramite una PET con un analogo del glucosio marcato con 18F) può indicare la presenza di cellule tumorali altamente proliferanti, ma potrebbe anche essere dovuto a una condizione infiammatoria con un aumento del consumo da parte dei granulociti neutrofili. Pertanto, l’interpretazione dei risultati richiede un’attenta considerazione clinica e un’analisi approfondita delle informazioni fornite dalle immagini scintigrafiche.
I radiofarmaci possono essere classificati in base al principale meccanismo che determina le loro specifiche proprietà di distribuzione. Di seguito, alcuni esempi di classificazione in base a questi meccanismi:
- Principio di Diluizione o Localizzazione Compartimentale:
- Massa Eritrocitaria: Utilizzando emazie marcate con 51Cr, è possibile determinare la massa delle cellule del sangue rosso. Questo si basa sul principio della diluizione di un’attività (o massa) di sostanza radioattiva in un volume di distribuzione sconosciuto, permettendo di calcolare il volume sconosciuto (o massa).
- Volume Plasmatico: L’albumina marcata con 125I può essere utilizzata per determinare il volume plasmatico.
- Volume Ematico Circolante: Si può misurare il volume ematico circolante utilizzando emazie marcate con 99mTc.
- Frazione di Eiezione Cardiaca: Questo parametro può essere calcolato utilizzando diversi radiofarmaci.
- Sanguinamenti Gastroenterici Occulti: Emazie marcate con 99mTc possono essere utilizzate per rilevare sanguinamenti gastrointestinali occultati.
- Principio della Microembolizzazione:
Le particelle radioattive di dimensioni adeguate possono essere intrappolate meccanicamente nel letto capillare di alcuni organi. Ad esempio, i macroaggregati di albumina marcati con 99mTc (99mTc-MAA) vengono intrappolati nel letto arterioso dei capillari polmonari. Questo principio viene utilizzato per valutare la distribuzione regionale della perfusione in un organo. Le regioni con normale perfusione saranno visualizzate, mentre quelle a valle di un’ostacolazione (come in caso di malattia tromboembolica) non mostreranno il radiofarmaco. - Principio del Chemioadsorbimento:
Alcuni radiofarmaci, come i difosfonati (ad esempio, 99mTc-HDP o 99mTc-MDP), si accumulano nella matrice cristallina dell’idrossiapatite di calcio nelle ossa. Questo principio è utilizzato per lo studio della patologia scheletrica. - Accumulo dovuto a Stimoli Chemiotattici:
Alcuni radiofarmaci si accumulano in specifici distretti corporei come risultato di stimoli chemiotattici. Ad esempio, i leucociti marcati con 99mTc-HMPAO o con 111In-Ossina si accumulano nei focolai infiammatori, le piastrine marcate con 111In-Ossina sono utilizzate per valutare i trombi, e i globuli rossi danneggiati dall’esposizione al calore e marcati con 99mTc vengono utilizzati per lo studio del sequestro splenico.
Ogni tipo di radiofarmaco sfrutta specifici meccanismi di distribuzione che sono correlati alle caratteristiche chimico-fisiche della molecola e alle interazioni con i tessuti o gli organi bersaglio. Questi principi consentono di ottenere informazioni diagnostiche o terapeutiche utili in una varietà di applicazioni in medicina nucleare.
I radiofarmaci possono accumularsi all’interno delle cellule attraverso diversi meccanismi di trasporto transmembrana. Ecco alcuni dei principali meccanismi coinvolti:
Caricamento…
- Diffusione Semplice: Alcuni radiofarmaci, particolarmente quelli lipofili, possono attraversare facilmente il doppio strato fosfolipidico della membrana cellulare. Questo processo è basato sulla semplice diffusione delle molecole dalla zona di maggiore concentrazione (solitamente l’ambiente extracellulare) a quella di minore concentrazione (ambiente intracellulare). Tuttavia, spesso questi radiofarmaci subiscono ulteriori modifiche intracellulari, legandosi a metaboliti polari o complessi carichi, impedendo così la fuoriuscita dalla cellula.
- Trasporto Facilitato: Alcuni radiofarmaci utilizzano trasportatori specifici nella membrana cellulare per entrare o uscire dalle cellule. Ad esempio, l’analogo del glucosio [18F]FDG sfrutta il sistema di trasportatori del glucosio (GLUT1-5) per entrare nella cellula. Questo è utilizzato comunemente in imaging PET per rilevare l’accumulo di glucosio nelle cellule.
- Trasporto Attivo: Alcuni radiofarmaci richiedono l’impiego di energia, come l’ATP o un gradiente elettrochimico di ioni (come Na+ o H+), per entrare nelle cellule. Ad esempio, lo ione ioduro (come 123I–, 124I–, 125I–, 131I) entra nelle cellule tiroidee attraverso uno specifico trasportatore transmembrana noto come symporter sodio/iodio (NIS). Anche radiofarmaci come il 201Tl– e 82Rb–, analoghi del potassio, sono trasportati attivamente nelle cellule, spesso sfruttando la pompa sodio/potassio.
- Fagocitosi: Alcuni radiofarmaci, come i nanocolloidi di albumina marcati con 99mTc, vengono inglobati dalle cellule attraverso il processo di fagocitosi. Questo meccanismo è responsabile dell’accumulo di radiofarmaci nei macrofagi del sistema reticoloendoteliale, come le cellule di Kupffer nel fegato.
- Intrappolamento Metabolico: Alcuni radiofarmaci subiscono una trasformazione chimica all’interno delle cellule, catalizzata da specifici enzimi. Questa trasformazione converte il radiofarmaco originario in un metabolita intermedio che non può attraversare nuovamente la membrana cellulare, portando all’accumulo intracellulare. Ad esempio, il [18F]FDG si accumula nelle cellule dopo essere stato trasportato attraverso la membrana da trasportatori di glucosio (GLUT1-5) e successivamente fosforilato, impedendo il suo ritorno all’esterno.
- Competizione Enzimatica: Alcuni radiofarmaci agiscono come substrati competitivi rispetto a molecole endogene per lo stesso sito catalitico degli enzimi. Di conseguenza, il radiofarmaco compete con il substrato endogeno, portando all’accumulo del prodotto radiomarcato all’interno della cellula. Esempi includono la deossitimidina e la colina marcate con 11C o 18F, che competono rispettivamente con la timidina-chinasi e la colina-chinasi.
- Legame a Recettori: Alcuni radiofarmaci si legano ai recettori presenti sulla superficie delle cellule. Questi radiofarmaci competono con il ligando endogeno recettore-specifico per il legame al recettore stesso. L’efficacia di questi radiofarmaci dipende dall’alta specificità di legame (in genere a livello nano-molare) e dall’attività specifica della preparazione radiofarmaceutica. Ad esempio, gli analoghi radiomarcati della somatostatina si legano ai recettori della somatostatina presenti sulla superficie delle cellule.
- Legame a Proteine Specifiche: Alcuni radiofarmaci mirano a proteine endogene presenti in condizioni fisiologiche o durante la trasformazione patologica dei tessuti. Questo legame può essere basato su meccanismi immunologici o di affinità non recettoriale. Esempi includono anticorpi radiomarcati diretti contro antigeni espressi sulla superficie delle cellule tumorali o contro epitopi di glicoproteine nel tessuto tumorale.
- Monitoraggio della Trasfezione Genetica: Questo approccio, ancora in fase di ricerca preclinica, coinvolge radiofarmaci (soprattutto in ambito PET) che consentono il monitoraggio dell’efficacia di una trasfezione di materiale genetico all’interno di un sistema biologico. Un vettore di trasfezione integrerà una sequenza specifica nel genoma dell’ospite, che può essere selettivamente rilevata da un radiofarmaco. Questo processo consente di visualizzare la trasfezione genetica e la produzione di un segnale specifico.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.