In primo luogo, la PET-FDG è una procedura di prima linea nella diagnosi della febbre di origine sconosciuta (FUO), a causa della necessità in questi pazienti di una sensibilità elevata per rilevare lesioni occulte, non negativamente controbilanciata da una ridotta specificità. È importante ricordare che le lesioni occulte che determinano la febbre possono essere individuate sia come neoplasie, inclusi frequentemente linfomi o tumori della testa e del collo, sia come malattie infiammatorie, spesso in una fase cronica attiva.
Altre informazioni utili possono essere fornite dalla PET-FDG nella definizione dell’attività in molte malattie infiammatorie, come la malattia di Crohn o la sarcoidosi, per rilevare placche aterosclerotiche attivate nei grandi vasi, per determinare la presenza di una reazione infiammatoria nell’area circostante dispositivi protesici, nelle malattie autoimmuni, e così via.
Diagnosi differenziale con PET-FDG in oncologia
Sebbene l’assorbimento di FDG sia “probabilmente” collegato alla presenza di cellule neoplastiche, questo evento non è patognomonico di malignità, a causa della possibile presenza di risultati falsi positivi. Allo stesso modo, l’assenza di assorbimento non può escludere la presenza di neoplasie, a causa della possibilità di falsi negativi dovuti a vari parametri come il tipo istologico (basso o assente assorbimento nelle neoplasie differenziate), la dimensione (inferiore a 0,5 mm o anche di più in alcune aree) e la localizzazione (difficile rilevamento delle metastasi cerebrali).
Pertanto, una diagnosi differenziale non può basarsi esclusivamente sulla PET-FDG, richiedendo un’integrazione iniziale basata su dati clinici ed ematologici e sul rilevante contributo complementare fornito dalla TC, soprattutto quando implementata con l’uso di mezzi di contrasto.
Tuttavia, in molti casi è difficile ottenere una diagnosi certa e, pertanto, sono state sviluppate e proposte nella pratica clinica molte procedure per cercare di aumentare l’accuratezza diagnostica.
Per la PET-FDG, sono stati sviluppati due approcci principali, basati sul presupposto che le lesioni maligne abbiano un assorbimento maggiore rispetto a quelle benigne e su cinetiche diverse. In particolare, le procedure a doppio tempo sono state suggerite sulla base dell’osservazione che, nelle prime ore dopo l’iniezione endovenosa, mentre l’assorbimento di FDG tende a crescere o rimanere stabile nei tumori, diminuisce nelle lesioni benigne. Questa strategia diagnostica differenziale non ha ancora trovato ampia diffusione, sia per la mancanza di prove complete e ampie su tutti i tipi di lesioni patologiche, sia per l’alto costo di una seconda scansione, che potrebbe ridurre significativamente il numero di pazienti che possono essere studiati quotidianamente con uno scanner PET.
Più applicabile è l’uso di un approccio quantitativo. Sebbene sia stato dimostrato che le cellule neoplastiche possono concentrare più glucosio rispetto alle cellule normali che crescono allo stesso ritmo, questa informazione non può essere acquisita in modo affidabile solo utilizzando FDG negli studi di routine, richiedendo la correzione simultanea dell’assorbimento misurato per il numero di cellule e per il loro tasso di crescita (come potrebbe essere valutato, ad esempio, con F-18 timidina). Inoltre, un confronto rigoroso dovrebbe basarsi su metodi quantitativi assoluti, ma al momento non esistono ancora procedure non invasive, facili e ripetibili applicabili nella pratica clinica.
Pertanto, in attesa di tecniche più rigorose, per aumentare le informazioni acquisite attraverso l’analisi visiva sono stati sviluppati e proposti metodi semiquantitativi nella pratica clinica.Sebbene siano state proposte procedure quantitative più precise e rigorose, l’unica consolidata nella pratica clinica è ancora il cosiddetto SUV (Valore di Assorbimento Standardizzato).
Il SUV è un metodo semiquantitativo che definisce l’entità dell’assorbimento di FDG, basato su un rapporto che approssimativamente confronta il valore della lesione con l’attività dell’intero corpo. Questo valore è influenzato da molti fattori, come il livello di glucosio nel sangue, il peso corporeo e la distribuzione del glucosio nei compartimenti. Inoltre, è fortemente influenzato da variabili come la macchina, il rilevatore e la procedura utilizzata, inclusi possibili miglioramenti come il gating respiratorio.
Non è possibile confrontare un SUV misurato con uno scanner TOF con quello calcolato con una macchina standard o una PET/MRI, poiché i valori calcolati nello stesso paziente possono variare tra diversi centri.
Per questi motivi, il SUV non può essere considerato un’informazione assolutamente affidabile e deve essere utilizzato con cautela nei rapporti clinici, per evitare confusione nei medici che leggono i valori ottenuti in vari centri. Tuttavia, quando analizzato criticamente dai medici nucleari in un contesto omogeneo (ad esempio, utilizzando la stessa macchina), il SUV può avere un ruolo clinico utile, complementare all’analisi visiva, aumentando (o diminuendo) la probabilità diagnostica di malignità, definendo meglio un valore prognostico in una popolazione con un singolo istotipo e determinando più precisamente le variazioni temporali nel follow-up dello stesso paziente o nella valutazione della risposta tumorale.
Inoltre, il SUV è stato proposto per aumentare l’accuratezza diagnostica nella diagnosi differenziale dei tumori primari, come i noduli polmonari solitari, attraverso la definizione di una soglia di assorbimento: per lesioni superiori a 1 cm, il cancro è più probabile in presenza di un SUV superiore a 2,5.
Attualmente, l’utilità del SUV può essere suggerita in tutti i casi in cui una valutazione semiquantitativa può essere importante per una valutazione prognostica e/o quando la PET-FDG è utilizzata per valutare la risposta terapeutica. In tutti i casi, il SUV (e/o altri metodi semiquantitativi) deve essere valutato con molta attenzione, e il suo ruolo deve essere considerato più utile nella valutazione della risposta tumorale e/o dell’evoluzione prognostica che nella diagnosi differenziale di un cancro primario.
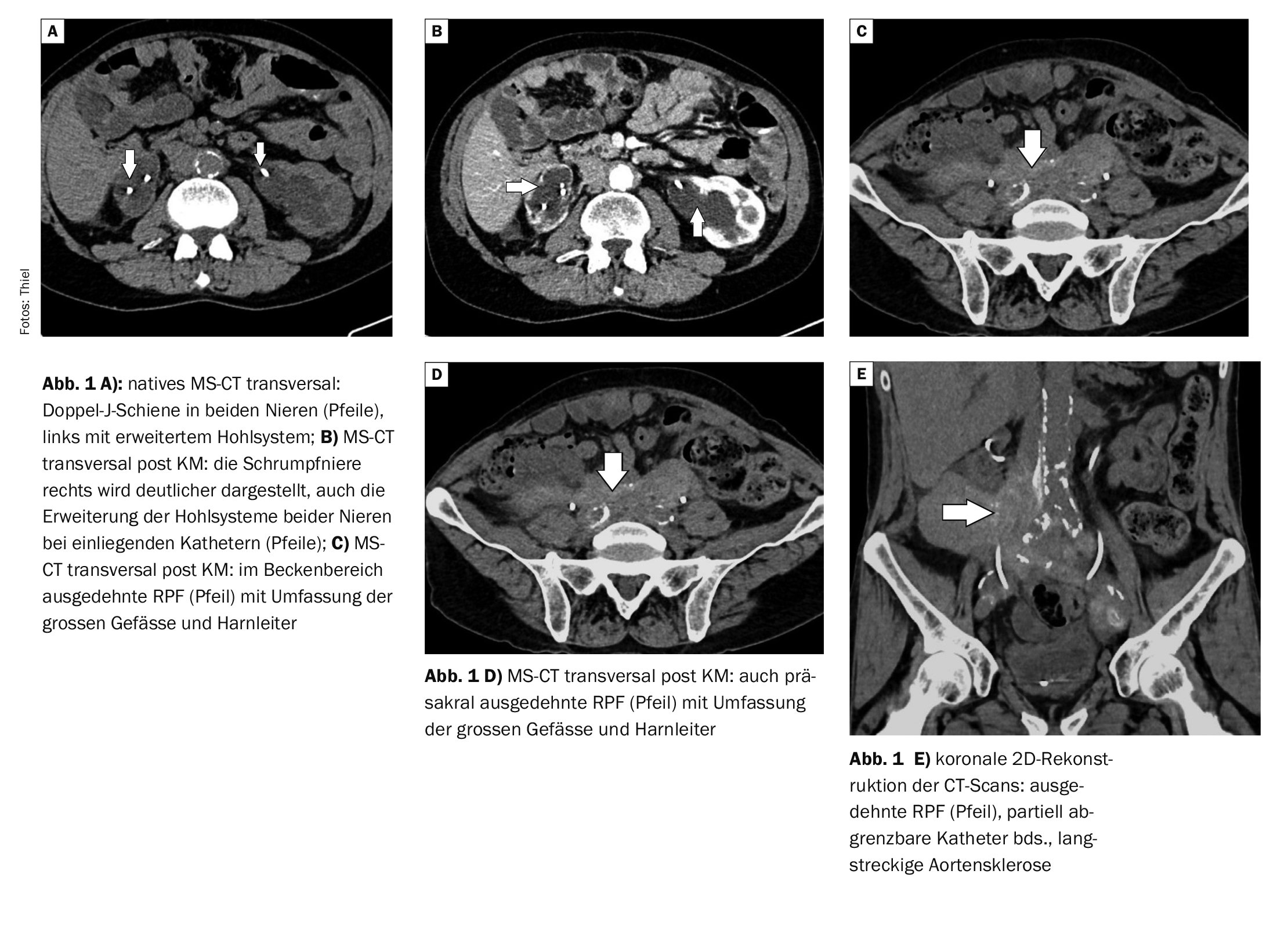
È importante sottolineare che una maggiore accuratezza diagnostica nella diagnosi differenziale può essere raggiunta in modo più affidabile quando l’interpretazione della PET è completata dal contributo significativo della TC, soprattutto quando eseguita come CECT.
Fonte: Atlas of Pet-ct: A Quick Guide to Image Interpretation.