L’ipertensione arteriosa è una delle condizioni più comuni e studiate in medicina. Nella maggior parte dei casi è di tipo essenziale, cioè senza una causa individuabile. Tuttavia, in circa il 10% dei pazienti ipertesi, l’origine è secondaria, ovvero legata a una patologia specifica.
Una delle forme più frequenti di ipertensione secondaria è l’iperaldosteronismo primitivo, una condizione spesso misconosciuta ma potenzialmente curabile.
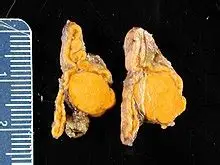
L’iperaldosteronismo primitivo (o sindrome di Conn) è una condizione in cui le ghiandole surrenali producono una quantità eccessiva di aldosterone, un ormone che regola l’equilibrio di sodio e potassio e contribuisce al controllo della pressione arteriosa.
In condizioni normali, l’aldosterone aumenta il riassorbimento di sodio (e quindi di acqua) nei reni e promuove l’eliminazione di potassio. Quando è prodotto in eccesso, si verifica:
- ipertensione arteriosa, per ritenzione di sodio e acqua;
- ipokaliemia, cioè bassi livelli di potassio nel sangue.
Cause
L’iperaldosteronismo primitivo si sviluppa quando le ghiandole surrenali iniziano a produrre aldosterone in eccesso in modo indipendente dai normali stimoli regolatori (come la renina o l’equilibrio sodio-potassio). Questo eccesso non è una risposta fisiologica, ma è dovuto a un’alterazione strutturale o funzionale delle surrenali.
Le principali cause dell’iperaldosteronismo primitivo sono:
- adenoma surrenalico (benigno, unilaterale) → circa 30-40% dei casi;
- iperplasia surrenalica bilaterale (aumento del volume delle ghiandole) → circa 60%;
- forme genetiche rare, come l’iperaldosteronismo familiare;
- più raramente, carcinoma surrenalico.
Now loading…
Una delle cause più frequenti è la presenza di un adenoma surrenalico unilaterale, noto anche come adenoma di Conn. Si tratta di un tumore benigno che produce aldosterone in modo autonomo. Rappresenta circa il 30-40% dei casi di iperaldosteronismo primitivo. Questi adenomi sono spesso piccoli (1-2 cm) e vengono diagnosticati mediante tomografia computerizzata (TAC) o risonanza magnetica. Nei casi sospetti, si ricorre al cateterismo delle vene surrenaliche per confermare la lateralizzazione della produzione ormonale.
La causa più frequente in assoluto è però l’iperplasia surrenalica bilaterale, presente in circa il 60% dei casi. In questa condizione, entrambe le ghiandole surrenali sono ingrandite o presentano un’iperattività funzionale, ma senza una lesione nodulare definita. L’iperplasia è spesso idiopatica, ovvero non si conosce una causa scatenante precisa, ma è chiaro che comporta un’alterazione dell’equilibrio del sistema renina-angiotensina-aldosterone, con una secrezione autonoma di quest’ultimo. Poiché interessa entrambe le surrenali, non è curabile con la chirurgia, e il trattamento è principalmente farmacologico.
Una minoranza dei casi (meno del 5%) è rappresentata da forme genetiche ereditarie, classificate come iperaldosteronismo familiare. Ne esistono diverse varianti:
- Tipo I (detto anche “glucocorticoide-remissibile“): è causato da una fusione anomala tra il gene dell’aldosterone sintasi e quello della 11β-idrossilasi. Risponde alla soppressione con cortisone;
- Tipo II e III: associati a mutazioni genetiche che alterano la funzione delle cellule surrenaliche. In alcuni casi (tipo III), si osservano iperplasie massicce resistenti alla terapia medica.
Le forme familiari sono più frequenti nei pazienti giovani e con forte familiarità per ipertensione precoce o eventi cardiovascolari.
Tra le cause più rare, ma da tenere in considerazione in casi particolari, troviamo il carcinoma surrenalico secernente aldosterone, che rappresenta meno dell’1% dei casi ma può presentarsi in forma aggressiva. Anche alcune forme miste di tumori surrenalici possono produrre più ormoni (es. aldosterone e cortisolo), complicando la diagnosi.
Clinica e complicanze
L’iperaldosteronismo primitivo è spesso definito un “killer silenzioso”, perché in molti casi resta asintomatico o paucisintomatico per anni. Questo è particolarmente vero quando i livelli di potassio rimangono nei limiti della norma, condizione che si verifica in una quota non trascurabile di pazienti. Tuttavia, anche in assenza di sintomi evidenti, l’eccesso cronico di aldosterone esercita un effetto tossico su vari organi, contribuendo a danni cardiovascolari, renali e metabolici.
Sintomi legati all’ipertensione arteriosa
Il segno clinico predominante dell’iperaldosteronismo primitivo è l’ipertensione arteriosa. Spesso si presenta in forma grave o resistente, ovvero non controllata adeguatamente con tre o più farmaci antipertensivi, inclusi un diuretico. In alcuni casi, l’ipertensione può comparire in giovane età (prima dei 40 anni), oppure essere scoperta incidentalmente nel corso di controlli routinari.

I sintomi dell’ipertensione in sé non sono specifici, ma possono includere:
- cefalea persistente, soprattutto mattutina;
- sensazione di tensione o pesantezza al capo;
- palpitazioni, sudorazione e ansia in alcuni casi;
- affaticamento generale o senso di stanchezza anche a riposo.
Va sottolineato che molti pazienti non avvertono disturbi significativi fino a quando non si sviluppano complicanze.
Manifestazioni da ipokaliemia
L’ipokaliemia, cioè la carenza di potassio nel sangue, è una diretta conseguenza dell’azione dell’aldosterone, che stimola i reni a espellere potassio. Quando presente in modo significativo, l’ipokaliemia può dare luogo a una serie di disturbi neuromuscolari e cardiaci, tra cui:
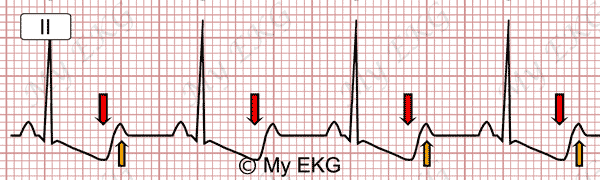
- debolezza muscolare o crampi, specie agli arti inferiori;
- astenia profonda, talvolta confusa con sindromi da fatica cronica;
- poliuria e polidipsia (aumento della diuresi e della sete), dovute all’incapacità renale di concentrare le urine;
- aritmie cardiache, talvolta anche gravi, come tachicardie ventricolari o fibrillazione atriale;
- nei casi più severi, può comparire paralisi muscolare episodica.
Questi sintomi, quando presenti, devono sempre far sospettare un disordine elettrolitico sottostante, specie se associati a ipertensione.
Conseguenze a lungo termine dell’eccesso di aldosterone
Anche in assenza di ipokaliemia, l’eccesso di aldosterone ha effetti pro-infiammatori, fibrotici e pro-ipertrofici, che colpiscono cuore, vasi e reni. Le principali complicanze a lungo termine includono:
Caricamento….
- danno cardiovascolare: l’aldosterone favorisce ipertrofia ventricolare sinistra, rimodellamento cardiaco, e aumenta il rischio di infarto miocardico, scompenso cardiaco e fibrillazione atriale. È stato dimostrato che, a parità di pressione arteriosa, i pazienti con iperaldosteronismo hanno un rischio cardiovascolare superiore rispetto a quelli con ipertensione essenziale;
- ictus e eventi cerebrovascolari: l’associazione tra aldosterone e danno vascolare cerebrale è ben documentata. L’eccesso ormonale contribuisce a un aumento del tono vascolare e alla rigidità arteriosa, predisponendo a eventi ischemici;
- compromissione renale: l’azione vasocostrittrice dell’aldosterone a livello delle arteriole renali può portare a nefropatia ipertensiva, proteinuria, e progressivo deterioramento della funzione renale, soprattutto nei pazienti con ipertensione non controllata;
- alterazioni metaboliche: anche se meno frequente, è stato osservato un aumento della resistenza insulinica nei pazienti con iperaldosteronismo, suggerendo un possibile legame con la sindrome metabolica.
Diagnosi
La diagnosi dell’iperaldosteronismo primitivo (IAP) rappresenta un passaggio fondamentale per identificare una causa potenzialmente curabile di ipertensione arteriosa. È importante sottolineare che il percorso diagnostico non si esaurisce in un singolo esame, ma si articola in fasi distinte, che vanno dall’identificazione dei soggetti a rischio fino alla conferma biochimica e alla localizzazione della sede della produzione ormonale anomala:
- sospetto clinico;
- screening biochimico (ARR);
- test confermativi (es. carico salino);
- localizzazione (TAC + AVS).
Questo percorso consente di distinguere tra forme curabili chirurgicamente e forme da trattare farmacologicamente, migliorando significativamente la gestione del paziente iperteso.
Il primo passo diagnostico è rappresentato dal sospetto clinico. L’iperaldosteronismo primitivo deve essere considerato in tutti i pazienti con ipertensione arteriosa che presenti caratteristiche di gravità, resistenza ai trattamenti convenzionali o esordio precoce. In particolare, è giustificato lo screening nei soggetti con ipertensione resistente (ossia non controllata da almeno tre farmaci, tra cui un diuretico), nei casi di ipertensione grave, oppure quando l’ipertensione si associa a ipokaliemia, anche se indotta da diuretici. Altre situazioni che giustificano l’avvio dell’iter diagnostico sono la comparsa di ipertensione in giovane età, la presenza di un incidentaloma surrenalico o una familiarità per iperaldosteronismo o eventi cardiovascolari precoci.
Una volta individuato un paziente a rischio, il primo esame da eseguire è il dosaggio del rapporto aldosterone/renina (ARR), che rappresenta il test di screening più utilizzato. Si misura la concentrazione plasmatica dell’aldosterone e, parallelamente, l’attività reninica plasmatica (o la concentrazione diretta della renina). Nell’iperaldosteronismo primitivo, si riscontra una secrezione di aldosterone inappropriatamente elevata in presenza di renina soppressa: questo disequilibrio si traduce in un rapporto marcatamente aumentato. Tuttavia, il risultato può essere influenzato da numerose variabili, tra cui la postura, l’ora del prelievo, lo stato del bilancio idro-elettrolitico e l’uso di farmaci antipertensivi che interferiscono con il sistema renina-angiotensina-aldosterone. È quindi buona pratica eseguire il test al mattino, dopo alcune ore in posizione eretta, e sospendere temporaneamente, quando possibile, i farmaci interferenti. Inoltre, è essenziale correggere eventuali alterazioni della potassiemia prima del prelievo, perché la carenza di potassio può sopprimere la produzione di aldosterone e falsare il risultato.
Un valore elevato del rapporto aldosterone/renina non è di per sé sufficiente per confermare la diagnosi, e va seguito da un test di conferma. Questo serve a verificare che la secrezione di aldosterone sia effettivamente autonoma e non influenzabile dagli stimoli fisiologici. Tra i test confermativi, quello più utilizzato nella pratica clinica è il test da carico salino endovenoso. Esso prevede l’infusione controllata di due litri di soluzione fisiologica nell’arco di quattro ore. In un soggetto sano, l’espansione volemica dovrebbe determinare una soppressione dell’aldosterone, mentre nei pazienti con iperaldosteronismo primitivo i livelli plasmatici restano elevati. Il test è ben tollerato nella maggior parte dei pazienti, salvo controindicazioni nei soggetti con insufficienza cardiaca o renale.
Altri test disponibili includono il test al captopril, che si basa sull’inibizione dell’enzima convertitore dell’angiotensina, e il test alla fludrocortisone, considerato il più sensibile ma meno pratico per la sua complessità esecutiva, che richiede un monitoraggio continuo e spesso un’ospedalizzazione.
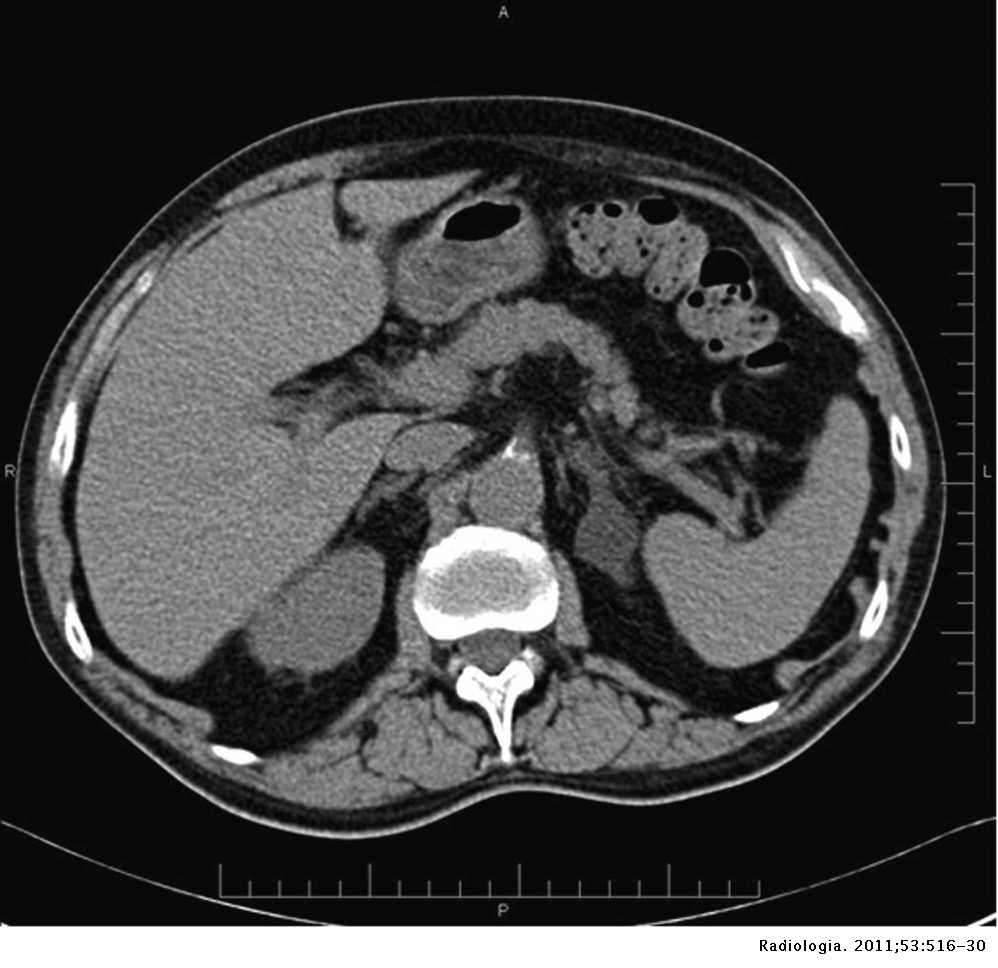
Una volta confermata la diagnosi biochimica, è necessario determinare se l’eccesso di aldosterone sia monolaterale, come accade in presenza di un adenoma funzionante del surrene (adenoma di Conn), o bilaterale, come nelle forme di iperplasia surrenalica idiopatica. Questo passaggio è cruciale per scegliere il trattamento più appropriato. Il primo esame radiologico indicato è la tomografia computerizzata (TAC) dell’addome con mezzo di contrasto, che permette di visualizzare eventuali noduli surrenalici. Tuttavia, la sola imaging morfologica può essere fuorviante, poiché piccoli adenomi possono sfuggire alla rilevazione o, al contrario, possono essere presenti lesioni non secernenti che non spiegano il quadro clinico.
Per questo motivo, nei casi candidabili a un intervento chirurgico, è indicato procedere al cateterismo delle vene surrenaliche (AVS). Si tratta di una procedura invasiva, eseguita in centri altamente specializzati, che consente di prelevare sangue direttamente dalle vene di ciascun surrene. Analizzando il rapporto tra aldosterone e cortisolo nei due lati, è possibile stabilire con precisione se la produzione è unilaterale (e quindi potenzialmente curabile con la surrenectomia) oppure bilaterale (più indicata al trattamento medico). Nonostante la difficoltà tecnica della procedura, l’AVS rappresenta il gold standard per la diagnosi funzionale topografica.
Ricordiamoci che l’iperaldosteronismo primitivo va distinto da:
- iperaldosteronismo secondario (renina alta): causato da stenosi dell’arteria renale, diuretici, insufficienza cardiaca, cirrosi;
- sindrome di Cushing: può mimare il IAP se produce anche aldosterone;
- feocromocitoma o ipokaliemia ipertensiva da altre cause (es. sindrome di Liddle).
Trattamento
Il trattamento dell’iperaldosteronismo primitivo mira principalmente a correggere l’eccesso di aldosterone, controllare la pressione arteriosa e prevenire le complicanze cardiovascolari e renali associate all’iperproduzione di questo ormone. La strategia terapeutica varia in base alla causa sottostante e alla localizzazione della produzione eccessiva di aldosterone, nonché alle caratteristiche cliniche del paziente.
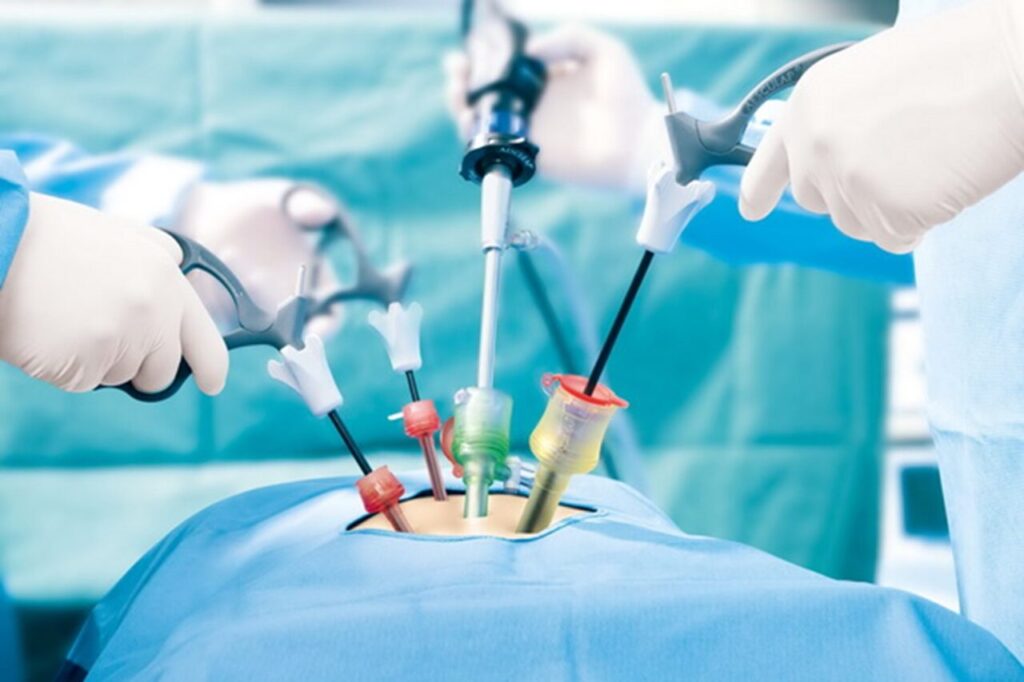
Nei pazienti in cui l’iperaldosteronismo primitivo è causato da un adenoma surrenalico unilaterale, la surrenectomia laparoscopica rappresenta la terapia di scelta. Questa procedura consiste nella rimozione chirurgica del surrene affetto, che elimina la fonte di aldosterone autonomo. Gli interventi di questo tipo sono generalmente ben tollerati e sono associati a un miglioramento significativo o alla normalizzazione della pressione arteriosa in una buona percentuale di casi. Inoltre, la correzione dell’iperaldosteronismo riduce il rischio di danni organici a lungo termine, come la fibrosi cardiaca e renale. La decisione di procedere con la chirurgia richiede una diagnosi accurata tramite cateterismo delle vene surrenaliche per confermare la unilateralità della lesione, poiché nelle forme bilaterali l’intervento non è indicato.
Now loading…
Nei casi in cui l’iperaldosteronismo è dovuto a iperplasia surrenalica bilaterale o in pazienti non candidabili a chirurgia, il trattamento principale è farmacologico. I farmaci di prima linea sono gli antagonisti del recettore mineralcorticoide, come la spironolattone e l’eplerenone. Questi farmaci bloccano gli effetti dell’aldosterone a livello renale e tissutale, favorendo la riduzione della pressione arteriosa e la normalizzazione del potassio plasmatico. La spironolattone è efficace e generalmente ben tollerata, anche se può causare effetti collaterali come ginecomastia e disturbi gastrointestinali. L’eplerenone, un antagonista più selettivo, è associato a minori effetti androgenici e rappresenta un’alternativa per i pazienti che non tollerano la spironolattone.
La terapia medica richiede un monitoraggio regolare della pressione, degli elettroliti e della funzione renale, soprattutto nelle prime fasi del trattamento, per aggiustare le dosi e prevenire iperkaliemia o altre complicanze.
Oltre alla terapia specifica per l’iperaldosteronismo, è fondamentale ottimizzare il controllo dell’ipertensione arteriosa e gestire i fattori di rischio cardiovascolare associati. Ciò include l’adozione di modifiche dello stile di vita come una dieta iposodica, l’attività fisica regolare, la cessazione del fumo e la gestione del peso corporeo. Nei casi in cui la terapia con antagonisti del recettore mineralcorticoide sia insufficiente, si possono aggiungere altri farmaci antipertensivi (es. calcio-antagonisti, ACE-inibitori) per raggiungere gli obiettivi pressori.
La ricerca clinica continua a migliorare la comprensione dei meccanismi molecolari alla base dell’iperaldosteronismo e a sviluppare terapie più mirate. Nuovi antagonisti del recettore mineralcorticoide con profili di sicurezza migliorati e farmaci che modulano la sintesi di aldosterone sono in fase di studio. Inoltre, l’approccio multidisciplinare che coinvolge endocrinologi, nefrologi e chirurghi consente di personalizzare la cura, migliorando i risultati a lungo termine.
Prognosi
La prognosi dipende da vari fattori, tra cui la tempestività della diagnosi, la corretta identificazione della forma clinica e l’efficacia del trattamento instaurato.
In assenza di un trattamento appropriato, l’eccesso cronico di aldosterone determina un aumento della pressione arteriosa che risulta spesso difficile da controllare con le comuni terapie antipertensive. Inoltre, l’aldosterone esercita effetti dannosi diretti su cuore, vasi e reni, indipendentemente dall’ipertensione. Questi effetti includono la promozione della fibrosi cardiaca e renale, che può portare a insufficienza cardiaca, aritmie, ipertrofia ventricolare sinistra e danno renale progressivo. Di conseguenza, i pazienti con IAP non diagnosticato o non trattato hanno un rischio significativamente maggiore di eventi cardiovascolari, quali ictus, infarto miocardico e insufficienza renale, rispetto a quelli con ipertensione essenziale.
Caricamento…
Fortunatamente, la prognosi migliora notevolmente quando l’iperaldosteronismo primitivo viene riconosciuto e trattato tempestivamente. Nei pazienti con adenoma surrenalico unilaterale, la rimozione chirurgica del surrene affetto può portare alla normalizzazione o a un significativo miglioramento della pressione arteriosa e del bilancio elettrolitico. Molti di questi pazienti possono ridurre o interrompere la terapia antipertensiva, e si osserva spesso una riduzione del rischio di danni d’organo.
Nei casi di iperplasia bilaterale, la terapia farmacologica con antagonisti del recettore mineralcorticoide controlla efficacemente la pressione e corregge l’ipokaliemia, migliorando la qualità di vita e riducendo il rischio di complicanze. Tuttavia, la risposta può essere parziale e spesso è necessario associare altri farmaci antipertensivi.
Diversi elementi influenzano la prognosi individuale. Il tempo trascorso dalla comparsa dell’ipertensione all’inizio della terapia è critico: più precoce è il trattamento, migliore sarà la prevenzione del danno d’organo. L’età del paziente, la presenza di altre comorbidità cardiovascolari o renali, e la severità dell’ipertensione sono anch’essi determinanti importanti.
Fonti:
- Primary Aldosteronism Guideline Resources – Endocrine society;
- Primary aldosteronism – UpToDate;
- Williams Textbook of Endocrinology, 14th Edition (2019);
- Harrison’s Principles of Internal Medicine, 20th Edition (2018);
- Endocrinology: Adult and Pediatric, 7th Edition (2016);
- European Society of Hypertension (ESH) Guidelines on Hypertension (2018).