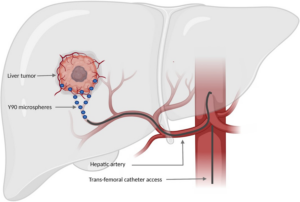
Il razionale biologico della radioembolizzazione si fonda su una peculiarità anatomica del fegato: la sua duplice vascolarizzazione. Mentre il parenchima epatico sano riceve oltre l’80% del suo apporto ematico dalla vena porta, i tumori con diametro superiore ai 2 cm dipendono per oltre l’80% dall’arteria epatica. Questa ipervascolarizzazione arteriosa delle neoplasie consente di veicolare microsfere radioattive direttamente nel letto vascolare tumorale attraverso l’arteria epatica, ottenendo un targeting selettivo che massimizza l’effetto terapeutico sulle lesioni e minimizza l’esposizione del tessuto sano circostante.
La terapia si avvale di specifici radionuclidi, le cui proprietà fisiche ne determinano l’applicazione clinica e le modalità di imaging:
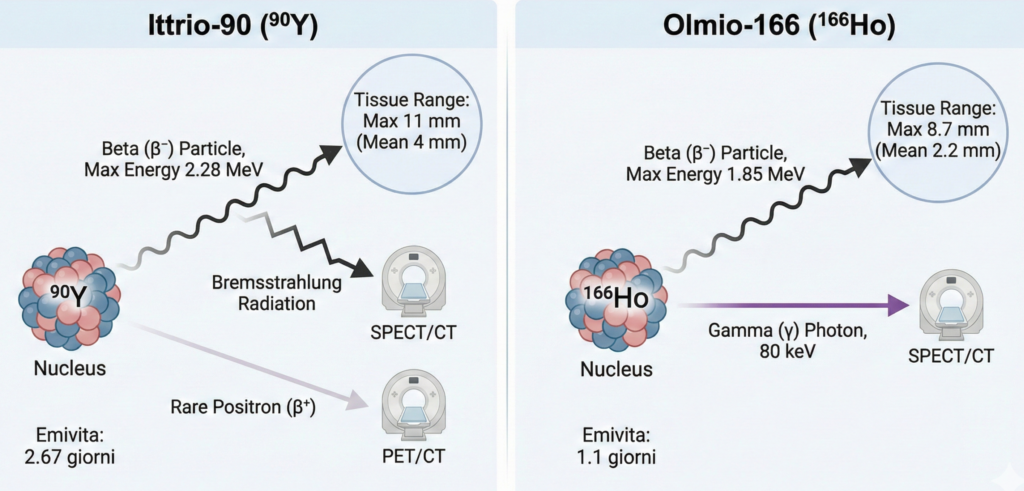
- 90Y (Ittrio-90): è un emettitore beta puro con un’emivita fisica di 2.67 giorni (64.2 ore). Le particelle beta emesse hanno un’energia massima di 2.28 MeV e media di 0.94 MeV, con un raggio d’azione massimo nei tessuti molli di 11 mm (medio 4 mm). Non emette fotoni gamma, ma la radiazione secondaria di “bremsstrahlung” e una rara emissione di positroni (32 decadimenti per milione) ne permettono la visualizzazione tramite imaging post-trattamento (rispettivamente SPECT/CT e PET/CT);
- 166Ho (Olmio-166): è un emettitore beta con un’emivita fisica più breve, pari a 1.1 giorni (26.8 ore). Le principali energie delle particelle beta sono 1.85 MeV (50.0%) e 1.77 MeV (48.7%), con un raggio d’azione massimo nei tessuti molli di 8.7 mm (medio 2.2 mm). A differenza dell’Ittrio-90, l’Olmio-166 co-emette fotoni gamma a 80 keV, che ne consentono una visualizzazione diretta e quantitativa tramite SPECT/CT.
Le microsfere utilizzate come veicolo per questi radionuclidi presentano caratteristiche fisiche distinte che influenzano la procedura e la distribuzione della dose.
Confronto tra le microsfere per radioembolizzazione
| Caratteristica | Microsfere di resina (SIR-Spheres®) | Microsfere di vetro (TheraSphere®) | Microsfere di Acido Polilattico (QuiremSpheres®) |
|---|---|---|---|
| Materiale | Resina | Vetro | Acido Polilattico |
| Dimensione particelle (μm) | 30 (range 20-60) | 25 (range 20-30) | 30 (range 15-60) |
| Effetto embolico | Moderato | Lieve | Moderato |
| Attività per sfera (Bq) | 40–70 | 4534* | 200–400 |
| Peso specifico (g/dL) | 1.6 | 3.7 | 1.4 |
Nota: Il valore di attività per le microsfere di vetro TheraSphere® (4534 Bq) deriva da una misurazione diretta alla calibrazione, mentre le istruzioni per l’uso (IFU) del produttore riportano un valore di 2500 Bq.
Le differenze nell’attività specifica hanno importanti implicazioni cliniche. A parità di attività prescritta, le microsfere di vetro, avendo un’attività per sfera molto più elevata, vengono iniettate in numero significativamente inferiore rispetto a quelle di resina. Questo si traduce in un effetto embolico minore per le microsfere di vetro. D’altra parte, il numero maggiore di microsfere di resina potrebbe, in teoria, garantire una distribuzione della dose più omogenea all’interno del volume target, sebbene il fenomeno del “clustering” (aggregazione delle particelle) sia presente in entrambe le tipologie.
Indicazioni al trattamento
La radioembolizzazione rappresenta un’opzione terapeutica consolidata per i tumori epatici, in un panorama di indicazioni in rapida e continua evoluzione. Data la complessità degli scenari clinici, la decisione di procedere con il trattamento deve essere sempre presa nell’ambito di un team multidisciplinare, in accordo con le più recenti linee guida cliniche.
L’indicazione generale per la radioembolizzazione comprende tumori epatici primari o secondari.
Valutazione delle controindicazioni
La fase di screening per identificare le controindicazioni al trattamento è di importanza cruciale. Un’accurata selezione del paziente è il primo passo per massimizzare la sicurezza della procedura e ottimizzarne l’efficacia terapeutica, minimizzando i rischi di tossicità severa.
Controindicazioni assolute
Le seguenti condizioni precludono categoricamente l’esecuzione della radioembolizzazione:
- gravidanza e allattamento;
- aspettativa di vita inferiore a 3 mesi;
- insufficienza epatica conclamata (presenza di ascite, ittero, encefalopatia);
- malattia neoplastica extraepatica disseminata;
- presenza di shunt extraepatico non correggibile nel tratto gastrointestinale, evidenziato alla scintigrafia pre-trattamento o all’imaging peri-procedurale.
Controindicazioni relative
Queste condizioni non escludono a priori il trattamento, ma richiedono un’attenta ponderazione del rapporto rischio/beneficio da parte del team multidisciplinare:
- punteggio Child-Pugh > B7: pazienti con cirrosi epatica in classe B7 presentano un rischio elevato di scompenso epatico post-trattamento, specialmente in caso di terapie non segmentali;
- elevato carico tumorale intraepatico: sebbene non esista un cut-off universalmente accettato, un coinvolgimento tumorale del 50-70% del volume epatico totale richiede cautela, poiché riduce il parenchima sano residuo in grado di tollerare l’irradiazione;
- carico tumorale extraepatico limitato: a differenza della malattia disseminata (controindicazione assoluta), una malattia extraepatica limitata può essere accettabile. Vengono spesso tollerati linfonodi ilari (fino a 2 cm) e un numero limitato di noduli polmonari (fino a 5, di diametro ≤1 cm);
- shunt polmonare elevato: uno shunt polmonare che comporterebbe una dose al polmone >30 Gy per sessione o >50 Gy cumulativi. Questa soglia non è assoluta, in quanto l’imaging planare con 99mTc-MAA tende a sovrastimare lo shunt e un limite di sicurezza definitivo non è ancora stato stabilito;
- trombosi della vena porta principale (PVT): in questi pazienti, il beneficio del trattamento è limitato e l’outcome generalmente sfavorevole, specialmente se il trombo neoplastico non è adeguatamente targettato;
- controindicazioni al cateterismo arterioso epatico: condizioni come disordini della coagulazione non gestibili, insufficienza renale severa o allergie gravi ai mezzi di contrasto.
Avvertenze speciali
Esistono scenari clinici che, pur non essendo controindicazioni formali, impongono una pianificazione particolarmente attenta:
- precedente radioterapia a fasci esterni (EBRT) sul fegato: la dose di radiazioni assorbita non può essere semplicemente sommata. Il rischio di epatotossicità è elevato se una frazione significativa del fegato ha già ricevuto ≥30 Gy;
- terapie sistemiche epatotossiche: l’uso recente di chemioterapici ad alta tossicità epatica può aumentare il rischio di insufficienza epatica post-radioembolizzazione;
- rischio di epatite da radiazioni (REILD): una dose eccessiva al parenchima epatico sano può causare una grave epatopatia, caratterizzata da iperbilirubinemia, ipoalbuminemia e ascite, che si manifesta tipicamente 2-6 mesi dopo la procedura;
- rischio di sottodosaggio o sovradosaggio: l’utilizzo di metodi di calcolo dell’attività non basati sulla dosimetria personalizzata (es. metodo BSA) può portare a un trattamento sub-ottimale o, al contrario, a una tossicità inaccettabile.
Il superamento di questa fase di screening apre la strada al work-up diagnostico completo, necessario per confermare l’idoneità del paziente e pianificare in dettaglio la procedura.
Work-up diagnostico pre-procedurale
Un accurato work-up diagnostico è il fondamento per una pianificazione terapeutica personalizzata, sicura ed efficace. Questo processo integra dati clinici, di laboratorio e di imaging multimodale per definire la strategia di trattamento ottimale per ogni singolo paziente.
Valutazione clinica e di laboratorio
La valutazione iniziale deve includere:
- stadiazione del tumore secondo gli standard internazionali;
- valutazione del performance status del paziente;
- dosaggio dei marcatori tumorali sierici, come l’alfa-fetoproteina (AFP) per l’HCC o l’antigene carcino-embrionario (CEA) per le metastasi colorettali;
- test di funzionalità epatica completi, includendo enzimi (AST, ALT), bilirubina, albumina e colinesterasi;
- valutazione dei parametri di coagulazione e della funzione renale (creatinina).
Imaging pre-trattamento
L’imaging multimodale è essenziale per la stadiazione, la valutazione del carico tumorale e la pianificazione dell’approccio:
- Tomografia Computerizzata (TC) con contrasto o Risonanza Magnetica (RMN): eseguite entro 30 giorni dalla procedura, sono fondamentali per calcolare il volume tumorale e del fegato sano, per la stadiazione e per definire l’anatomia vascolare. La fase arteriosa precoce è di particolare importanza;
- PET con 18F-FDG: per i tumori FDG-avidi, la PET è cruciale per la stadiazione, l’identificazione di malattia extraepatica prognostica e la valutazione precoce della risposta metabolica post-trattamento;
- scintigrafia epatobiliare (es. con 99mTc-mebrofenina): può essere considerata per misurare la distribuzione segmentaria della funzione epatica, specialmente in previsione di trattamenti parziali (es. lobectomia da radiazioni).
Imaging peri-procedurale e scintigrafia con 99mTc-MAA
Questa fase combina la valutazione angiografica con una simulazione della distribuzione delle microsfere.
- Angiografia: gli obiettivi principali sono:
- valutare l’anatomia vascolare arteriosa del fegato;
- verificare la pervietà della vena porta;
- identificare vasi anomali o shunt artero-venosi o gastrointestinali che potrebbero causare un’embolizzazione non-target;
- simulazione con 99mTc-MAA / dose scout di 166Ho:
- principio: si inietta un tracciante surrogato, i macroaggregati di albumina marcati con Tecnezio-99m (99mTc-MAA), per simulare la distribuzione delle microsfere. Questo permette di calcolare la Frazione di Shunt Polmonare, un parametro critico per la sicurezza. La formula utilizzata è:
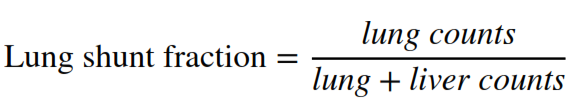
- sicurezza: il calcolo dello shunt è fondamentale per prevenire la polmonite da radiazioni. La dose assorbita ai polmoni deve essere mantenuta al di sotto di soglie di sicurezza: <30 Gy per singola sessione e <50 Gy cumulativi;
- valutazione dosimetrica: la scintigrafia con 99mTc-MAA, acquisita preferibilmente con tecnica SPECT/CT, permette di escludere shunt gastrointestinali e di eseguire una dosimetria pre-trattamento. Lo studio di livello 1 DOSISPHERE-01 ha dimostrato che una dosimetria personalizzata basata su 99mTc-MAA aumenta significativamente la sopravvivenza globale (OS) nei pazienti con HCC, validandone il valore predittivo;
- principio: si inietta un tracciante surrogato, i macroaggregati di albumina marcati con Tecnezio-99m (99mTc-MAA), per simulare la distribuzione delle microsfere. Questo permette di calcolare la Frazione di Shunt Polmonare, un parametro critico per la sicurezza. La formula utilizzata è:
- alternative: per il trattamento con microsfere di Olmio-166, l’uso di una piccola “dose scout” dello stesso agente terapeutico (166Ho-microsfere) si è dimostrato sicuro e più accurato del 99mTc-MAA nel predire la distribuzione finale del farmaco e lo shunt polmonare.
Strategie di pianificazione del trattamento
La pianificazione del trattamento è un processo altamente personalizzato, che tiene conto dell’estensione della malattia, della funzionalità epatica residua e degli obiettivi clinici, che possono variare da un intento palliativo a uno potenzialmente curativo.
Segmentectomia da radiazioni (radiation segmentectomy)
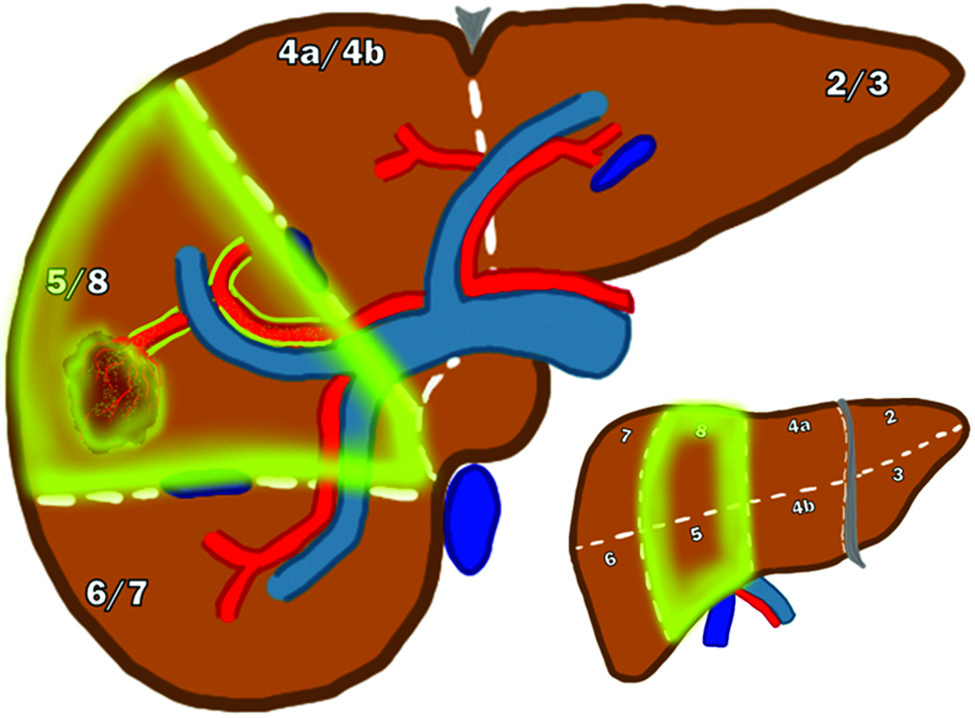
Questa strategia è riservata a pazienti con malattia limitata a uno o due segmenti epatici. Irradiando un volume ridotto di parenchima, è possibile somministrare dosi ablative molto elevate (es. >400 Gy) direttamente al tumore, ottenendo alti tassi di risposta con un rischio di tossicità estremamente basso.
Lobectomia da radiazioni (radiation lobectomy)
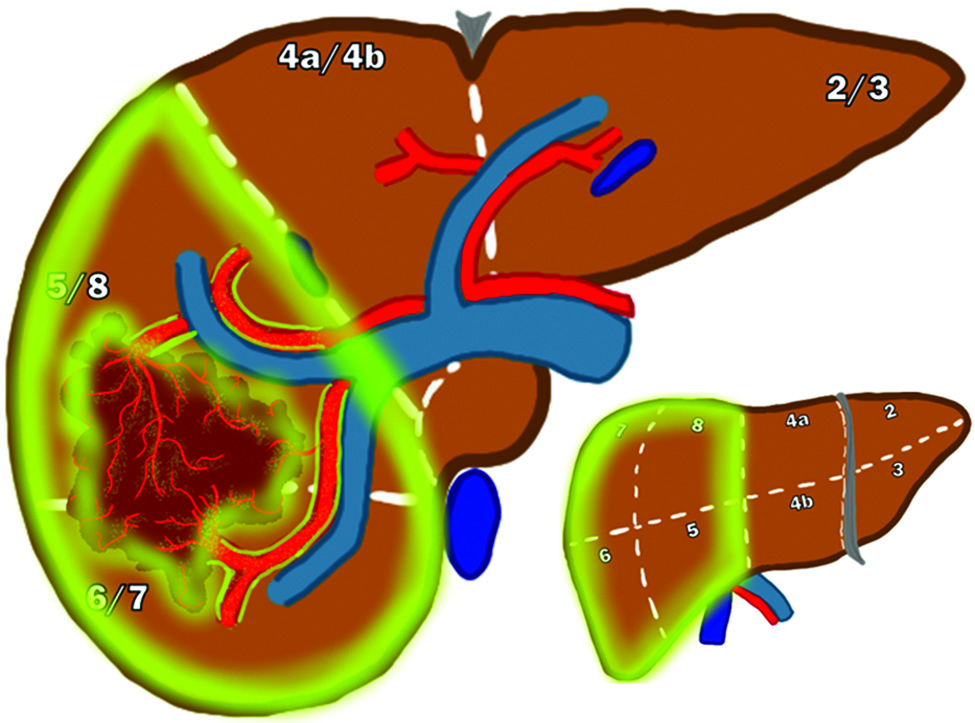
Nei pazienti con malattia confinata a un solo lobo epatico ma non candidabili a resezione chirurgica per un futuro lobo residuo insufficiente, la lobectomia da radiazioni ha un duplice scopo. Oltre al controllo tumorale, l’irradiazione di un intero lobo induce un’ipertrofia compensatoria del lobo controlaterale sano, potendo così fungere da ponte a una successiva resezione chirurgica con intento curativo.
Malattia lobare con/senza trombosi venosa portale (PVT)
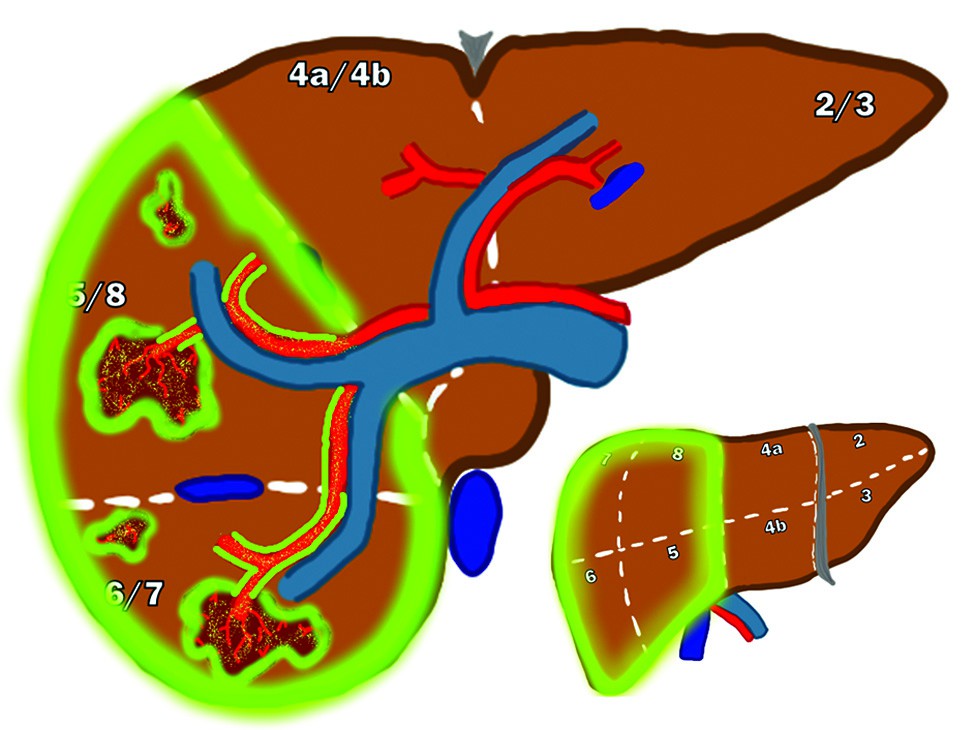
Per i pazienti con malattia unilobare non candidabili a chirurgia per altre ragioni (es. ipertensione portale, cirrosi avanzata), il trattamento ha un intento principalmente palliativo. L’obiettivo è bilanciare l’erogazione di una dose tumoricida efficace con la necessità di preservare il parenchima epatico sano, specialmente quello non trattato.
Malattia bilobare
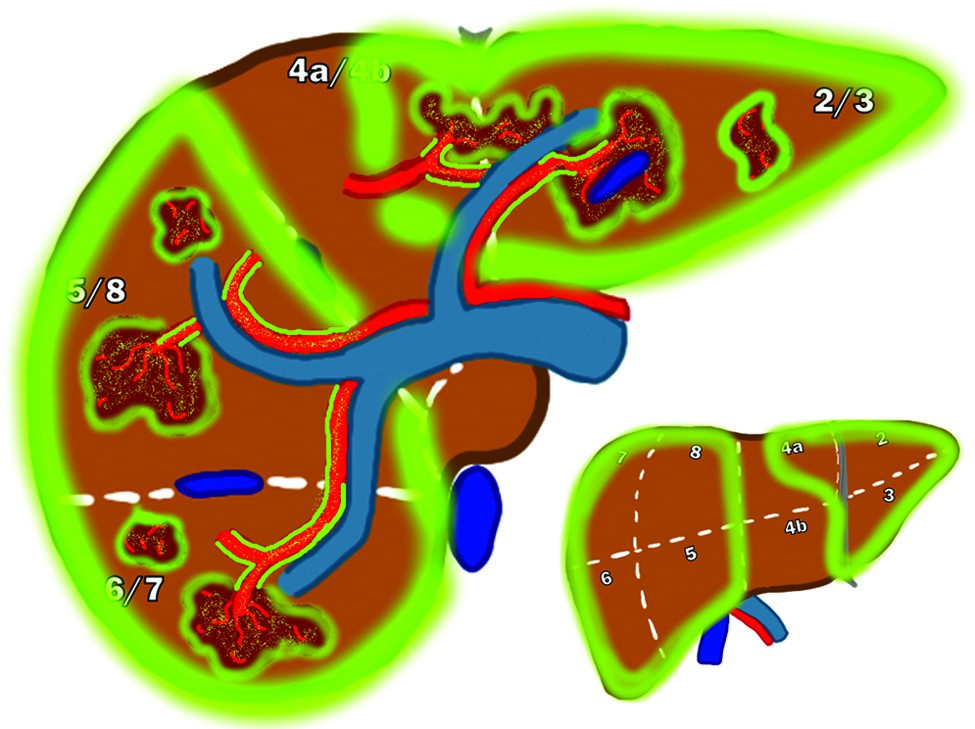
La gestione della malattia epatica estesa a entrambi i lobi rappresenta la sfida maggiore. È cruciale raggiungere dosi efficaci al tumore mantenendo la dose al fegato sano entro i limiti di tolleranza per evitare la REILD. Una strategia comune è il trattamento sequenziale dei due lobi, con un intervallo di alcune settimane o mesi:
- vantaggi: permette di calibrare la dose del secondo trattamento sulla base della dosimetria reale (misurata con PET post-trattamento) del primo, ottimizzando la sicurezza;
- svantaggi: comporta il rischio di progressione della malattia nel lobo non trattato durante l’intervallo tra le due procedure.
Per implementare queste strategie in modo quantitativo e riproducibile, la dosimetria personalizzata è uno strumento indispensabile.
Caricamento…
Principi di dosimetria
La dosimetria è un pilastro della radioembolizzazione moderna, fondamentale per ottimizzare il rapporto tra efficacia terapeutica e tossicità, in linea con i principi di ottimizzazione dell’esposizione radioterapica sanciti dalla Direttiva Europea 2013/59. Essa permette di personalizzare la quantità di attività da somministrare sulla base delle caratteristiche del paziente e del tumore.
Confronto tra modelli dosimetrici
- Modello a compartimento singolo: questo approccio calcola una dose media assorbita sull’intero volume epatico perfuso dal catetere. Il suo limite principale è l’incapacità di distinguere tra tessuto tumorale e parenchima sano. Di conseguenza, si corre il rischio di sottodosare il tumore (se questo è ipervascolarizzato) o di sovradosare il fegato sano (in caso di tumori ipovascolarizzati), portando a un’efficacia sub-ottimale o a una tossicità inaccettabile;
- modello multi-compartimento (partition model): questo modello, più sofisticato, valuta separatamente le dosi medie assorbite da ciascun “compartimento”: tumore, fegato sano e polmoni. Introduce il concetto di rapporto tumore/normale (T/N), che quantifica l’uptake preferenziale del tracciante nel tumore rispetto al fegato sano:
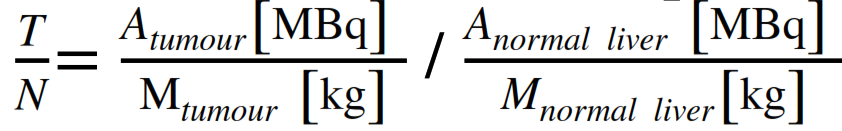
Sulla base di questo rapporto e delle dosi target desiderate, si calcola l’attività da somministrare:
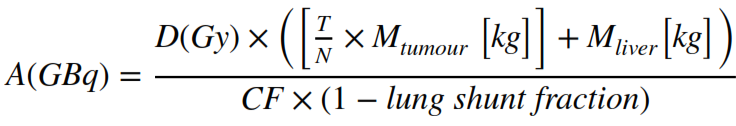
- dosimetria Voxel-based: è l’approccio più avanzato, analogo a quello utilizzato nella radioterapia a fasci esterni. Calcola la dose assorbita in ogni singolo voxel (elemento di volume) dell’immagine, permettendo di visualizzare mappe di dose e gradienti. Sebbene rappresenti un enorme potenziale per correlare la distribuzione spaziale della dose con la risposta biologica, la sua superiorità clinica rispetto all’approccio a dose media (multi-compartimento) non è ancora stata dimostrata in modo conclusivo.
L’applicazione di questi modelli teorici si traduce nel calcolo pratico dell’attività da somministrare, che varia in base al tipo di microsfere utilizzate.
Caricamento….
Calcolo dell’attività e pianificazione pratica del trattamento
Sulla base dei principi dosimetrici, si procede al calcolo dell’attività da somministrare, personalizzandola in base al tipo di microsfere e all’obiettivo clinico. Le attuali linee guida raccomandano, ove possibile, l’utilizzo di un approccio dosimetrico multi-compartimentale in sostituzione dei metodi empirici.
Microsfere di resina (90Y)
Il metodo basato sulla superficie corporea (Body Surface Area – BSA), storicamente utilizzato, è stato superato. Un panel di esperti internazionali raccomanda ora l’uso del modello a partizione (o di metodi voxel-based) per migliorare l’efficacia del trattamento.
Raccomandazioni dosimetriche per microsfere di resina con 90Y
| Scenario Clinico | Dosimetria a scomparto Singolo (dose al volume perfuso, Gy) | Dosimetria multi-scomparto (dose al fegato normale perfuso, Gy) | Dosimetria multi-scomparto (dose al tumore, Gy) |
|---|---|---|---|
| HCC Segmentectomia | >150 | Non applicabile | ≥100–120 |
| HCC Lobectomia | Non raccomandato | >70 | ≥100–120 |
| HCC Unilobare | <40 | <70 | ≥100–120 |
| HCC Bilobare | <30 o <40 | <70 | ≥100–120 |
| ICC Segmentectomia | >150 | Non applicabile | ≥100–120 |
| ICC Lobectomia | Non raccomandato | >70 | ≥100–120 |
| ICC Unilobare | <40 | <70 | ≥100–120 |
| ICC Bilobare | <30 o <40 | <70 | ≥100–120 |
| mCRC Segmentectomia | >150 | Non applicabile | >100 |
| mCRC Lobectomia | Non raccomandato | >70 | >100 |
| mCRC Unilobare | <40 | <70 | >100 |
| mCRC Bilobare | <30 o <40 | <70 | >100 |
Note:
- la dose deve essere mantenuta sotto una soglia di sicurezza. >70 Gy si riferisce alla dose al fegato normale perfuso in pazienti con una riserva epatica (HR) maggiore del 30%;
- la soglia di <30 Gy si applica specificamente ai pazienti pretrattati o a quelli con funzionalità epatica compromessa;
- per HCC e ICC, il raggiungimento di ≥100–120 Gy è associato a risultati migliorati. Per le metastasi da cancro colorettale (mCRC), dosi al tumore superiori a 100 Gy sono state associate a tassi più elevati di risposta metabolica completa, sebbene una soglia inferiore (>40–60 Gy) predica una risposta parziale.
Microsfere di vetro (90Y)
Il calcolo della dose assorbita per un dato compartimento si basa sulla formula MIRD (Medical Internal Radiation Dose) semplificata:
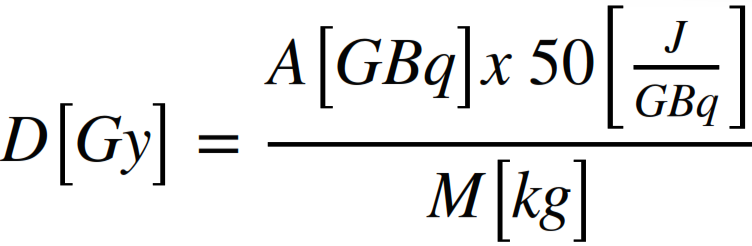
dove A è l’attività nel compartimento e M la sua massa.
La dose al polmone si calcola specificamente come:
DPolmone(Gy) = Attività Iniettata (GBq) × Frazione Shunt Polmonare × 50
Raccomandazioni dosimetriche per microsfere di vetro con 90Y
| Scenario Clinico | Approccio a scomparto singolo (dose al volume perfuso) (Gy) | Approccio a scomparti multipli (dose al fegato normale) (Gy) | Approccio a scomparti multipli (dose al tumore) (Gy) |
|---|---|---|---|
| HCC Segmentectomia | >400 | Non applicabile | |
| HCC Lobectomia | >150 se dose al fegato intero <150; 140–150 | ≥88; <75 (range: 50/90) | ≥205; ≥250–300 |
| HCC Unilobare | >150 se dose al fegato intero <150; 80–150 | <120 se HR <30%; <75 (range: 50/90) | ≥205; ≥250–300 |
| HCC Bilobare | 80–150 | <50/90 | ≥205 |
| ICC Segmentectomia | >400 | Non applicabile | |
| ICC Lobectomia | 140–150 | <75 (range: 50/90) | ≥260 |
| ICC Unilobare | 80–150 | <75 (range: 50/90) | ≥260 |
| ICC Bilobare | 80–150 | <75 (range: 50/90) | ≥260 |
| mCRC Segmentectomia | >400 | Non applicabile | |
| mCRC Lobectomia | 140–150 | <75 (range: 50/90) | ≥189 |
| mCRC Unilobare | 80–150 | <75 (range: 50/90) | ≥189 |
| mCRC Bilobare | 80–150 | <75 (range: 50/90) | ≥189 |
Microsfere di Olmio (166Ho)
Il calcolo dell’attività si basa su un approccio simile al MIRD, utilizzando un fattore di conversione specifico per l’Olmio-166. La formula è:
A (GBq) = ( Dose Desiderata (Gy) × Mtarget (kg) ) / 15.87
L’obiettivo standard è una dose media di 60 Gy al fegato totale, ma la dosimetria multi-compartimento è consigliata per ottimizzare la dose al tumore.
Raccomandazioni dosimetriche per microsfere con 166Ho
| Scenario clinico | Dose al fegato sano totale | Dose al tumore |
|---|---|---|
| Segmentectomia | Non applicabile | Non disponibile |
| Lobectomia | < 60 Gy | > 90-150 Gy (a seconda dell’istologia) |
| Malattia Unilobare | < 60 Gy | > 90-150 Gy (a seconda dell’istologia) |
| Malattia Bilobare | < 40 Gy (fino a 60 Gy in pz. selezionati) | > 90-150 Gy (a seconda dell’istologia) |
Una volta calcolata e preparata l’attività, si procede alla fase di somministrazione, che presenta peculiarità tecniche a seconda del prodotto utilizzato.
Procedura di somministrazione
La tecnica di somministrazione delle microsfere è un momento critico della procedura, mirato a garantire una distribuzione ottimale e sicura dell’agente radioattivo, minimizzando il rischio di reflusso e di embolizzazione in sedi non target. Le modalità variano in base al tipo di particelle impiegate.
Microsfere di resina (90Y)
Dato il numero elevato di particelle (40-80 milioni) e il conseguente effetto embolico moderato, la somministrazione richiede particolare cautela:
- il catetere deve essere posizionato in posizione distale, ad almeno 3-4 cm dall’origine dell’arteria gastroduodenale, per prevenire il reflusso;
- l’infusione deve essere lenta, a una velocità non superiore a 5 ml/min;
- è preferibile utilizzare una soluzione glucosata al 5% come veicolo, poiché riduce la stasi e il disagio per il paziente;
- è mandatorio un controllo fluoroscopico continuo per monitorare il flusso e la posizione del catetere.
Microsfere di vetro (90Y)
Il basso numero di particelle (1.2-8 milioni) non satura il letto vascolare, rendendo la procedura più rapida e meno dipendente dal controllo visivo diretto:
- il tempo di infusione è breve, richiedendo tipicamente 20-60 ml di soluzione e circa 5 minuti per essere completato;
- il controllo fluoroscopico continuo non è necessario, data la minima probabilità di reflusso legato alla stasi del flusso.
Microsfere di Olmio (166Ho)
La procedura di somministrazione è simile a quella delle microsfere di resina, data la natura embolica delle particelle:
- il posizionamento del catetere deve essere distale;
- l’infusione deve essere lenta, a una velocità ≤5 ml/min;
- come veicolo si utilizza soluzione salina standard.
Al termine della procedura, l’imaging post-trattamento è essenziale per verificare l’esito tecnico e dosimetrico dell’intervento.
Now loading…
Imaging post-trattamento
L’imaging post-trattamento è una fase fondamentale del protocollo, con il triplice obiettivo di: confermare la corretta deposizione delle microsfere nel target tumorale, escludere concentrazioni anomale in sedi extraepatiche e consentire una dosimetria a posteriori per correlare la dose effettivamente erogata con la risposta clinica.
Per microsfere con 90Y
Now loading…
L’imaging dell’Ittrio-90 si basa sulla rilevazione di radiazioni secondarie:
- PET/CT: sfrutta la rara emissione di positroni (circa 32 per milione di decadimenti). Nonostante il basso segnale, la moderna tecnologia PET/CT, specialmente con tempo di volo (TOF), consente un’imaging quantitativo di alta qualità. Offre una risoluzione spaziale e una capacità di quantificazione superiori rispetto alla SPECT. Per ottenere immagini di buona qualità, si raccomandano tempi di acquisizione di almeno 15 minuti;
- SPECT/CT da Bremsstrahlung: rileva i fotoni di “frenamento” prodotti dall’interazione delle particelle beta con i tessuti. Sebbene sia più accessibile, la qualità dell’immagine e l’accuratezza quantitativa sono inferiori rispetto alla PET/CT.
Per microsfere con 166Ho
L’Olmio-166 permette un imaging multimodale diretto:
- SPECT/CT: la co-emissione di fotoni gamma a 81 keV consente un’acquisizione diretta della distribuzione delle microsfere. L’imaging presenta sfide tecniche, come lo scatter dei fotoni ad alta energia e il rischio di “dead time” del detector a causa dell’elevata attività iniziale. Per questo motivo, l’acquisizione è generalmente raccomandata tra 2 e 5 giorni dopo il trattamento;
- RMN: l’Olmio-166 possiede proprietà paramagnetiche che ne consentono la visualizzazione e la quantificazione tramite Risonanza Magnetica. I vantaggi includono un’alta risoluzione spaziale e l’assenza di radiazioni ionizzanti. Tuttavia, la presenza di artefatti da suscettibilità magnetica può limitarne l’applicazione in prossimità di aria o clip metalliche.
Oltre agli aspetti tecnici, il successo di un programma di radioembolizzazione dipende strettamente dai requisiti organizzativi e dalla competenza del personale.
Requisiti della struttura e del personale
Il successo e la sicurezza di un programma di radioembolizzazione non dipendono solo dalla tecnologia, ma anche da una struttura adeguata e, soprattutto, da un team interdisciplinare affiatato e competente.
I requisiti strutturali includono la disponibilità di:
- locali di degenza in isolamento, se richiesti dalla normativa nazionale, dotati di schermature e servizi igienici dedicati;
- procedure standardizzate per la gestione dei rifiuti radioattivi e per la decontaminazione in caso di spandimenti;
- attrezzature di monitoraggio e sicurezza per il personale.
L’elemento chiave è la presenza di un team interdisciplinare dedicato, la cui composizione è cruciale per la gestione ottimale del paziente in ogni fase del percorso. Il team dovrebbe includere:
- radiologo interventista;
- oncologo medico;
- radioterapista oncologo;
- chirurgo oncologo/trapiantologo;
- medico nucleare;
- epatologo;
- fisico medico;
- esperto in radioprotezione.
La stretta collaborazione tra queste figure garantisce una corretta selezione del paziente, una pianificazione accurata e una gestione sicura del trattamento, inclusa la radioprotezione del personale.
Caricamento….
Esposizione del personale
La gestione dell’esposizione professionale a radiazioni ionizzanti è un elemento chiave della sicurezza del programma di radioembolizzazione. Le dosi ricevute dal personale variano significativamente in base al tipo di microsfere e alle fasi della procedura (preparazione vs. iniezione):
- microsfere con 90Y: esiste una notevole differenza tra i due tipi di microsfere, principalmente a causa delle diverse procedure di preparazione:
- microsfere di vetro: l’esposizione equivalente alle dita è relativamente bassa, dell’ordine di 14.0 ± 7.9 μSv/GBq per l’operatore che esegue l’iniezione;
- microsfere di resina: la necessità di aliquotare la dose comporta una manipolazione maggiore e, di conseguenza, un’esposizione alle dita significativamente più alta, pari a 235.5 ± 156 μSv/GBq per l’operatore.
- bicrosfere con 166Ho: la preparazione e l’iniezione comportano un’esposizione alle dita dell’ordine di 2.9 ± 0.2 × 10³ μSv/GBq.
È importante sottolineare un’avvertenza cruciale: i dosimetri ad anello hanno una sensibilità limitata alle emissioni beta pure (come quelle del 90Y) e possono quindi sottostimare severamente le dosi effettive assorbite dalla cute delle dita.
La sicurezza dello staff è un prerequisito fondamentale, così come lo è una corretta informazione e gestione della sicurezza del paziente.
Informazione e istruzioni per il paziente
Una comunicazione chiara, completa e trasparente con il paziente non è solo un dovere etico e medico-legale, ma anche un requisito fondamentale per ottenere un consenso realmente informato e la massima collaborazione durante tutto il percorso terapeutico.
I punti chiave da comunicare al paziente, sia verbalmente che tramite materiale scritto, includono:
- una spiegazione dettagliata della procedura, dei suoi obiettivi e delle varie fasi;
- la natura generalmente palliativa del trattamento, salvo casi altamente selezionati (es. segmentectomia) in cui si può mirare a un intento curativo;
- i potenziali effetti collaterali, sia comuni che rari ma gravi, e la loro gestione;
- le opzioni terapeutiche alternative disponibili;
- istruzioni scritte chiare sulle norme di radioprotezione da adottare dopo la dimissione per ridurre l’esposizione non necessaria a familiari, conviventi e al pubblico.
Queste istruzioni sono parte integrante delle norme di radioprotezione specifiche per il paziente.
Norme di radioprotezione
Dopo la somministrazione delle microsfere, il paziente diventa una sorgente di radiazioni e devono essere adottate specifiche misure di radioprotezione, sebbene il rischio esterno, specialmente con 90Y, sia generalmente basso.
Le principali raccomandazioni includono:
- in caso di emergenze mediche post-trattamento, la preoccupazione per l’esposizione a radiazioni non deve mai interferire con o ritardare le cure necessarie al paziente;
- il rateo di dose esterno al paziente deve essere monitorato secondo le normative locali;
- è fortemente raccomandato di evitare gravidanze per almeno 4 mesi dopo il trattamento;
- è opportuno considerare la presenza di impurità radioisotopiche a lunga emivita, che possono avere implicazioni per la gestione dei rifiuti a lungo termine, ma non rappresentano un rischio per eventuali successive biopsie o interventi chirurgici.
La gestione del rischio radiologico si affianca alla gestione degli effetti collaterali clinici, che devono essere attentamente monitorati.
Effetti collaterali
Now loading…
Il profilo di tossicità della radioembolizzazione è generalmente gestibile. La maggior parte degli effetti collaterali è di grado lieve-moderato e autolimitante, manifestandosi come una “sindrome post-embolizzazione”.
- Effetti collaterali comuni (>10% di incidenza):
- affaticamento (fatigue);
- dolore addominale;
- nausea;
- febbre e/o brividi;
- alterazioni transitorie degli enzimi epatici;
- linfopenia transitoria;
- possibili eventi avversi gravi (<5%):
- malattia epatica indotta da radioembolizzazione (REILD): è la tossicità più temuta, caratterizzata da iperbilirubinemia, ipoalbuminemia e ascite, che si manifesta tipicamente 2-6 mesi dopo il trattamento in assenza di progressione di malattia;
- irradiazione non-target: conseguenza di un reflusso o di uno shunt non identificato di microsfere nel tratto gastrointestinale, può causare gastrite da radiazioni, ulcere, pancreatite o, più raramente, polmonite da radiazioni.
In caso di risposta iniziale seguita da progressione della malattia, in pazienti selezionati può essere considerato un secondo trattamento.
Trattamento ripetuto
Il ritrattamento con radioembolizzazione è un’opzione praticabile in pazienti selezionati, in particolare coloro che hanno beneficiato di una risposta positiva alla prima procedura ma che successivamente mostrano una progressione della malattia.
La letteratura scientifica disponibile, sebbene basata su studi con campioni spesso limitati ed eterogenei, suggerisce che il ritrattamento è fattibile e presenta un profilo di tossicità accettabile.
Tuttavia, è necessaria la massima cautela. La decisione di procedere con un secondo trattamento deve seguire le stesse indicazioni e controindicazioni della prima procedura, con un’attenzione ancora maggiore alla funzionalità epatica residua. È di fondamentale importanza valutare sempre le dosi cumulative assorbite dal tessuto epatico non tumorale per minimizzare il rischio di tossicità cronica.
Dopo il trattamento, inizia la fase di monitoraggio a lungo termine del paziente.
Follow-up
Il programma di follow-up post-radioembolizzazione ha il duplice obiettivo di monitorare l’insorgenza di tossicità e di valutare la risposta al trattamento, utilizzando tempistiche e criteri di imaging standardizzati e appropriati per l’istologia tumorale.
Caricamento….
- Monitoraggio clinico e di laboratorio: i primi controlli clinici e degli esami ematochimici (in particolare la funzionalità epatica) dovrebbero essere programmati a distanza di 2-4 settimane dalla procedura;
- imaging radiologico: la prima valutazione della risposta tramite imaging cross-sezionale (TC o RMN) è raccomandata a 3 mesi dalla procedura. Tempi più lunghi possono essere necessari per apprezzare la massima risposta;
- criteri di risposta: la scelta dei criteri di valutazione è cruciale e dipende dall’istologia del tumore:
- epatocarcinoma (HCC) e colangiocarcinoma intraepatico (ICC): i criteri puramente dimensionali (come RECIST) sono poco adeguati, poiché non tengono conto della necrosi indotta dal trattamento. Sono nettamente superiori i criteri basati sulla valutazione della vitalità tumorale (la porzione che ancora capta mezzo di contrasto), come mRECIST o EASL, che hanno dimostrato una migliore correlazione con la sopravvivenza;
- metastasi da cancro del colon-retto (mCRC): in questo contesto, i criteri RECIST mantengono la loro validità e correlano con la sopravvivenza globale, a differenza di mRECIST. La FDG-PET può offrire una valutazione più precoce e accurata della risposta metabolica.
I costanti progressi in questo campo aprono la strada a nuove sfide e direzioni per la ricerca futura.
Direzioni future
Nonostante i significativi progressi che hanno consolidato il ruolo della radioembolizzazione nel trattamento dei tumori epatici, la metodica continua a evolversi. La ricerca futura è chiamata ad affrontare sfide importanti per ottimizzarne ulteriormente l’efficacia e la personalizzazione.
Le principali sfide identificate includono:
- definire e validare in modo prospettico soglie di dose assorbita che siano predittive di efficacia (dose tumoricida) e di sicurezza (dose massima tollerata dal fegato sano) per i diversi scenari clinici e per le diverse istologie tumorali;
- valutare l’efficacia clinica della radioembolizzazione pianificata con dosimetria multi-compartimentale all’interno di studi clinici randomizzati e controllati, confrontandola o combinandola con gli attuali standard di cura (terapie sistemiche, immunoterapia) per definire il suo posizionamento ottimale negli algoritmi terapeutici.
Fonte: Weber, M., Lam, M., Chiesa, C. et al. EANM procedure guideline for the treatment of liver cancer and liver metastases with intra-arterial radioactive compounds. Eur J Nucl Med Mol Imaging 49, 1682–1699 (2022). https://doi.org/10.1007/s00259-021-05600-z https://rdcu.be/eTlt4