ESERCITAZIONE: Acidimetria e Alcalimetria
OGGETTO: Preparazione e standardizzazione dell’Acido Cloridrico con titolazione Acido Forte – Base Forte utilizzando diversi indicatori.

REAZIONE:
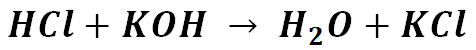
FORMULE:
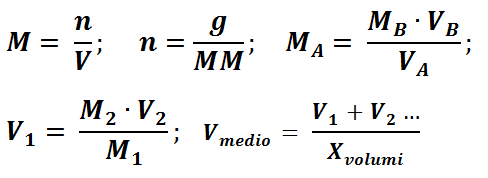
LEGENDA:
g: grammi;
MM: Massa Molecolare;
V: Volume (in Litri);
n: Moli;
M: Molarità.
CALCOLI e RISULTATI:
PREPARAZIONE:
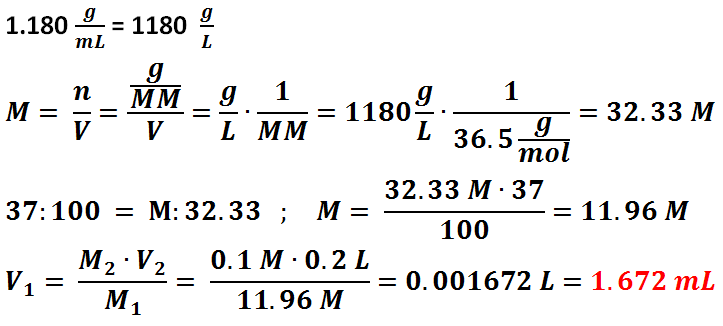
STANDARDIZZAZIONE:
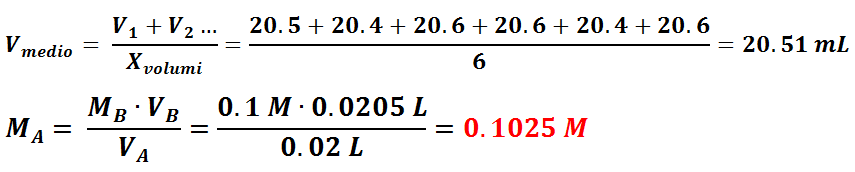
STRUMENTI E APPARECCHI:
- Matraccio da 200 mL;
- Spruzzetta con acqua distillata;
- Buretta da 50 mL;
- Cappa di sicurezza chimica;
- Soluzione di HCl 37% 1.18 g/mL;
- Soluzione di KOH 0.1 N;
- Pipetta graduata con propipetta;
- Pipetta tarata con propipetta;
- Beuta;
- Soluzione Blu di bromotimolo;
- Soluzione di Metilarancio;
- Soluzione di Fenolftaleina.
RELAZIONE:
CONOSCENZE TEORICHE:
Caricamento….
Le titolazioni acido-base sono delle titolazioni utili a verificare la concentrazione ignota di un acido o di una base mediante la reazione di neutralizzazione che porta alla formazione di un sale più l’acqua. Il monitoraggio dell’andamento della titolazione può avvenire tramite una costante misura del pH attraverso un pHmetro, oppure tramite l’utilizzo di un indicatore il cui pH di viraggio sia nella regione del punto di equivalenza. Nelle titolazioni tra acidi forti e basi forti, il valore del pH inizialmente varia molto lentamente, per poi avere un grande salto al punto di equivalenza (pH 7).
Gli indicatori acido-base sono delle sostanze aventi la caratteristica di cambiare colore quando cedono o acquistano un protone. La percezione visiva del colore di un indicatore avviene a concentrazioni molto basse, per cui l’aggiunta di poche gocce di una sua soluzione diluita è in grado di colorare nettamente la soluzione da titolare. Il cambiamento di colore di un indicatore è detto viraggio, per cui il valore di pH corrispondente al punto di equivalenza è detto punto di viraggio anche se è preferibile associare ad ogni indicatore un intervallo di viraggio.

Il metilarancio ha un pH di viraggio 3.1-4.4; in ambiente acido ha un colore rosso, mentre in quello basico giallo.
Il blu bromotimolo ha pH di viraggio 6.2-7.6; in forma acida ha un colore giallo, mentre in forma basica è blu.
La fenolftaleina ha pH di viraggio 8.2-9.6; non assume un colore quando è acido, diventa rosso-violetto quando è basico.
L’acido cloridrico è un acido minerale forte che si ionizza completamente in soluzione acquosa. Esso è uno dei liquidi più corrosivi esistenti, una sua soluzione 1 M in acqua ha un pH uguale a 0. La concentrazione massima ottenibile in acqua va dal 36 al 38%. Condizione nella quale dalla soluzione si sprigionano vapori di acido, questo perché in realtà l’acido cloridrico è una sostanza gassosa che si scioglie facilmente in acqua. Tutte le operazioni con l’acido cloridrico concentrato vanno eseguite sotto cappa per via della sua tossicità.
DESCRIZIONE DELLA PROVA:
Lo scopo della prova è di preparare e standardizzare l’acido cloridrico con una titolazione acido-base.

L’acido cloridrico non ha caratteristiche di una sostanza madre quindi bisogna prima preparare una soluzione a titolo approssimato e successivamente eseguire una standardizzazione. Nel nostro caso bisogna preparare 200 mL di Acido Cloridrico 0.1 N partendo da una soluzione di acido cloridrico concentrato al 37% con densità 1.18 g/mL.
Come si può vedere nei calcoli, bisogna prima di tutto calcolarsi la concentrazione molare basandosi sulla densità dell’acido, poi bisogna fare la proporzione perché il nostro acido è concentrato al 37%. Infine si calcolano i mL di volume di acido concentrato da prelevare per formare una soluzione di 200 mL 0.1 N utilizzando l’equazione della conservazione delle moli. Come si può vedere nei calcoli, i mL da prelevare sono 1.672.
Dopo i calcoli si riempie 1/3 di matraccio con dell’acqua distillata e si preleva l’acido cloridrico con la pipetta graduata. Si inserisce prima l’acqua perché l’acido cloridrico, come l’acido solforico, dà luogo a reazioni esotermiche e quindi bisogna agire con molta attenzione.
Le operazioni di prelievo di acido cloridrico vanno eseguite sotto cappa perché quando si apre il boccione si liberano dei vapori di acido cloridrico gassoso che è altamente tossico. Dopo aver prelevato e messo nel matraccio 1,7 mL di HCl si agita bene per far sciogliere e successivamente si porta a volume il matraccio aggiungendo altra acqua.
Si avvina e azzera la buretta con l’idrossido di potassio (KOH) e si inizia la standardizzazione. Si mettono nella beuta circa 20-30 ml di acqua distillata (ad occhio), 20 mL di HCl usando la pipetta tarata e 2-3 gocce di uno dei tre indicatori. Se si utilizza blu di bromotimolo, la soluzione avrà un colore iniziale giallino in ambiente acido, per poi diventare blu quando l’ambiente è alcalino.
Se si utilizza metilarancio, la soluzione è inizialmente rosa per poi diventare giallo. Se si usa la fenolftaleina, la soluzione inizialmente non ha colore, poi diventa viola.

Come in tutte le titolazioni, dopo aver inserito l’indicatore, si fa scendere goccia dopo goccia il titolante fino a che la soluzione non cambia colore. Nel caso si utilizzi il blu di bromo timolo, la titolazione si interrompe quando la soluzione diventa di colore verdino; se si utilizza il metilarancio, il colore della soluzione deve essere arancio chiaro; per la fenolftaleina, la soluzione si deve colorare di rosa.
La standardizzazione si ripete più volte usando indicatori diversi. Dei valori di volume ottenuti si fa una media, scartando ovviamente i valori lontani dal margine medio. Nel nostro caso il volume medio di titolante utilizzato è stato di 20.51 mL. Conoscendo il volume ed il titolo della base e il volume dell’acido ci si può ricavare il titolo noto dell’acido. Dai calcoli si può vedere che la nostra soluzione di acido cloridrico aveva una concentrazione di 0.1 N.
Nel caso di titolazioni degli acidi forti con basi forti, tutti e tre gli indicatori sono adatti. Questo perché il punto di equivalenza rientra nell’intervallo di Viraggio di ciascuno di essi dovuto all’improvviso aumento del pH corrispondente al punto di equivalenza. Grazie alle curve di titolazione si può capire che qualsiasi indicatore con un viraggio compreso tra 4 e 10 (pH) potrebbe essere utilizzato per le titolazioni acido forte/base forte. Per altre titolazioni acido/base in cui si ha curve di titolazione differenti, la scelta dell’indicatore deve essere fatta in modo tale che il viraggio avvenga esattamente al pH della soluzione al punto equivalente. Dato che il punto equivalente lo si ha quasi sempre ad un pH neutro (7), l’indicatore più usato è il blu di bromotimolo.













