TITOLO: Colorazione di Gram
OBIETTIVO: Colorazione di gram di un ceppo di fermenti lattici e osservazione microscopica.
STRUMENTI:
- Bunsen, Microscopio Ottico;
MATERIALI BIOLOGICI:
- Piastra Petri PCA con Fermenti lattici;
VETRERIA:
- Vetrino portaoggetti, Ansa monouso sterile, Vaschetta per colorazione, Pinze in legno;
MATERIALI CHIMICI:
- Olio per immersione, Spruzzetta con H2O, Kit per la colorazione di gram (Cristal Violetto, Liquido di Lugol, Decolorante, Safranina);
DPI DA UTILIZZARE:
- Camice, Guanti in lattice;
Caricamento….
RELAZIONE:
PROCEDIMENTO:

Credit: Raffaele Cocomazzi (www.bmscience.net)
La prova consiste nel colorare un ceppo batterico tramite la colorazione di gram per poi poterlo osservare al microscopio ottico con l’obiettivo ad immersione. Per colorare e il preparato a secco bisogna:
- Prelevare con un’ansa sterile una colonia batterica da una piastra precedentemente seminata e distribuire l’inoculo su un vetrino portaoggetti dove è stata posizionata una goccia di acqua distillata;
- Si stempera bene l’inoculo all’interno della goccia e sulla parte centrale del vetrino in modo da distribuire bene le singole cellule;
- Si lascia asciugare il vetrino aiutandosi con il bunsen e con una pinza in legno fino a quando non evapora tutta l’acqua. Il calore della fiamma farà sì che il campione si fissi sul vetrino;
- Dopo la fissazione si pone il vetrino sulla vaschetta in modo tale che esso rimanga in posizione orizzontale;
- Si aggiunge il primo colorante sul vetrino e lo si lascia agire per un minuto. Il primo colorante è il cristal violetto che colora di viola;
- Dopo un minuto si elimina l’eccesso di cristal violetto con una spruzzetta con acqua distillata e si aggiunge il liquido di Lugol (soluzione iodo-iodurata) per un minuto che ha la funzione mordenzante di fissare il cristal violetto ai componenti cellulari acidi e colora tutte le cellule;
- La fase successiva è la decolorazione che consiste nell’aggiunta di una miscela 50% alcool e 50% acido acetico. Essa la si lascia applicare per 30-60 secondi fino a che il preparato non lascia più il colore. Il decolorante decolora solo i batteri Gram-, mentre i Gram+ resistono all’azione del solvente e rimangono viola. Questo comportamento è dovuto al differente spessore dello strato di peptidoglicano;

Credit: Raffaele Cocomazzi (www.bmscience.net)
- Dopo la decolorazione si risciacqua il vetrino con l’acqua distillata e si aggiunge il secondo colorante lasciandolo agire per un minuto. Il secondo colorante è la safranina che si lega ai componenti acidi dei Gram- e li colora in rosso o fucsia, mentre non si possono legare ai Gram+ perché ormai sono impegnati nel legame con il complesso cristal violetto-iodio che restano viola;
- Ancora una volta si sciacqua il vetrino con H2O per eliminare l’eccesso di safranina e si porta ad asciugare sul bunsen.
Al termine di queste operazioni si avrà il preparato a fresco pronto per essere osservato al microscopio:
- Si inizia l’osservazione con l’obiettivo 40x in modo da individuare cellule batteriche separate e non quelle ammassate;
- Una volta scelto il punto migliore, si abbassa il tavolino portaoggetti e si inserisce una goccia di olio per immersione nel punto desiderato e si passa all’osservazione con l’obiettivo 100x;
- Si fa una distinzione dei tipi di batteri osservati se sono gram+, gram-, bacilli o cocchi.
POSSIBILI ERRORI:

L’identificazione batterica è una procedura molto delicata e gli errori da valutare possono essere tanti. Un errore possibile può avvenire durante la fase di decolorazione che è una fase critica perché un eccessiva durata fa sì che i Gram+ appaiano come Gram-, mentre una decolorazione ridotta non permette l’estrazione completa del complesso cristal violetto-iodio e fa apparire i Gram- come Gram+; inoltre vanno utilizzate colture fresche di 24 ore circa poiché le cellule vecchie, soprattutto quelle dei Gram+, tendono a perdere la capacità di trattenere il primo colorante per cui nello striscio si possono osservare reazioni variabili con alcune cellule colorate in viola e altre in rosso. Tuttavia l’errore più facile da commettere è quello di contaminare il vetrino. La contaminazione può avvenire anche nei passaggi precedenti, durante la semina della coltura.
OSSERVAZIONI:
I batteri che ci dovremmo aspettare dall’osservazione dovrebbero essere tutti lactobacilli gram+ perché nella coltura in piastra sono stati inseriti i seguenti batteri: Lactobacillus rhamnosus, Lactobacillus paracasei, Lactobacillus acidophilus e Bifidobacterium bifidum.
Dalle osservazioni microscopiche si può capire di come il vetrino sia stato contaminato infatti sono presenti diverse specie:
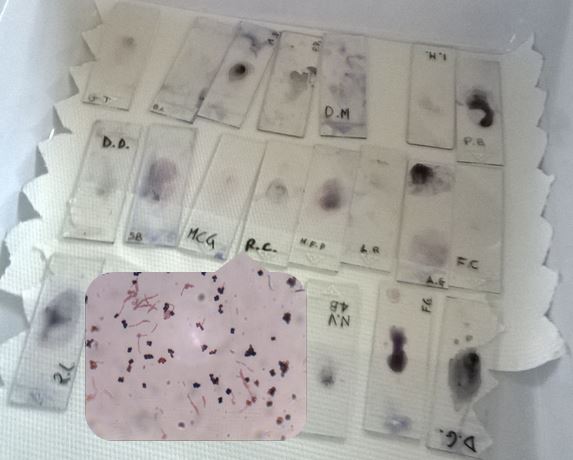
Credit: Raffaele Cocomazzi (www.bmscience.net)
CONCLUSIONI:
Dalla colorazione e dall’osservazione microscopica si può comprendere uno degli ultimi passaggi dell’identificazione batterica, quella che consente di colorare e osservare la forme e la disposizione delle cellule oltre che di classificare i batteri in Gram- e Gram+. La prova di per sé non è complessa, ma bisogna fare molta attenzione nell’eseguire i vari passaggi per evitare la contaminazione come è avvenuta nel mio caso.










