OBIETTIVI:
- Preparazione del terreno di coltura PCA (Plate Count Agar).
- Semina e conta in piastra per spatolamento di fermenti lattici.
CALCOLI e RISULTATI:
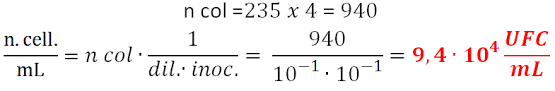
| STRUMENTI: | |
| Bilancia Tecnica; Piastra riscaldante con agitatore magnetico; | Autoclave; Frigorifero; Termostato; |
| MATERIALI BIOLOGICI: | |
PCA: Plate Count Agar; | Capsula con fermenti lattici; |
| VETRERIA: | |
|
Beuta da 500 mL; | Bacchettina di vetro; Spatola d’acciaio; Cotone idrofilo e garza (15x15cm); Becherino da 100 mL; Piastra petri; Bacchette recupera magnete; Provette con porta provette; Pipetta monouso graduata (1 mL); |
| MATERIALI CHIMICI: | |
|
H2O distillata; | Soluzione fisiologica al 0,9%; |
| DPI DA UTILIZZARE: | |
|
Camice; | Guantoni isolanti; |
| RISCHI: | |
| Inalazione di sostanza chimiche; |
Scottature al fornello elettrico; |
PROCEDIMENTO:
Per preparare il terreno di coltura PCA, sono richieste diverse operazioni:
- Si leggono attentamente le indicazioni riportate sulle confezioni (quantità da pesare, temperatura e modalità di sterilizzazione e scioglimento). Nel nostro terreno le indicazioni sono di 23,5 g in 1 L.
- Si risale alla quantità di polvere da pesare facendo le giuste proporzioni. Sapendo che per ogni piastra si utilizzano 20 mL, si dovranno preparare 460 mL per ottenere 23 piastre. I 460 mL dovranno essere preparati inoltre da 4 gruppi, quindi 115 mL a testa. Seguendo la proporzione nei calcoli, ogni gruppo deve prelevare 2,7 g di PCA.
- Dopo aver effettuato i giusti calcoli, si prepara il materiale occorrente (elencato già precedentemente).
- Si preleva la quantità calcolata di terreno disidratato utilizzando una spatola d’acciaio, un vetrino d’orologio e la bilancia tecnica. Durante questo procedimento bisogna agire con cautela perché si stanno manipolando sostanze chimiche molto leggere e soprattutto si possono alterare i risultati della bilancia.
- Si preleva con un cilindro graduato la giusta quantità di acqua distillata (115 mL).
- Si versa parte dell’acqua prelevata nella beuta e poi si inserisce il terreno disidratato all’interno per agevolare lo scioglimento. Adesso si versa la restante acqua cercando di raccogliere i residui di terreno aderiti alle pareti del vetrino d’orologio e alla spatola.
- Si inserisce il magnete nella beuta e la si porta a riscaldare a 200 °C con agitazione a 3 fino a quando la soluzione non diventa limpida. Si copre la beuta con il vetrino d’orologio per evitare l’evaporazione e quindi disidratazione del terreno.
- Nel frattempo si prepara un tappo utilizzando cotone idrofilo e una garza 15×15 cm.
- Quando la soluzione diventa limpida, si toglie il magnete usando le bacchette magnetiche e si ricopre la beuta con il tappo, in modo tale che gli spigoli della garza siano esterni al collo della beuta per non far cadere il tappo all’interno. Poi si ricopre il tappo con la carta stagnola.
- Dopo aver “sigillato” la beuta, la si inserisce in autoclave a 121 °C per 15 minuti per sterilizzare il terreno.
- Al termine della sterilizzazione, si distribuisce il terreno nelle varie piastre, ma prima di versare si passa velocemente l’imboccatura della beuta sul becco bunsen per evitare contaminazione. Nella piastra bisogna versare 4-5 mm di terreno spostando leggermente il coperchio e facendo raffreddare il terreno vicino ad un bunsen acceso (l’ideale sarebbe utilizzare una cappa con lampada U.V accesa).
- Quando il terreno si è solidificato, si chiude la piastra e la si conserva in frigorifero capovolta in pile da massimo 5 piastre avvolte in carta stagnola, oppure in fila da 3.
Il terreno è quindi pronto per essere utilizzato. Prima di eseguire la prova vanno preparate le provette con le varie diluizioni in modo tale da poter ridurre le concentrazioni delle cellule ed ottenere delle piastre in cui le colonie siano contabili. Quindi:
Caricamento…
- Si inserisce in una provetta tutto il contenuto della capsula di fermenti lattici e si aggiungono 9 mL di soluzione fisiologica perché bisogna rendere liquidi i campioni solidi.
- Si allestisce una serie di provette per le diluizioni 10-1, 10-2 e 10-3. Si inseriscono 9 mL di diluente utilizzando una pipetta monouso graduata (10 mL) in ciascuna delle provette.
- Con una pipetta monouso graduata (1 mL) si preleva 1 mL di campione e lo si versa nella prima provetta con diluizione 10-1, si agita bene e si preleva dalla provetta 10-1 1 mL di campione e lo si versa nella provetta 10-2. Si mescola bene il contenuto della provetta e si effettua lo stesso procedimento con la provetta con diluizione 10-3.
- Dopo aver effettuato la diluizione, si preleva 0,1 mL di campione dalla diluizione prestabilita (nel mio caso dalla diluizione 10-1) e la si versa al centro della piastra.
- Con molta cautela si spatola e distribuisce la goccia di campione su tutta la superficie del terreno in modo da non ottenere colonie sovrapposte che potrebbero alterare i risultati.
- Si inserisce la piastra nel termostato a 37 °C per 24 h per far avvenire la crescita.
- Al termine delle 24 h d’incubazione, la piastra va rimossa dal termostato, quindi si procede alla conta microbica oppure la si conserva in frigorifero.
- Per contare le piastre con colonie numerose, si può dividere la piastra in 4 settori e si moltiplica per 4 il numero delle colonie presenti in un quadrante.
- Le colonie vanno contate e segnate con un pennarello sul fondo della piastra in modo da evitare di ricontare più volte la stessa colonia. Nel mio caso, il numero di colonie era molto elevato quindi è stato necessario dividere in quadranti.
- Dopo aver contato, i risultati si riferiscono al numero di colonie presenti in piastra, ma non a quelle del campione iniziale. Infatti bisogna moltiplicare questo valore per l’inverso della diluizione effettuata e dell’inoculo che corrisponde a 0,1 mL e si calcola il numero microbico in UFC/mL (Unità Formanti Colonie) perché una colonia può essere originata, oltre che da singole cellule, anche da aggregati di cellule che non si sono separate.
OSSERVAZIONI:
Il risultato ottenuto di 940 colonie rilevate, vuol dire che la diluizione utilizzata non era idonea, e bisognava procedere con diluizioni successive perché le colonie dovrebbero essere comprese tra 30 e 300 per avere una migliore accuratezza. Questo perché la conta di colonie al di sopra di 300, oltre ad essere difficile da eseguire, è poco attendibile per il sovraffollamento dei microrganismi e l’insufficienza dei nutrienti.
CONCLUSIONI:
Lo scopo della prova era quello di seminare e contare una piastra tramite la tecnica per spatolamento, una tecnica che è molto efficace nella determinazione del numero di cellule presenti in una carica microbica, ma che di per se richiede molta concentrazione e precisione nell’esecuzione.