La sepsi e lo shock settico costituiscono emergenze mediche di primaria importanza, caratterizzate da un’elevata mortalità e dalla necessità di un intervento tempestivo e mirato. Le linee guida della Surviving Sepsis Campaign (2021) hanno consolidato le definizioni di queste sindromi, fornendo un framework essenziale per un approccio diagnostico e terapeutico omogeneo. La gestione efficace di tali condizioni dipende intrinsecamente dalla capacità del clinico di riconoscere precocemente i segni di disfunzione d’organo potenzialmente letale, attivando protocolli di trattamento basati sull’evidenza.
In accordo con tali direttive, la sepsi è definita come una disfunzione d’organo causata da una risposta inappropriata e disregolata dell’organismo a un’infezione. Questa reazione sistemica, anziché essere protettiva, diventa essa stessa la causa del danno tissutale e della compromissione funzionale a carico dei diversi apparati.
Lo shock settico rappresenta l’evoluzione più grave della sepsi, configurandosi come uno stato di profonda disfunzione cardiocircolatoria e cellulare-metabolica, associato ad un rischio di mortalità drasticamente più elevato. I criteri clinici che lo definiscono includono la coesistenza di iperlattatemia (lattati > 2 mmol/L) e un’ipotensione refrattaria al riempimento volemico, tale da richiedere la somministrazione di farmaci vasopressori per mantenere una Pressione Arteriosa Media (PAM) superiore a 65 mmHg.
Per poter applicare correttamente gli strumenti di valutazione prognostica e impostare un’adeguata strategia terapeutica, è imperativo comprendere i meccanismi fisiopatologici sottostanti e le relative manifestazioni cliniche.
Fisiopatologia e manifestazioni cliniche
La comprensione dei meccanismi fisiopatologici dello shock settico è un prerequisito non negoziabile per l’interpretazione dei segni clinici, il monitoraggio della risposta del paziente e la guida della terapia. Al centro del processo vi è un danno d’organo progressivo che, se non interrotto, evolve inesorabilmente verso quadri di insufficienza multipla.
Il danno d’organo viene comunemente descritto con due acronimi:
- Multiple Organ Failure (MOF): un quadro clinico in cui si manifesta un’insufficienza conclamata di almeno due organi;
- Multiple Organ Dysfunction Syndrome (MODS): la presenza concomitante della disfunzione di più di due organi, a un livello tale che l’omeostasi non può essere mantenuta senza un supporto esterno continuo.
Il meccanismo fisiopatologico centrale dello shock settico è di tipo distributivo. La liberazione di endotossine, secondaria all’infezione, innesca una disregolata vasodilatazione a carico del microcircolo. Questa alterazione compromette il flusso ematico e, di conseguenza, il trasporto di ossigeno ai tessuti periferici (cuore, reni, cervello, muscoli). L’ipoperfusione che ne deriva costringe le cellule a passare da un metabolismo aerobio a uno anaerobio, con una conseguente produzione e accumulo di acido lattico. La lattatemia non è solo un marcatore di ipossia tissutale, ma anche un potente indicatore prognostico: livelli più elevati si associano a una prognosi peggiore e a un’aumentata mortalità.
Clinicamente, lo shock settico si manifesta attraverso due fasi distinte:
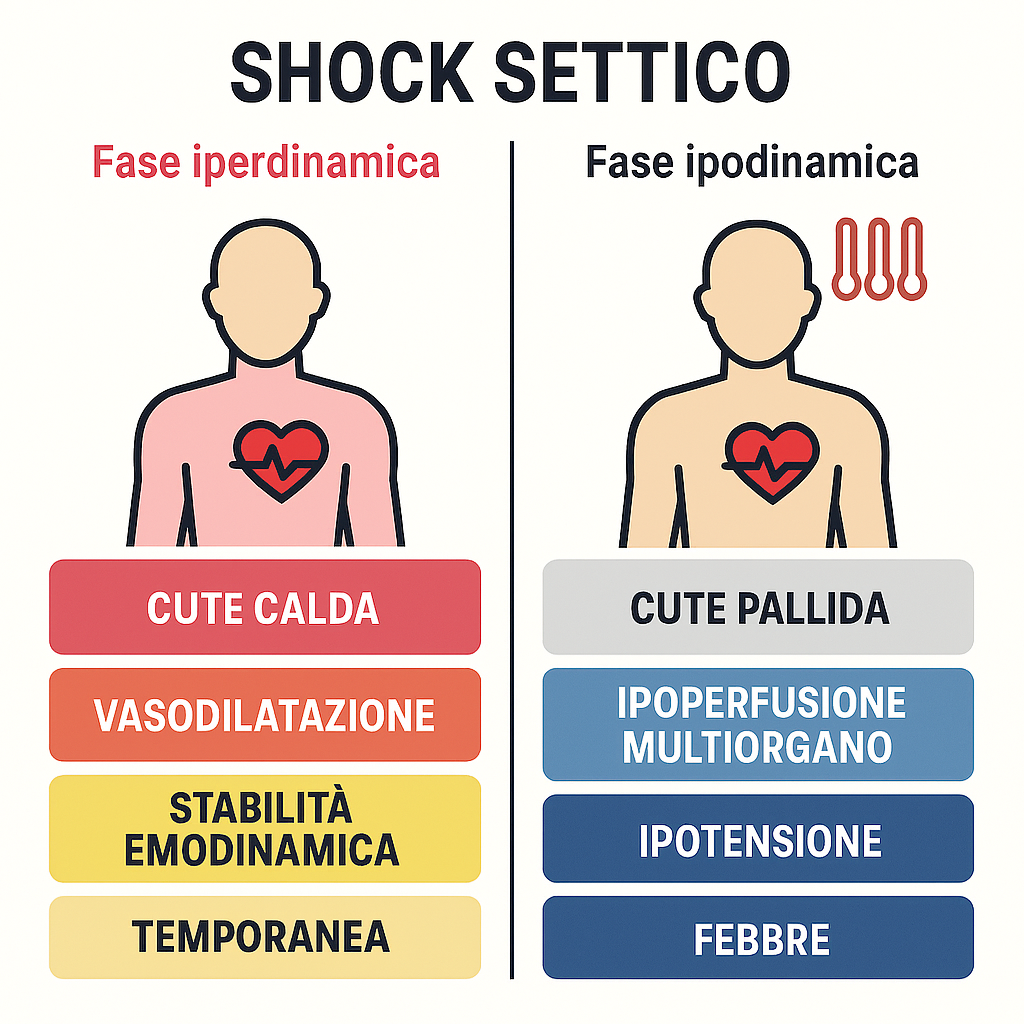
- fase “iperdinamica”: una fase iniziale e transitoria in cui, nonostante la vasodilatazione periferica, il paziente può mantenere una temporanea stabilità emodinamica. La cute si presenta tipicamente calda e rosea;
- fase “ipodinamica”: rappresenta la manifestazione dello shock conclamato. Il paziente è spesso febbrile, con picchi termici elevati, e tachicardico a causa dell’ipovolemia relativa. Questa fase è caratterizzata da una grave insufficienza cardiocircolatoria con ipotensione (PAM < 65 mmHg), cute pallida, insufficienza respiratoria e segni di ipoperfusione multiorgano quali oligo-anuria, aumento dei lattati (> 2 mmol/L) e una diminuzione della ScVO₂ sotto il 70%.
La gravità di queste manifestazioni cliniche impone l’utilizzo di sistemi di punteggio standardizzati per una valutazione oggettiva e riproducibile della condizione del paziente.
Sistemi di punteggio per la sepsi
I sistemi di punteggio rappresentano strumenti clinici essenziali nella gestione del paziente settico. Essi permettono di determinare la gravità della condizione, monitorare l’evoluzione clinica, stratificare il rischio prognostico e supportare le decisioni relative all’intensità di cura, come la necessità di un ricovero in Terapia Intensiva. Tra i più utilizzati vi sono SOFA, qSOFA, MEWS, NEWS e APACHE II.
Sequential Organ Failure Assessment (SOFA) Score
Il SOFA score è un punteggio multifattoriale ampiamente utilizzato in Terapia Intensiva per quantificare la disfunzione d’organo e monitorarne l’andamento nel tempo. La sua forza risiede nella valutazione oggettiva di sei sistemi d’organo chiave:
- respiratorio;
- cardiovascolare;
- neurologico;
- coagulativo;
- renale;
- epatico.
Ad ogni sistema viene assegnato un punteggio da 1 a 4 in base al grado di disfunzione, come dettagliato nella tabella seguente.
| Punteggio SOFA | Respiration PaO2/FiO2 (mmHg) | Coagulation Platelets (10³/mm³) | Liver Bilirubin (mg/dL) | Cardiovascular Hypotension | CNS Glasgow Coma Score | Renal Creatinine (mg/dL) or Urine Output |
|---|---|---|---|---|---|---|
| 1 | < 400 | < 150 | 1.2 – 1.9 | MAP < 70 mmHg | 13 – 14 | 1.2 – 1.9 (110-170) |
| 2 | < 300 | < 100 | 2.0 – 5.9 | Dopamine ≤ 5 or Dobutamine (any dose) | 10 – 12 | 2.0 – 3.4 (171-299) |
| 3 | < 200 (with respiratory support) | < 50 | 6.0 – 11.9 | Dopamine > 5 or Epinephrine ≤ 0.1 or Norepinephrine ≤ 0.1 | 6 – 9 | 3.5 – 4.9 (300-440) or < 500 mL/die |
| 4 | < 100 (with respiratory support) | < 20 | > 12.0 | Dopamine > 15 or Epinephrine > 0.1 or Norepinephrine > 0.1 | < 6 | > 5.0 (>440) or < 200 mL/die |
Quick SOFA (qSOFA) Score
Now loading…
Il qSOFA è stato sviluppato come una versione semplificata del SOFA, da utilizzare al letto del paziente al di fuori della Terapia Intensiva (es. in reparto o Pronto Soccorso) per predire il rischio di setticemia. Un punteggio è considerato positivo se almeno due dei seguenti tre criteri sono soddisfatti:
- frequenza respiratoria ≥ 22 atti/min.
- alterazione dello stato di coscienza.
- pressione arteriosa sistolica ≤ 100 mmHg.
È fondamentale sottolineare che il qSOFA è un test poco sensibile e specifico. Per tale ragione, le linee guida della Surviving Sepsis Campaign del 2021 ne hanno fortemente ridimensionato il ruolo, raccomandando di non utilizzarlo in maniera isolata ma in combinazione con altri score di valutazione più completi.
Altri score rilevanti (MEWS, NEWS, APACHE II)
- MEWS (Modified Early Warning Score) e NEWS (National Early Warning Score): questi due score sono primariamente strumenti di monitoraggio clinico. Il loro scopo principale è supportare il clinico nell’identificazione di un deterioramento e nel processo decisionale relativo all’escalation dell’intensità di cura, ad esempio valutando la necessità di un trasferimento del paziente in Terapia Intensiva.
- APACHE II (Acute Physiology and Chronic Health Evaluation II): a differenza degli altri, l’APACHE II è un punteggio prognostico specifico per i pazienti ricoverati in Rianimazione. Basandosi su parametri clinici e di laboratorio raccolti all’ammissione, è in grado di stimare la mortalità attesa del paziente.
La scelta dello score più appropriato dipende dal setting clinico e dall’obiettivo della valutazione. La seguente tabella sintetizza gli utilizzi primari dei diversi sistemi.
| Score | Utilizzo clinico primario | Setting di applicazione tipico |
|---|---|---|
| SOFA | Quantificazione della disfunzione d’organo e monitoraggio nel tempo. | Terapia intensiva |
| qSOFA | Strumento rapido di screening per il rischio di sepsi. | Reparti di medicina, pre-Terapia Intensiva |
| MEWS / NEWS | Monitoraggio e supporto decisionale per l’escalation delle cure. | Reparti di medicina, Pronto Soccorso |
| APACHE II | Stima della mortalità attesa all’ammissione. | Terapia Intensiva |
Una corretta valutazione tramite l’uso appropriato di questi score costituisce il presupposto fondamentale per un intervento terapeutico tempestivo ed efficace.
Gestione terapeutica dello Shock Settico
La terapia dello shock settico è un processo articolato e tempo-dipendente, guidato dalle raccomandazioni della Surviving Sepsis Campaign. L’obiettivo primario è l’ottimizzazione della perfusione d’organo nel minor tempo possibile, al fine di prevenire l’insorgenza o l’aggravamento dell’insufficienza multiorgano (MOF/MODS). La strategia terapeutica si fonda su sei pilastri.
Now loading…
- Fluidoterapia endovenosa: la priorità assoluta è la correzione dell’ipovolemia relativa. Le linee guida raccomandano la somministrazione di almeno 30 mL/kg di cristalloidi bilanciati nelle prime 3 ore dalla diagnosi. La risposta alla fluidoterapia deve essere attentamente monitorata tramite indici dinamici (es. pulse pressure variation) per evitare un sovraccarico volemico dannoso. L’uso dei colloidi è controindicato a causa del loro potenziale nefrotossico.
- Raccolta di campioni per esami colturali: è imperativo raccogliere emocolture e campioni microbiologici da tutti i siti di sospetta infezione (es. urinocoltura, puntale di catetere) prima dell’inizio della terapia antibiotica, al fine di consentire una successiva de-escalation mirata.
- Terapia antibiotica ad ampio spettro: immediatamente dopo la raccolta dei campioni, deve essere avviata una terapia antibiotica empirica. Le tempistiche sono critiche: entro 3 ore per la sepsi stabile ed entro 1 ora per lo shock settico conclamato. Nello shock, si raccomanda l’uso di due agenti ad ampio spettro per coprire sia germi Gram-positivi che Gram-negativi. È indicato aggiungere in terapia anche un agente anti-fungino se è verosimile una co-infezione da micete, come accade nei pazienti immunodepressi, lungodegenti o con diversi device invasivi.
- Impiego di amine vasoattive: se la PAM rimane inferiore a 65 mmHg nonostante un’adeguata fluidoterapia, è indicato l’impiego di vasopressori. Il farmaco di prima scelta è la noradrenalina. In caso di risposta insufficiente, il farmaco di seconda scelta da aggiungere è la vasopressina. In presenza di una disfunzione cardiaca associata, è raccomandata l’aggiunta di un agente inotropo (es. dobutamina, adrenalina).
- Rimodulazione della terapia antibiotica: una volta disponibili i risultati degli esami colturali e dell’antibiogramma, la terapia antibiotica deve essere “rimodulata” (de-escalation), passando a un trattamento mirato sul patogeno isolato. Il monitoraggio di biomarcatori come la procalcitonina può guidare la durata ottimale della terapia.
- Source control: è fondamentale identificare e rimuovere la fonte dell’infezione. Questo può richiedere un intervento chirurgico di bonifica o la rimozione di un device infetto, come un catetere vascolare o vescicale.
Il raggiungimento di specifici target terapeutici, che indicano il ripristino di un’adeguata perfusione d’organo, è la misura del successo di tale approccio.
- Ottenimento di una PAM > 65 mmHg;
- abbassamento del livello dei lattati < 2 mmol/L;
- mantenimento della diuresi oraria > 0.5-1 mL/kg/h;
- mantenimento dell’ScVO₂ / SvO₂ > 70-75%.
Il raggiungimento di questi target è la misura del successo di un approccio integrato, che combina la valutazione oggettiva con un’azione terapeutica tempestiva.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.