La comprensione dell’avvelenamento da cianuro richiede un’analisi che trascenda la semplice descrizione medica, integrando la chimica industriale, la biochimica mitocondriale, la botanica evolutiva e la storia della scienza.
Il cianuro è una delle tossine più rapide ed efficaci conosciute dall’uomo, agendo come un interruttore molecolare capace di spegnere la produzione di energia cellulare in pochi istanti.1
Questo articolo esamina la natura duale del cianuro: da un lato, colonna portante dell’industria chimica moderna e possibile precursore della vita stessa; dall’altro, strumento di morte rapida e causa di gravi sindromi neurologiche croniche nelle popolazioni vulnerabili.
Now loading…
- Natura chimica e classificazione del cianuro
- Storia: dalla scoperta agli usi bellici
- Origine e produzione: sintesi naturale e artificiale
- Cianogenesi nel regno vegetale
- Produzione Industriale
- Meccanismo d’azione e fisiopatologia cellulare
- Inibizione della citocromo c ossidasi
- Passaggio al metabolismo anaerobico e acidosi lattica
- Tossicocinetica: assorbimento, distribuzione e metabolismo
- Vie di ingresso e assorbimento
- Distribuzione tissutale
- Metabolismo e vie di eliminazione
- Tossicologia quantitativa e dose letale
- Presentazione clinica: sintomi e segni
- Intossicazione acuta
- Esposizione cronica e sindromi neurologiche
- Diagnosi differenziale e approccio laboratoristico
- Strategie terapeutiche e gestione dell’emergenza
- Misure di supporto e stabilizzazione
- Terapia antidotica specifica
- Prognosi, sopravvivenza e complicanze a lungo termine
- Quadro normativo e sicurezza sul lavoro
Natura chimica e classificazione del cianuro
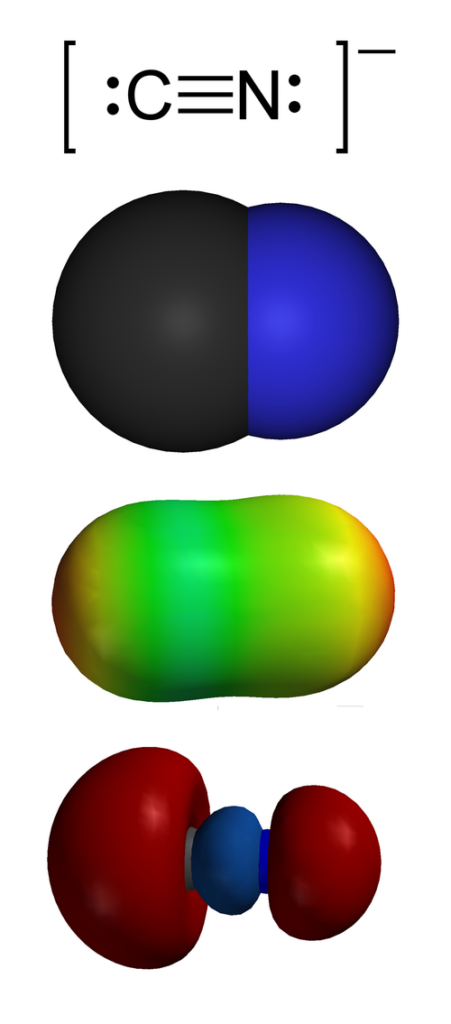
Il termine cianuro identifica genericamente ogni composto chimico contenente il gruppo funzionale ciano (C≡N), caratterizzato da un triplo legame tra un atomo di carbonio e uno di azoto. La pericolosità biologica di questi composti risiede principalmente nella capacità dello ione cianuro (CN−) di dissociarsi e interagire con i siti metallici degli enzimi cellulari.2
L’acido cianidrico (HCN), noto anche come acido prussico, rappresenta la forma più volatile e letale; a temperatura ambiente si presenta come un liquido incolore o un gas con un punto di ebollizione di circa 25,6 °C.
Chimicamente, il cianuro si presenta in diverse forme che determinano la sua cinetica di assorbimento e la gravità della tossicità. I sali inorganici semplici, come il cianuro di sodio (NaCN) e il cianuro di potassio (KCN), sono solidi bianchi altamente solubili in acqua che rilasciano rapidamente lo ione CN− in soluzione o a contatto con acidi gastrici.3
Esistono poi i nitrili, composti organici in cui il gruppo ciano è legato a un radicale idrocarburico; sebbene la loro tossicità sia spesso meno immediata, la metabolizzazione enzimatica può liberare cianuro libero nel tempo, portando a quadri clinici di intossicazione ritardata.
| Proprietà fisico-chimiche | Acido cianidrico (HCN) | Cianuro di sodio (NaCN) | Cianuro di potassio (KCN) |
|---|---|---|---|
| Stato di aggregazione | Gas / Liquido volatile | Solido cristallino | Solido cristallino |
| Peso Molecolare | 27,03 g/mol | 49,01 g/mol | 65,12 g/mol |
| Punto di ebollizione | 25,6 °C | 1.496 °C | 1.625 °C |
| Solubilità in H2O | Miscibile | 480 g/L a 20 °C | 716 g/L a 25 °C |
| pKa | 9,21 | N/A | N/A |
L’equilibrio di dissociazione dell’acido cianidrico è fortemente influenzato dal pH dell’ambiente. Al pH fisiologico del sangue umano (circa 7,4), il cianuro esiste prevalentemente nella sua forma indissociata (HCN), che è elettricamente neutra e altamente lipofila, facilitando così il passaggio attraverso le membrane cellulari e la barriera emato-encefalica.
Storia: dalla scoperta agli usi bellici
La storia del cianuro è una cronaca di scoperte scientifiche intrecciate con eventi tragici. Il primo incontro documentato della chimica moderna con i composti del cianuro risale al 1704, quando il produttore di colori Diesbach e l’alchimista Dippel crearono accidentalmente il Blu di Prussia (ferrocianuro ferrico), un pigmento blu intenso utilizzato dai pittori.5 Tuttavia, la natura dell’acido in esso contenuto rimase ignota per quasi un secolo.
Nel 1782, il chimico svedese Carl Wilhelm Scheele riuscì a isolare l’acido cianidrico a partire dal Blu di Prussia, definendolo “acido prussico“. Scheele descrisse minuziosamente le proprietà del gas, ignaro della sua estrema letalità; la tradizione narra che morì nel suo laboratorio proprio a causa delle esalazioni dei composti che stava studiando, segnando il cianuro come una sostanza pericolosa sin dalle sue origini accademiche. Successivamente, nel 1811, Joseph Louis Gay-Lussac ne determinò la formula molecolare e la struttura chimica corretta, gettando le basi per la comprensione della chimica dei nitrili.
L’uso del cianuro come agente di morte è stato sistematico nel XX secolo. Durante la Prima Guerra Mondiale, l’esercito francese impiegò l’acido cianidrico e il cloruro di cianogeno come armi chimiche, sebbene la loro volatilità ne riducesse l’efficacia sul campo di battaglia rispetto a gas più densi come il fosgene.6 L’apice dell’orrore fu raggiunto nella Seconda Guerra Mondiale, con l’utilizzo del Zyklon B (acido cianidrico adsorbito su granuli di terra diatomacea) nei campi di sterminio nazisti, trasformando un insetticida industriale in uno strumento di genocidio.7

In tempi più recenti, il cianuro è rimasto nell’immaginario collettivo per il suo ruolo nei suicidi di figure storiche come Heinrich Himmler e Alan Turing, e per eventi tragici come il suicidio di massa di Jonestown nel 1978, dove oltre 900 persone morirono ingerendo cianuro di potassio miscelato a bevande.
Questa storia carica di significati negativi non deve però oscurare il fatto che il cianuro è stato proposto come una molecola chiave nell’abiogenesi, agendo da precursore per la sintesi di amminoacidi e basi azotate nelle prime fasi della Terra.
Origine e produzione: sintesi naturale e artificiale
Il cianuro non è solo un prodotto della sintesi chimica umana, ma è onnipresente nel regno biologico, dove svolge funzioni di difesa e metabolismo.
Cianogenesi nel regno vegetale
Oltre 2.500 specie di piante praticano la cianogenesi, un processo biochimico che porta al rilascio di acido cianidrico in risposta a danni tissutali.8 9 Le piante non contengono cianuro libero, poiché sarebbe tossico per i loro stessi mitocondri; lo immagazzinano invece sotto forma di glicosidi cianogenetici, molecole stabili in cui il gruppo ciano è legato a uno zucchero.
Il meccanismo di attivazione è un esempio di “bomba chimica” a due componenti:
- fase di immagazzinamento: i glicosidi cianogenetici (come l’amigdalina o la linamarina) sono segregati nei vacuoli cellulari;
- fase di rilascio: in caso di masticazione da parte di un erbivoro, la rottura delle membrane cellulari mette i glicosidi in contatto con enzimi specifici (β-glucosidasi) situati nel citoplasma o nell’apoplasto;
- idrolisi: l’enzima scinde il legame glucosidico formando una cianidrina instabile, che si decompone poi spontaneamente o tramite l’idrossinitrile liasi in un chetone (o aldeide) e gas HCN.

Le principali fonti alimentari e naturali includono:
- Manioca (cassava): contiene linamarina. È la fonte alimentare di cianuro più significativa al mondo, specialmente in Africa;10 11
- Rosaceae (semi e noccioli): amigdalina è presente in mandorle amare, noccioli di albicocca, pesca, ciliegia e semi di mela;
- Sorgum: contiene durrina, particolarmente pericolosa per il bestiame durante i periodi di siccità o dopo le gelate, quando la concentrazione di glicosidi aumenta.
| Pianta/fonte | Glicoside principale | Parte della pianta | Potenziale di rilascio CN |
|---|---|---|---|
| Mandorle amare | Amigdalina | Seme | Elevatissimo |
| Manioca | Linamarina | Radici e foglie | Variabile (alto in varietà amare) |
| Albicocca | Amigdalina | Nocciolo | Elevato |
| Sorgo | Durrina | Foglie giovani | Elevato (pericoloso per bestiame) |
| Semi di lino | Linamarina | Semi | Moderato |
Produzione Industriale
A livello industriale, la produzione di cianuro è massiccia e fondamentale per settori come l’estrazione mineraria dell’oro e la produzione di plastiche. Esistono tre processi principali per la sintesi dell’acido cianidrico:
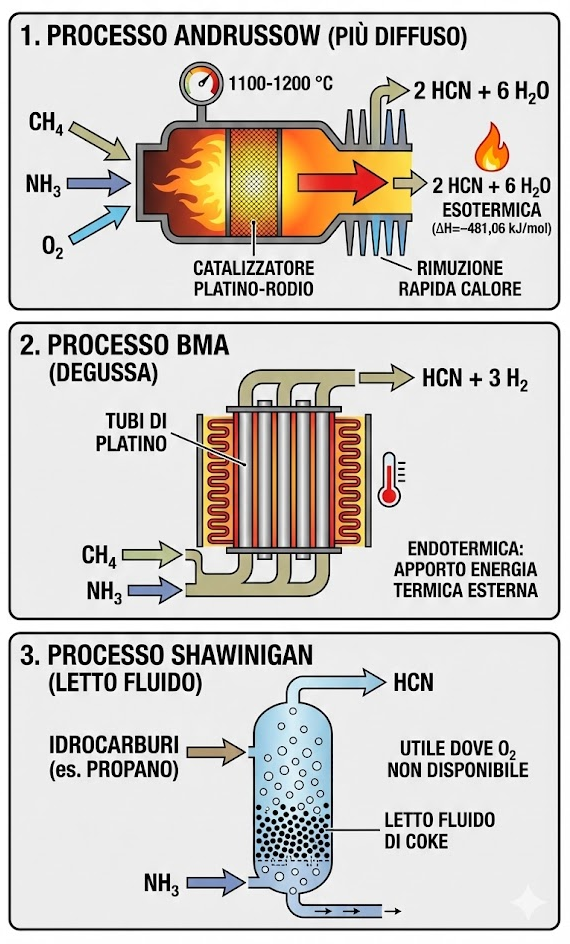
- processo Andrussow: è il metodo più diffuso. Consiste nella reazione catalitica tra metano (CH4), ammoniaca (NH3) e ossigeno (O2) su una rete di platino-rodio a circa 1.100−1.200 °C.12 13
2CH4 + 2NH3 + 3O2 → 2HCN + 6H2OQuesta reazione è fortemente esotermica (ΔH=−481,06kJ/mol). Il calore generato deve essere rimosso rapidamente per evitare la decomposizione termica del prodotto; - processo BMA (Degussa): utilizza metano e ammoniaca in assenza di ossigeno. La reazione avviene all’interno di tubi di platino ed è fortemente endotermica, richiedendo un apporto costante di energia termica esterna.
CH4 + NH3 → HCN + 3H2 - processo Shawinigan: utilizza idrocarburi (come il propano) e ammoniaca in un letto fluido di particelle di coke. Questo metodo è meno comune rispetto all’Andrussow ma è utile dove l’ossigeno puro non è facilmente disponibile.
Oltre alla produzione primaria, il cianuro è un sottoprodotto comune della combustione incompleta di materiali sintetici (poliuretano, nylon, acrilici) e fibre naturali ricche di azoto (lana, seta). Negli incendi domestici moderni, l’esposizione al cianuro tramite inalazione di fumo è una causa di morte rapida spesso concomitante all’avvelenamento da monossido di carbonio.14
Meccanismo d’azione e fisiopatologia cellulare
Il cianuro è classificato come un asfissiante cellulare o citotossico. La sua azione non impedisce all’ossigeno di entrare nel sangue, ma impedisce alle cellule di utilizzarlo per produrre energia, portando a una sorta di “fame interna” in presenza di abbondanza.15
Inibizione della citocromo c ossidasi
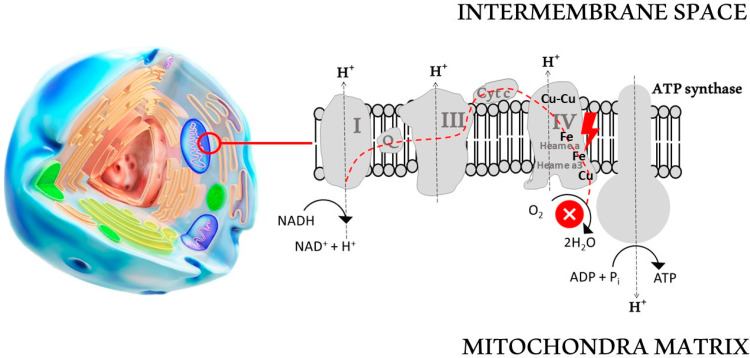
Il bersaglio molecolare critico è il mitocondrio, specificamente la catena di trasporto degli elettroni (ETC). All’interno di questa catena, la citocromo c ossidasi (complesso IV) è l’enzima finale responsabile del trasferimento di elettroni all’ossigeno per formare acqua.
- Legame al ferro ferrico: il cianuro ha un’affinità elettiva per il ferro nello stato di ossidazione ferrico (Fe3+). Si lega stabilmente all’atomo di ferro del gruppo eme a3 nel complesso IV;
- blocco della respirazione: questo legame impedisce all’enzima di passare allo stato ridotto necessario per legare l’ossigeno molecolare. La catena di trasporto si interrompe bruscamente;
- crisi energetica: senza il flusso di elettroni, viene a mancare il gradiente protonico che alimenta l’ATP sintasi. La produzione di adenosina trifosfato (ATP) crolla, portando alla morte cellulare per l’incapacità di mantenere i gradienti ionici e le funzioni basali.
Passaggio al metabolismo anaerobico e acidosi lattica
Nel tentativo disperato di sopravvivere alla mancanza di ATP aerobico, le cellule attivano massicciamente la glicolisi anaerobica. Questo processo converte il piruvato in lattato per rigenerare il NAD+, ma con una resa energetica minima (2 molecole di ATP contro le 36-38 della respirazione aerobica).16
L’accumulo di acido lattico nel sangue è una conseguenza diretta e proporzionale alla gravità dell’avvelenamento. Un livello di lattato plasmatico superiore a 8-10 mmol/L è considerato un marker altamente sensibile e specifico per l’intossicazione acuta da cianuro. Poiché i tessuti non possono estrarre ossigeno dal sangue, la differenza di saturazione tra sangue arterioso e venoso si annulla, portando al segno clinico dell’arterializzazione del sangue venoso.
Tossicocinetica: assorbimento, distribuzione e metabolismo
La pericolosità del cianuro è amplificata dalla sua estrema velocità di assorbimento e dalla distribuzione ubiquitaria nei tessuti vitali.
Vie di ingresso e assorbimento
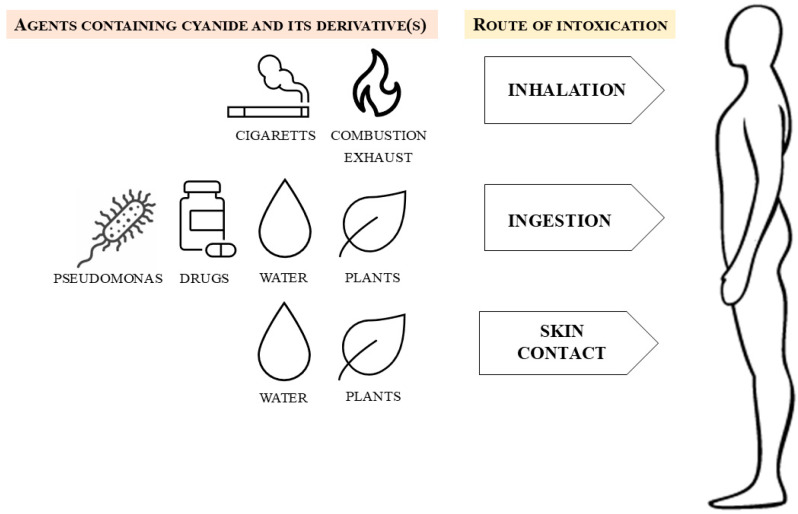
Il cianuro è una molecola “opportunista” che può penetrare l’organismo attraverso ogni via disponibile:
- inalazione: è la via più letale. L’acido cianidrico gassoso attraversa istantaneamente la superficie alveolare entrando nel circolo sistemico. I sintomi iniziano entro pochi secondi e la morte può sopraggiungere in meno di un minuto;
- ingestione: i sali (NaCN, KCN) raggiungono lo stomaco dove il pH acido favorisce la conversione in HCN, facilitandone l’assorbimento gastrico e duodenale. I sintomi appaiono solitamente entro pochi minuti;
- contatto dermico: il cianuro è liposolubile e può attraversare la pelle intatta. Questa via è particolarmente insidiosa negli incidenti industriali o durante la pulizia di serbatoi, dove l’esposizione può essere prolungata prima dell’insorgenza dei sintomi.
Distribuzione tissutale
Una volta nel sangue, il cianuro si distribuisce rapidamente a tutti gli organi, con una predilezione per quelli ad alto consumo di ossigeno (cervello e cuore). Il volume di distribuzione (Vd) è stimato intorno a 1,5L/kg. Circa il 60% del cianuro plasmatico è legato alle proteine, ma la quota maggiore nel sangue intero si trova all’interno dei globuli rossi, dove si lega con alta affinità alla metaemoglobina.
Metabolismo e vie di eliminazione
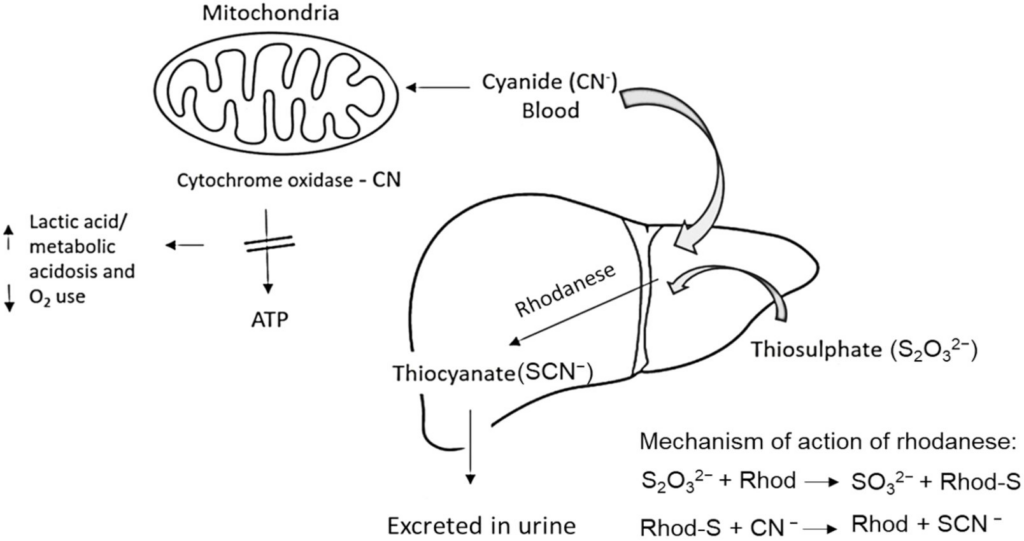
L’organismo umano possiede una capacità innata di disintossicare piccole quantità di cianuro. Il meccanismo principale coinvolge l’enzima rhodanese (tiosolfato-cianuro solfurotransferasi), localizzato principalmente nei mitocondri di fegato e reni:
- reazione di detossificazione: la rhodanese utilizza un donatore di zolfo (solitamente il tiosolfato endogeno) per convertire lo ione cianuro (CN−) in tiocianato (SCN−), una sostanza significativamente meno tossica;
- escrezione: il tiocianato è idrosolubile e viene escreto per via renale nelle urine. L’emivita del cianuro nel sangue è molto breve (0,3−1,3 ore), mentre quella del tiocianato è più lunga (circa 5 ore), rendendo quest’ultimo un biomarcatore utile per l’esposizione recente;17
- vie minori: includono l’escrezione di HCN gassoso attraverso l’aria espirata e la combinazione con la cisteina per formare acido 2-amminotiazolina-4-carbossilico (ATCA).
Tossicologia quantitativa e dose letale
Il margine tra una dose sicura (come quella contenuta in pochi semi di mela) e una dose letale è estremamente stretto. La tossicità è quantificata in base alla via di esposizione e alla concentrazione ematica.
| Parametro di tossicità | Valore / Dose | Note |
|---|---|---|
| Dose letale orale (uomo) | 1,5-3,5 mg/kg | Circa 100-200 mg per un adulto medio |
| Concentrazione letale inalatoria | >300 ppm | Morte immediata o entro pochi minuti |
| Concentrazione ematica tossica | >0,5 mg/L (20 μM) | Insorgenza di sintomi sistemici |
| Concentrazione ematica letale | >2,5-3,0 mg/L | Spesso fatale senza trattamento |
La variabilità individuale è significativa. Fattori come la pienezza dello stomaco (che rallenta l’assorbimento dei sali) o la presenza di una riserva adeguata di amminoacidi solforati possono influenzare leggermente la sopravvivenza, ma non alterano la natura intrinsecamente letale del composto.18
Presentazione clinica: sintomi e segni
L’avvelenamento da cianuro si manifesta come una “tempesta metabolica” che colpisce primariamente i sistemi più dipendenti dall’ossigeno.
Intossicazione acuta
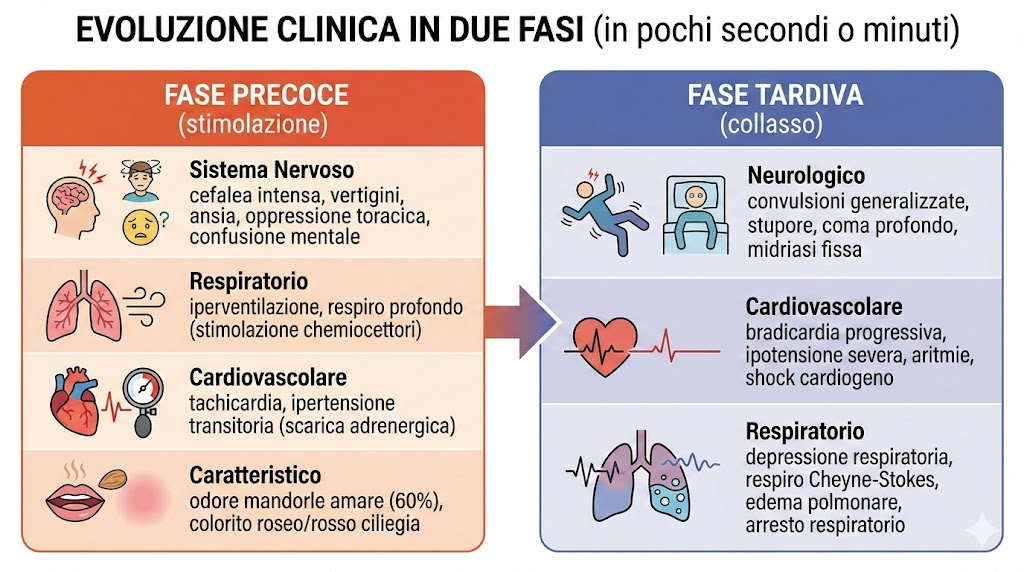
La clinica evolve in due fasi distinte che possono susseguirsi in pochi secondi o minuti:
Caricamento….
- Fase precoce (stimolazione):
- Sistema Nervoso: cefalea intensa, vertigini, ansia, senso di oppressione toracica e confusione mentale;
- Respiratorio: iperventilazione (tachipnea) e respiro profondo, causati dalla stimolazione diretta dei chemiocettori;
- Cardiovascolare: tachicardia e ipertensione transitoria dovuta alla scarica adrenergica;
- Caratteristico: odore di mandorle amare nell’alito (percepibile solo dal 60% della popolazione) e colorito roseo/rosso ciliegia della cute.
- Fase tardiva (collasso):
- Neurologico: convulsioni generalizzate, stupore, coma profondo e midriasi fissa;
- Cardiovascolare: bradicardia progressiva, ipotensione severa, aritmie ventricolari (compresa la fibrillazione) e shock cardiogeno;
- Respiratorio: depressione respiratoria, respiro irregolare (Cheyne-Stokes), edema polmonare non cardiogeno e arresto respiratorio.
Esposizione cronica e sindromi neurologiche
L’assunzione costante di bassi livelli di cianuro (tipicamente tramite la manioca) non porta alla morte immediata ma danneggia permanentemente il sistema nervoso centrale:
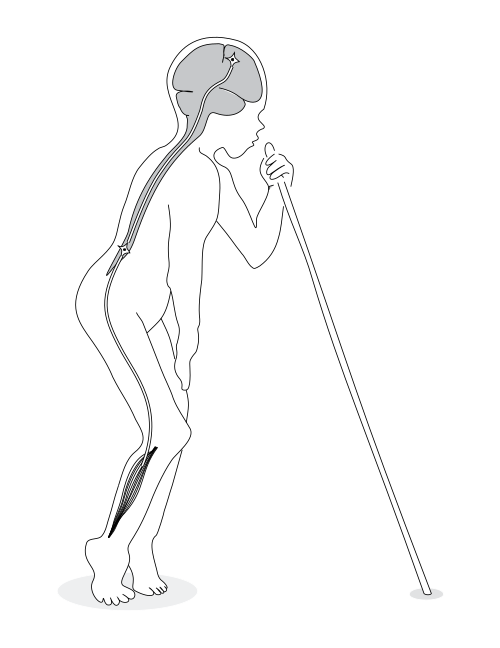
- Konzo: una malattia del motoneurone superiore che causa paralisi spastica irreversibile delle gambe. Colpisce principalmente bambini e donne in età fertile. È associata a una dieta quasi esclusiva di manioca amara processata male, combinata con una carenza di proteine che impedisce la detossificazione del cianuro;19
- Neuropatia Atassica Tropicale (TAN): caratterizzata da perdita della vista (atrofia ottica), sordità e perdita di sensibilità alle estremità, con un decorso lento e progressivo nel tempo;
- gozzo e cretinismo: il tiocianato derivante dal cianuro compete con lo iodio nella tiroide, aggravando le carenze iodiche e portando a disfunzioni tiroidee endemiche.
Diagnosi differenziale e approccio laboratoristico
In un contesto di emergenza, la diagnosi deve basarsi sul sospetto clinico. I tempi della biologia superano quelli del laboratorio.
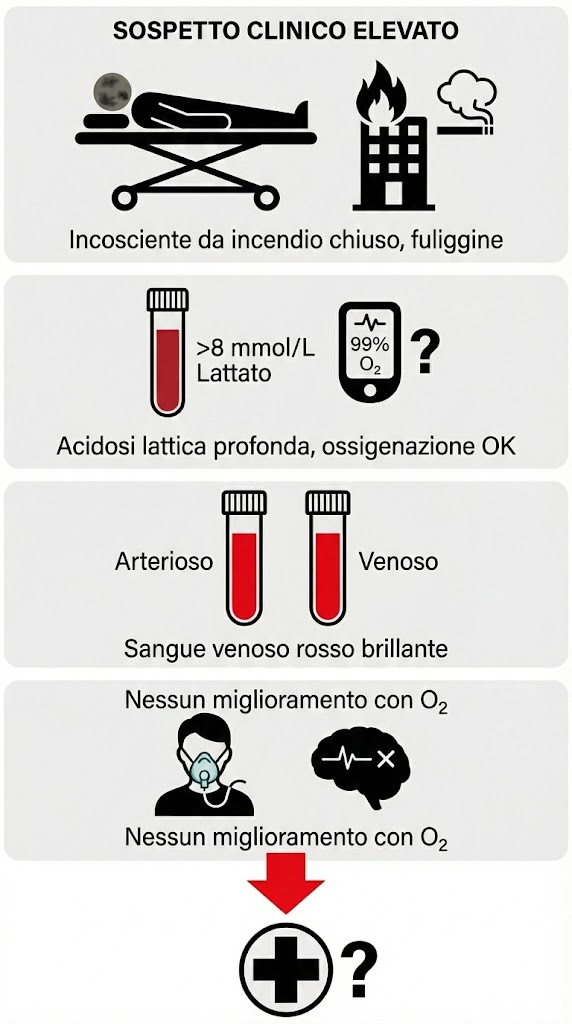
Criteri per il sospetto clinico elevato:
- paziente incosciente rimosso da un incendio in uno spazio chiuso con fuliggine nelle narici;
- presenza di acidosi lattica profonda inspiegabile (>8mmol/L) nonostante un’adeguata ossigenazione arteriosa;
- sangue venoso che appare rosso brillante (simile all’arterioso) a causa del mancato utilizzo periferico di ossigeno;
- mancato miglioramento dello stato di coscienza dopo somministrazione di ossigeno al 100% in un paziente sospetto per monossido di carbonio.
Sebbene il dosaggio del cianuro nel sangue intero sia la prova definitiva, esso serve quasi esclusivamente per scopi medico-legali post-mortem o per confermare la diagnosi a posteriori. Altri test includono il test del Blu di Prussia o la diffusione di Conway, ma sono raramente disponibili in tempo reale nei reparti di emergenza.
Strategie terapeutiche e gestione dell’emergenza
Il trattamento dell’avvelenamento da cianuro è una corsa contro il tempo. L’obiettivo primario è rimuovere il cianuro dalla citocromo ossidasi il più rapidamente possibile.
Misure di supporto e stabilizzazione
Prima di qualsiasi antidoto, è fondamentale garantire le funzioni vitali.
- ossigenazione: somministrare ossigeno al 100% via maschera o intubazione. L’ossigeno ad alti flussi può aiutare a spostare l’equilibrio di legame e favorire le vie metaboliche collaterali;
- supporto emodinamico: infusione di liquidi e vasopressori (noradrenalina) per contrastare l’ipotensione severa indotta dal cianuro;
- correzione dell’acidosi: il bicarbonato di sodio può essere utilizzato per tamponare l’acidosi metabolica estrema, sebbene la risoluzione definitiva dipenda dall’antidoto.
Terapia antidotica specifica
Caricamento…
Attualmente sono riconosciuti tre approcci principali, ciascuno con vantaggi e controindicazioni specifiche.
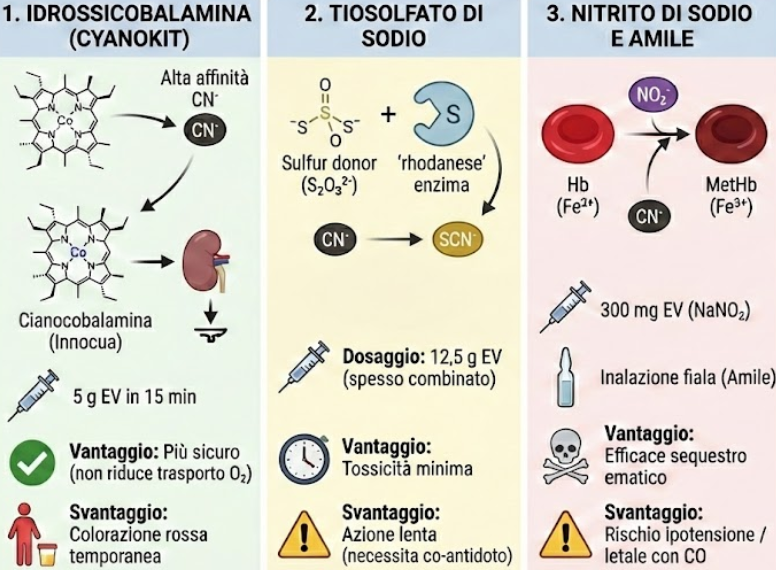
- Idrossicobalamina (Cyanokit):
- meccanismo: è una forma di vitamina B12 che contiene un atomo di cobalto. Questo atomo ha un’affinità per il cianuro superiore a quella della citocromo ossidasi. Si lega al cianuro formando cianocobalamina, che è innocua e viene escreta dai reni;
- dosaggio: 5 g endovena in 15 minuti. Una seconda dose può essere somministrata in base alla gravità;
- vantaggi: è considerato l’antidoto più sicuro, specialmente negli incendi, poiché non riduce la capacità di trasporto di ossigeno del sangue;
- Tiosolfato di Sodio:
- meccanismo: agisce come donatore esogeno di zolfo, potenziando l’attività dell’enzima rhodanese per convertire il cianuro in tiocianato;
- utilizzo: spesso usato in combinazione con l’idrossicobalamina o i nitriti. Da solo agisce troppo lentamente per le forme iperacute;
- Nitrito di Sodio e Amile:
- meccanismo: inducono la formazione di metaemoglobina (Fe3+). Questa “finta” citocromo ossidasi sequestra il cianuro nel sangue, impedendogli di raggiungere i tessuti;
- rischi: possono causare ipotensione severa e metaemoglobinemia eccessiva, che è letale in pazienti che hanno già inalato monossido di carbonio (incendi).20
| Antidoto | Dosaggio adulto standard | Principale vantaggio | Principale svantaggio |
|---|---|---|---|
| Idrossicobalamina | 5 g EV | Altissima sicurezza e velocità | Colorazione rossa temporanea di cute/urine |
| Tiosolfato di Sodio | 12,5 g EV | Tossicità minima | Azione lenta (necessita co-antidoto) |
| Nitrito di Sodio | 300 mg EV | Efficace sequestro ematico | Pericoloso se presente monossido di carbonio |
| Nitrito d’Amile | Inalazione fiala | Rapida somministrazione pre-ospedaliera | Efficacia limitata rispetto alla via EV |
Prognosi, sopravvivenza e complicanze a lungo termine
La sopravvivenza ad un avvelenamento da cianuro è una testimonianza della tempestività medica.
I dati clinici mostrano che, nonostante l’estrema tossicità, la prognosi è favorevole se l’antidoto viene somministrato prima dell’arresto cardiaco prolungato.
In studi su pazienti intossicati da fumo di incendi trattati con idrossicobalamina, i tassi di sopravvivenza oscillano tra il 42% e il 73%.
I dati NPDS (2019-2023) indicano una mortalità complessiva bassa (1,6%) se consideriamo tutte le vie di esposizione, ma questo dato è fortemente distorto dai casi lievi o accidentali. Nelle ingestioni intenzionali di dosi elevate, la mortalità senza trattamento si avvicina al 100%.
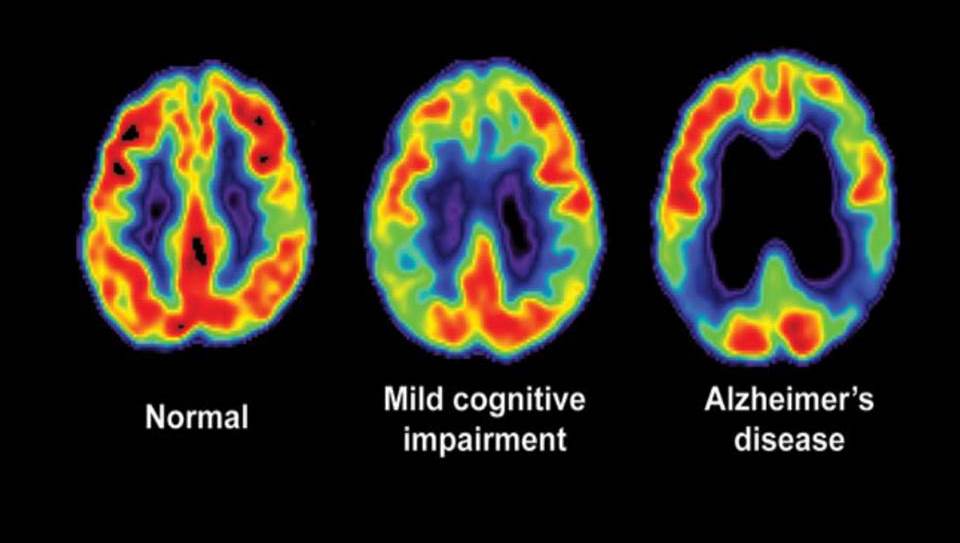
I pazienti che sopravvivono a crisi ipossiche gravi indotte dal cianuro possono manifestare danni cerebrali permanenti. Le aree più colpite sono i gangli della base e la corteccia cerebrale.
Molti sopravvissuti sviluppano entro settimane o mesi parkinsonismo post-cianuro una sindrome caratterizzata da tremori, rigidità e bradicinesia a causa della necrosi del putamen.
Perdita di memoria a breve termine, cambiamenti della personalità e difficoltà di concentrazione sono comuni sequele dei danni anossici cerebrali.
Quadro normativo e sicurezza sul lavoro
In ambito professionale, il cianuro è strettamente regolamentato per prevenire catastrofi ambientali e infortuni letali.
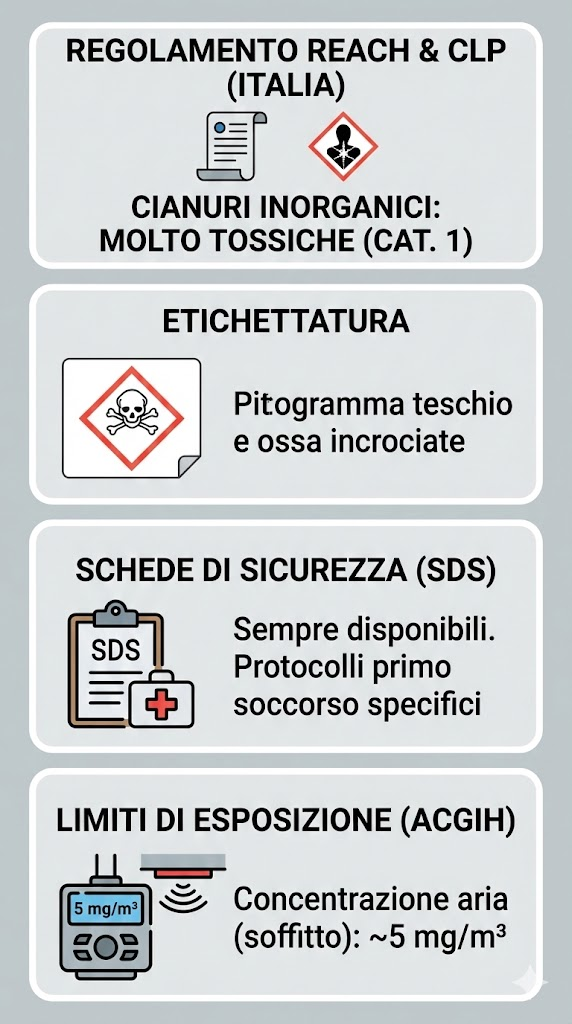
In Italia, il riferimento è il Regolamento REACH e il Regolamento CLP (1272/2008), che classificano i cianuri inorganici come sostanze “Molto Tossiche” (Categoria 1 per tossicità acuta):
- etichettatura: devono recare il pittogramma del teschio e delle ossa incrociate;
- schede di sicurezza (SDS): devono essere sempre disponibili e dettagliare i protocolli di primo soccorso specifici;
- limiti di esposizione: l’ACGIH stabilisce limiti rigorosi per la concentrazione nell’aria degli ambienti di lavoro (solitamente intorno a 5 mg/m3 come soffitto).
La prevenzione del Konzo e delle sindromi croniche nelle aree in via di sviluppo si basa invece sull’educazione alimentare. Il cosiddetto “metodo dell’ammollo” (wetting method) è una tecnica semplice ed efficace promossa dall’OMS che consiste nello stendere la farina di manioca inumidita al sole per alcune ore; questo permette agli enzimi naturali di liberare l’acido cianidrico gassoso prima del consumo, riducendo drasticamente il rischio di paralisi.
L’avvelenamento da cianuro rappresenta un paradigma della tossicologia d’urgenza: una sostanza onnipresente e fondamentale per la civiltà industriale che rimane, tuttavia, uno dei pericoli biologici più letali. La sfida futura risiede nella diffusione capillare degli antidoti sicuri e nell’implementazione di tecnologie di rilevamento rapido che possano guidare il clinico in quei pochi, decisivi secondi che separano la vita dalla morte cellulare.
Fonti:
- Mechanism and treatment methods of cyanide poisoning – ResearchGate ↩︎
- The Analysis of Cyanide and its Metabolites in Biological Samples – Open PRAIRIE – South Dakota State University ↩︎
- Hydrogen Cyanide: toxicological overview – GOV.UK ↩︎
- HEALTH EFFECTS – Toxicological Profile for Cyanide – NCBI Bookshelf ↩︎
- La scoperta di Carl Scheele dell’Acido Cianidrico 1782 – Roberto Poeti Chimica ↩︎
- Chapter 11 CYANIDE POIsONING ↩︎
- Cyanide Toxicity – StatPearls – NCBI Bookshelf ↩︎
- Cyanogenesis in Plants – PMC – NIH ↩︎
- Plant cyanogenic glycosides: from structure to properties and potential applications – Frontiers ↩︎
- Konzo and Cassava | ANU Research School of Biology ↩︎
- Superior Plants with Significant Amounts of Cyanide and Their Toxicological Implications ↩︎
- Cyanide – Wikipedia ↩︎
- Andrussow process – Wikipedia ↩︎
- Hyperbaric Evaluation and Treatment of Cyanide Toxicity – StatPearls – NCBI Bookshelf ↩︎
- Treat Cyanide Poisoning With CYANOKIT® (hydroxocobalamin) ↩︎
- Cyanide poisoning – Wikipedia ↩︎
- Cyanide and Cyanogenic Compounds—Toxicity, Molecular Targets, and Therapeutic Agents – PMC ↩︎
- Bioavailability of cyanide after consumption of a single meal of foods containing high levels of cyanogenic glycosides: a crossover study in humans – PMC ↩︎
- Konzo – Wikipedia ↩︎
- Biological properties of methaemoglobin – Deranged Physiology ↩︎