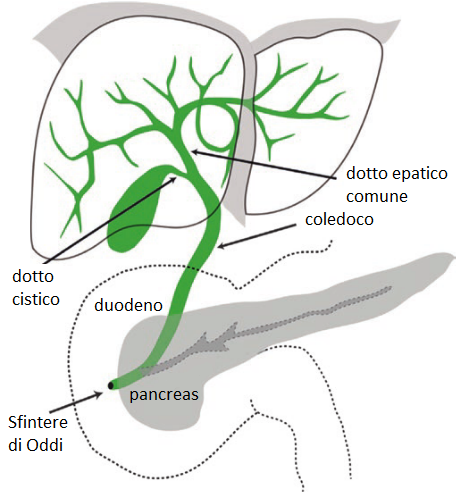
La fibrosi retroperitoneale (FRP) è una condizione rara e complessa caratterizzata dalla formazione di tessuto fibroso infiammatorio nello spazio retroperitoneale, la regione anatomica situata dietro il peritoneo, che contiene strutture come i reni, gli ureteri, l’aorta e la vena cava inferiore. Questa patologia può portare a complicazioni significative, tra cui l’ostruzione degli ureteri e il danneggiamento degli organi circostanti.
Eziopatogenesi
La fibrosi retroperitoneale è un processo complesso e multifattoriale che coinvolge meccanismi infiammatori, immunologici e fibrotici.
Innanzitutto bisogna distinguere due forme di FRP: idiopatica e secondaria.
Indipendentemente dalla causa, la FRP condivide alcuni meccanismi patogenetici comuni:
- attivazione dei fibroblasti, le cellule chiave nella formazione del tessuto fibroso. In risposta a stimoli infiammatori, i fibroblasti si attivano e iniziano a produrre grandi quantità di collagene e altre proteine della matrice extracellulare.
L’attivazione dei fibroblasti è mediata da citochine come il TGF-β (fattore di crescita trasformante beta), che svolge un ruolo centrale nella fibrogenesi; - infiammazione cronica. Le cellule infiammatorie, come macrofagi, linfociti T e mastociti, rilasciano citochine pro-infiammatorie (es. IL-1, IL-6, TNF-α) che perpetuano la risposta infiammatoria e promuovono la fibrosi;
- deposizione di collagene e altri componenti della matrice extracellulare in maniera eccessiva porta alla formazione di una massa fibrosa che può comprimere o avvolgere le strutture retroperitoneali, come gli ureteri o i vasi sanguigni;
- angiogenesi, la formazione di nuovi vasi sanguigni, è spesso osservata nel tessuto fibroso retroperitoneale. Questo processo è mediato da fattori come il VEGF (fattore di crescita endoteliale vascolare) e contribuisce alla progressione della fibrosi.
Alcuni fattori possono aumentare il rischio di sviluppare FRP:
- età: è più comune negli adulti di mezza età e negli anziani;
- sesso: gli uomini sono leggermente più colpiti rispetto alle donne;
- fumo: è un fattore di rischio per l’aterosclerosi, che può contribuire alla FRP idiopatica;
- malattie autoimmuni.
Caricamento….
Fibrosi retroperitoneale idiopatica (Malattia di Ormond)
La forma idiopatica, che rappresenta la maggior parte dei casi (circa il 70% dei casi), è caratterizzata dall’assenza di una causa evidente. Tuttavia, sono stati proposti diversi meccanismi patogenetici.
Una delle teorie più accreditate è che la FRP idiopatica sia una malattia autoimmune. In questo contesto, il sistema immunitario attacca erroneamente i tessuti retroperitoneali, scatenando una risposta infiammatoria cronica.
Sono stati osservati autoanticorpi e linfociti T attivati nel tessuto fibroso, suggerendo un ruolo dell’immunità cellulo-mediata. Inoltre alcuni pazienti presentano associazioni con altre malattie autoimmuni, come la tiroidite di Hashimoto o il lupus eritematoso sistemico, supportando l’ipotesi autoimmune.
La FRP idiopatica è spesso associata a placche aterosclerotiche nell’aorta addominale. Si ritiene che l’infiammazione vascolare cronica legata all’aterosclerosi possa estendersi ai tessuti circostanti, innescando la formazione di tessuto fibroso. Le cellule infiammatorie, come i macrofagi e i linfociti, rilasciano citochine pro-infiammatorie (es. IL-6, TNF-α) e fattori di crescita (es. TGF-β), che promuovono la proliferazione dei fibroblasti e la deposizione di collagene.
Alcuni ricercatori considerano la FRP idiopatica come una forma di periaortite cronica, in cui l’infiammazione colpisce principalmente l’avventizia dell’aorta e si estende ai tessuti retroperitoneali circostanti. Questo processo può essere innescato da antigeni rilasciati dalle placche aterosclerotiche, che attivano una risposta immunitaria locale.
Fibrosi Retroperitoneale secondaria
La forma secondaria è associata a cause specifiche, che possono innescare una risposta infiammatoria e fibrotica nel retroperitoneo. Tra i principali fattori eziologici rientrano:
- farmaci. Il meccanismo esatto non è chiaro, ma si ritiene che alcuni farmaci possano indurre una risposta infiammatoria cronica o una reazione autoimmune. Tra questi:
- metisergide: farmaco usato per l’emicrania, che può indurre fibrosi retroperitoneale, pleurica e cardiaca;
- beta-bloccanti: come il propranololo sono stati associati a casi di FRP;
- ergotamina: usata per il trattamento dell’emicrania, può causare fibrosi retroperitoneale;
- infezioni croniche, come la tubercolosi o le infezioni fungine, possono scatenare una risposta infiammatoria nel retroperitoneo, portando alla formazione di tessuto fibroso.
Le infezioni possono attivare macrofagi e linfociti, che rilasciano citochine pro-infiammatorie e fattori di crescita, favorendo la fibrosi; - neoplasie. La FRP può essere associata a tumori maligni, come il linfoma, il carcinoma a cellule renali o il cancro del colon. In questi casi, la fibrosi è spesso una reazione paraneoplastica, in cui il tumore induce una risposta infiammatoria e fibrotica nei tessuti circostanti.
In alcuni casi, la FRP può essere causata direttamente dall’invasione tumorale del retroperitoneo; - radioterapia nella regione addominale o pelvica può causare fibrosi retroperitoneale come effetto collaterale tardivo. Le radiazioni ionizzanti danneggiano il DNA delle cellule, innescando una risposta infiammatoria cronica e la deposizione di tessuto fibroso;
- trauma o interventi chirurgici nella regione retroperitoneale possono scatenare una risposta infiammatoria e fibrotica, portando alla FRP.
Clinica
La fibrosi retroperitoneale può manifestarsi con una sintomatologia variabile, spesso aspecifica, rendendo la diagnosi iniziale complessa. La progressione della malattia può portare a complicanze significative, soprattutto se non trattata tempestivamente.
I sintomi dipendono dalle strutture retroperitoneali coinvolte e dall’estensione della fibrosi. I pazienti possono presentare una combinazione di sintomi generali e locali, tra cui:
- affaticamento, febbre (spesso legati all’infiammazione sistemica) e perdita di peso (specie nei casi associati a neoplasie);
- dolore lombare o addominale, che può essere sordo e persistente o acuto e severo, a seconda del grado di compressione delle strutture retroperitoneali;
- massa addominale palpabile: In alcuni casi, la massa fibrosa può essere palpabile durante un esame fisico;
- edemi agli arti inferiori determinati dalla ritenzione di liquidi per la compressione della vena cava inferiore o delle vene iliache;
- sintomi urologici, tra cui ostruzione ureterale e idronefrosi dovuta all’accumulo di urina, con conseguente riduzione della funzione renale per insufficienza renale se l’ostruzione non viene trattata. Si associa a volte colica renale (dolore acuto e severo) dovuta all’ostruzione improvvisa dell’uretere;
- sintomi vascolari: ipertensione secondaria, trombosi venosa profonda (per compressione della cava inferiore o delle vene iliache) e sindrome post-trombotica.
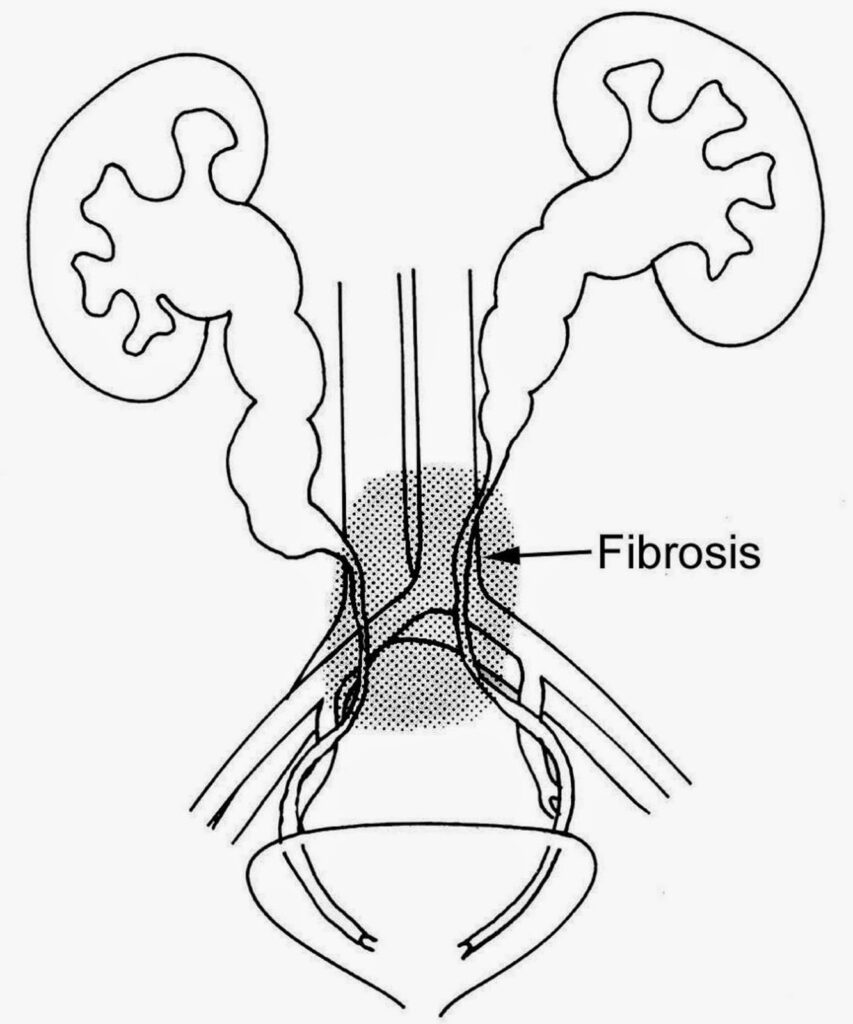
Se non diagnosticata e trattata tempestivamente, la FRP può portare a complicanze gravi e potenzialmente letali, tra cui quelle già dette:
- insufficienza renale acuta o cronica per l’ostruzione ureterale bilaterale e/o infezioni delle vie urinarie ricorrenti che possono complicarsi con pielonefrite o sepsi;
- trombosi venosa profonda (TVP) provocata dalla compressione della vena cava inferiore o delle vene iliache, con rischio di embolia polmonare e/o sindrome della vena cava inferiore con edema degli arti inferiori, dilatazione delle vene superficiali e insufficienza venosa cronica;
- ostruzione intestinale quando la fibrosi si estende al tratto gastrointestinale, perdita di peso e malnutrizione per la difficoltà nell’alimentazione;
- neuropatie periferiche da compressione dei nervi retroperitoneali, con dolore neuropatico, parestesie o debolezza muscolare;
- amiloidosi secondaria determinata dall’infiammazione cronica associata alla FRP.
Diagnosi
La diagnosi della fibrosi retroperitoneale è spesso complessa a causa della rarità della condizione e della natura aspecifica dei sintomi. Tuttavia, un approccio diagnostico multidisciplinare, che combina imaging avanzato, esami di laboratorio e, in alcuni casi, biopsia, è essenziale per confermare la presenza della malattia e distinguere tra la forma idiopatica e quella secondaria.
Molto importante è quindi l’anamnesi raccogliendo informazioni sui sintomi del paziente, come dolore lombare o addominale, affaticamento, perdita di peso, edemi agli arti inferiori o sintomi urologici (es. riduzione della diuresi, coliche renali) e valutando la storia clinica per la presenza di condizioni associate, come malattie autoimmuni, aterosclerosi, infezioni croniche o uso di farmaci noti per causare FRP (es. metisergide, beta-bloccanti).
Successivamente si passa all’esame obiettivo, infatti, in alcuni casi, la massa fibrosa retroperitoneale può essere palpabile. La presenza di gonfiore alle gambe può suggerire una compressione della vena cava inferiore. La misurazione della pressione arteriosa può rivelare ipertensione secondaria, legata alla compressione delle arterie renali.
Gli esami di laboratorio possono fornire indizi utili per la diagnosi di FRP, sebbene non siano specifici, tra questi vi sono:
- marcatori infiammatori: VES e PCR spesso elevata. Inoltre l’emocromo può mostrare anemia o leucocitosi, indicativi di infiammazione cronica;
- indici della funzionalità renale: creatinina e eGFR (un aumento della creatinina o una riduzione dell’eGFR possono indicare un’ostruzione ureterale o un danno renale), esame delle urine (può rilevare proteinuria o ematuria in caso di coinvolgimento renale);
- autoanticorpi (es. ANA, anti-TPO) per valutare la presenza di una condizione autoimmune sottostante.
L’imaging è fondamentale per la diagnosi della FRP, poiché consente di visualizzare il tessuto fibroso retroperitoneale e valutare il coinvolgimento delle strutture circostanti:
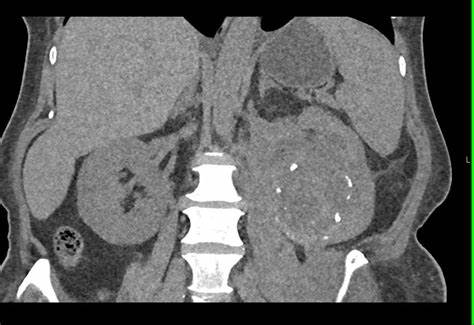
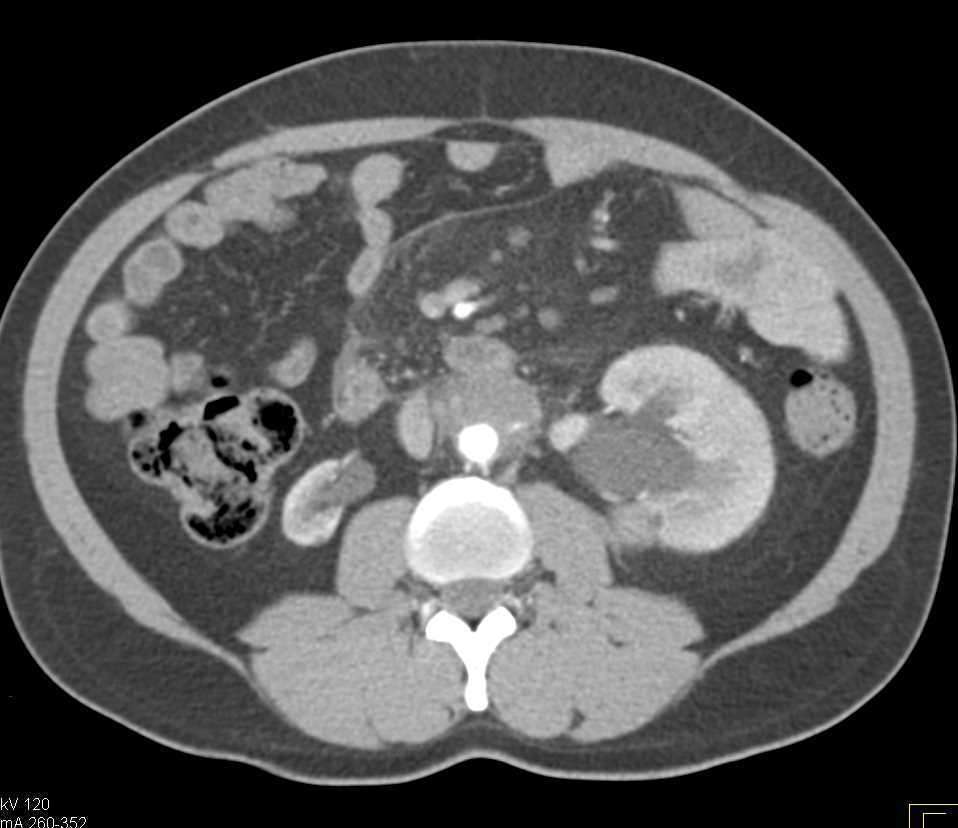
- la TC con mezzo di contrasto è l’esame di prima scelta per la diagnosi di FRP. Consente di identificare la massa fibrosa retroperitoneale, che appare come un tessuto denso e omogeneo, valutare il coinvolgimento degli ureteri, dell’aorta, della vena cava inferiore e di altre strutture.
Permette inoltre di rilevare idronefrosi o ostruzioni ureterali e distinguere tra FRP idiopatica e secondaria (es. presenza di masse tumorali); - la RM è particolarmente utile nei pazienti con allergia al mezzo di contrasto o in caso di necessità di una migliore caratterizzazione dei tessuti molli. Può evidenziare l’estensione della fibrosi e il coinvolgimento vascolare (es. compressione della vena cava inferiore);
- l’ecografia può essere utilizzata come esame iniziale per valutare l’idronefrosi o la presenza di masse retroperitoneali, tuttavia, ha una sensibilità inferiore rispetto alla TC o alla RM per la diagnosi di FRP;
- la scintigrafia renale con DMSA o MAG3 può essere utile per valutare la funzionalità renale e identificare ostruzioni ureterali;
- l’urografia endovenosa (IVU) è stata ampiamente sostituita dalla TC, ma può ancora essere utilizzata per valutare l’ostruzione ureterale;
- la PET-FDG può essere utile per identificare aree di infiammazione attiva nel retroperitoneo, distinguendo la FRP da altre condizioni (es. masse tumorali o fibrosi non attiva). La PET-FDG inoltre può mappare l’estensione della malattia, identificando aree di infiammazione attiva anche al di fuori del retroperitoneo e permette il monitoraggio della risposta al trattamento.
Ultimamente si sta studiando l’utilizzo della PET-FAPI, che sfrutta inibitori della proteina di attivazione dei fibroblasti (FAP), una proteina espressa dai fibroblasti attivati coinvolti nella fibrogenesi, permettendo quindi di visualizzare le aree di fibrosi attiva. Gli tudi preliminari sono promettenti, ma sono necessarie ulteriori validazioni.
In alcuni casi, può essere necessaria una biopsia percutanea o chirurgica per confermare la diagnosi di FRP e distinguere tra la forma idiopatica e quella secondaria. Essa viene eseguita in caso di sospetta FRP secondaria (presenza di una massa atipica o di neoplasia) e in caso di diagnosi incerta dopo imaging ed esami di laboratorio.
Il tessuto fibroso retroperitoneale mostra tipicamente una proliferazione di fibroblasti, deposizione di collagene e infiltrati infiammatori (linfociti, macrofagi, plasmacellule). Nella FRP secondaria, possono essere presenti cellule tumorali o segni di infezione.
Diagnosi differenziale
La FRP deve essere distinta da altre condizioni che possono causare sintomi simili, tra cui:
- condizioni infiammatorie e autoimmuni:
- malattia di Erdheim-Chester, una rara istiocitosi a cellule non-Langerhans che può coinvolgere il retroperitoneo, causando fibrosi e sintomi simili alla FRP, tuttavia si distingue per la presenza di coinvolgimento osseo (osteosclerosi) ed infiltrati di cellule istiocitiche CD68+ e CD1a- alla biopsia;
- vasculiti quali arterite a cellule giganti o polimialgia reumatica che possono causare infiammazione retroperitoneale e si distinguono per la presenza di sintomi sistemici (febbre, malessere), elevati marcatori infiammatori (VES, PCR), e coinvolgimento di altri vasi (es. arterie temporali);
- malattia di Crohn: può causare infiammazione e fibrosi retroperitoneale in casi avanzati, ma dà sintomi gastrointestinali (diarrea, dolore addominale) e coinvolgimento ileo-colico all’imaging;
- neoplasie retroperitoneali:
- linfomi, in particolare il linfoma non-Hodgkin, possono presentarsi come masse retroperitoneali. Si distinguono per la presenza di linfoadenopatia diffusa, sintomi B (febbre, sudorazione notturna, perdita di peso) e positività per marcatori linfoidi alla biopsia;
- sarcomi retroperitoneali, tumori maligni dei tessuti molli che si distinguono per la presenza di una massa eterogenea all’imaging, rapida crescita e invasione delle strutture circostanti;
- metastasi retroperitoneali da carcinoma del colon, del pancreas o del rene che possono metastatizzare in tale sede. In tal caso si evidenzia la lesione primaria e il coinvolgimento di altri organi;
- tumori desmoidi, neoplasie fibromatose che possono causare fibrosi localizzata. Sono a crescita lenta, non danno metastasi e alla biopsia sono positive alla beta-catenina;
- infezioni retroperitoneali:
- tubercolosi da Mycobacterium tuberculosis che può causare linfoadenite caseosa e fibrosi retroperitoneale. Si distingue per la storia di esposizione alla TB, sintomi sistemici (febbre, sudorazione notturna) e positività ai test per la TB (es. Mantoux, Quantiferon);
- ascessi retroperitoneali provocati da infezioni batteriche o fungine, ma che danno anche febbre, leucocitosi e raccolte fluide all’imaging con enhancement periferico;
- infezioni fungine, ad esempio istoplasmosi e criptococcosi che possono causare linfoadenopatia retroperitoneale in pazienti con storia di immunodepressione. Si evidenzia in questi casi positività ai test sierologici o colturali.
- condizioni vascolari:
- aneurisma dell’aorta addominale che può causare compressione delle strutture retroperitoneali e dolore lombare. Si osserva tramite dillatazione aortica all’imaging e provoca un dolore addominale pulsante;
- trombosi della vena cava inferiore, che causa edema degli arti inferiori e sintomi simili alla FRP. In tal caso l’imaging (eco-doppler, TC con contrasto) evidenzia segni di trombosi venosa;
- altre condizioni, quali l’amiloidosi retroperitoneale (che in genere ha un coinvolgimento multisistemico a reni, cuore, fegato) e la fibromatosi pelvica (caratterizzata da proliferazione di tessuto fibroso nella pelvi in assenza di infiammazione sistemica).
Approccio terapeutico
Il trattamento della fibrosi retroperitoneale dipende dalla causa sottostante (idiopatica o secondaria), dalla gravità della malattia e dalle complicanze associate. L’obiettivo principale è ridurre l’infiammazione, alleviare i sintomi, prevenire la progressione della fibrosi e gestire le complicanze, come l’ostruzione ureterale o l’insufficienza renale.
Il trattamento medico è la prima linea di terapia per la forma idiopatica e può essere utilizzato anche in casi selezionati di FRP secondaria. Tra i farmaci impiegati vi sono:
- corticosteroidi, come il prednisone, che riducono l’infiammazione e sopprimono la risposta immunitaria, rallentando la progressione della fibrosi. Si inizia tipicamente con una dose alta (0.5-1 mg/kg/die di prednisone) per 4-6 settimane, seguita da una riduzione graduale.
La maggior parte dei pazienti risponde bene, con miglioramento dei sintomi e riduzione della massa fibrosa all’imaging.
A lungo termine, possono dare osteoporosi, ipertensione, diabete e aumento del rischio di infezioni; - immunosoppressori, utilizzati in pazienti che non rispondono ai corticosteroidi o che richiedono un risparmio di steroidi. Tra questi vi sono il Micofenolato mofetile (1-1.5 g due volte al giorno), Azatioprina (1-2 mg/kg/die), Metotrexato (10-25 mg a settimana).
Questa terapia richiede regolari esami del sangue per valutare la funzionalità epatica e renale; - tamoxifene (20-40 mg/die), un modulatore selettivo del recettore degli estrogeni che può inibire la proliferazione dei fibroblasti. Alcuni studi riportano miglioramenti nella FRP idiopatica, ma l’evidenza è limitata. Tra gli effetti collaterali vi sono un aumento del rischio di trombosi ed effetti estrogenici.
- farmaci biologici, tra cui Rituximab, anticorpo monoclonale anti-CD20 utilizzato in casi refrattari di FRP idiopatica e Tocilizumab, un inibitore dell’interleuchina-6 (IL-6) che può ridurre l’infiammazione;
- sospensione dei farmaci causali nella forma secondaria indotta da farmaci (es. metisergide, beta-bloccanti).
Il trattamento chirurgico è indicato principalmente per gestire le complicanze della FRP, come l’ostruzione ureterale o la compressione vascolare. Esso si basa su:
- ureterolisi, che consiste nella liberazione chirurgica degli ureteri dal tessuto fibroso, spesso associata al posizionamento di stent ureterali. E’ indicata in caso di ostruzione ureterale con idronefrosi o insufficienza renale. Può essere eseguita per via laparoscopica o open;
- posizionamento di stent ureterali, indicato in caso di ostruzione ureterale acuta o come misura temporanea prima dell’ureterolisi. E’ minimamente invasivo ma migliora il flusso urinario e previene l’insufficienza renale. Può richiedere sostituzioni periodiche e può causare infezioni o irritazione;
- by-pass vascolare per ripristinare il flusso sanguingo in caso di compressione severa della vena cava inferiore o delle arterie renali;
- resezione della massa fibrosa, in casi selezionati, specialmente se associata a neoplasie.
Molto importante è gestire le complicanze dovute alla fibrosi. Una di queste è l’insufficienza renale che necessita il mantenimento di un’adeguata idratazione per supportare la funzionalità renale e, nei casi di insufficienza renale acuta o cronica gravi, la dialisi.
L’ipertensione va trattata con farmaci antipertensivi quali ACE-inibitori, calcio-antagonisti o beta-bloccanti.
La trombosi venosa profonda mediante anticoagulanti come eparina o warfarin.
Il monitoraggio regolare è essenziale per valutare la risposta al trattamento e prevenire recidive. Con un trattamento appropriato e un follow-up attento, molti pazienti possono ottenere un significativo miglioramento della qualità della vita e prevenire recidive. La ricerca continua a svolgere un ruolo cruciale nel migliorare le opzioni terapeutiche e la comprensione di questa condizione complessa.
Bibliografia:
- “Harrison’s Principles of Internal Medicine” (capitoli su malattie renali e fibrosi retroperitoneale);
- “Brenner & Rector’s The Kidney” (approfondimenti su patologie renali e urologiche);
- Idiopathic Retroperitoneal Fibrosis: A Review of Pathogenesis, Diagnosis, and Treatment – PubMed;
- The value of 18F-FDG PET/CT in the distinction between retroperitoneal fibrosis and its malignant mimics – PubMed;
- Clinical manifestations and diagnosis of retroperitoneal fibrosis – UpToDate;
- Treatment of retroperitoneal fibrosis – UpToDate.