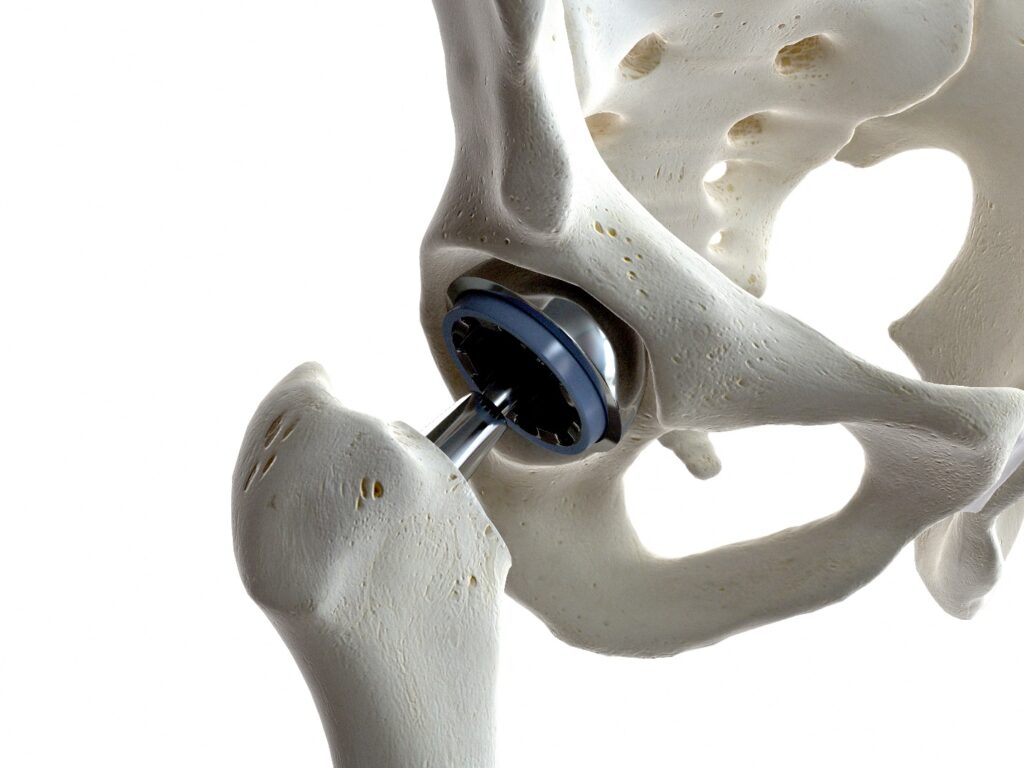
Le protesi d’anca hanno rivoluzionato la medicina ortopedica, offrendo a milioni di pazienti in tutto il mondo la possibilità di recuperare la mobilità e ridurre il dolore. Tuttavia, non tutte le protesi sono uguali, e alcune hanno portato a complicazioni impreviste. Tra queste, una delle più significative è lo pseudotumore da Metal-on-Metal (MoM), una condizione che ha attirato l’attenzione della comunità medica per i suoi effetti potenzialmente gravi.
Lo pseudotumore MoM è una massa non cancerosa che si forma nei tessuti circostanti una protesi d’anca con superfici di sfregamento in metallo. A differenza di un tumore vero e proprio, questa massa è il risultato di una reazione infiammatoria ai detriti metallici generati dall’usura delle componenti della protesi. Questa condizione è stata osservata principalmente in pazienti con protesi MoM, un tipo di impianto che è stato ampiamente utilizzato negli anni ’90 e 2000 per la sua presunta durabilità.
Cause
La formazione dello pseudotumore è il risultato di una combinazione di fattori meccanici, biologici e individuali:
- usura delle superfici metalliche: le protesi MoM sono progettate per avere due componenti metalliche che scorrono l’una sull’altra durante il movimento dell’anca. Con il tempo, questo movimento genera microparticelle e ioni metallici (come cromo e cobalto), che si diffondono nei tessuti circostanti e si accumulano innescando una reazione infiammatoria.
Inoltre, le superfici metalliche possono subire corrosione a causa dell’ambiente umido e ricco di elettroliti del corpo umano. Questo processo libera ulteriori ioni metallici nel tessuto circostante.
In alcuni casi, un posizionamento non ottimale della protesi o un design imperfetto possono aumentare l’attrito e accelerare l’usura, peggiorando il problema; - reazione immunitaria: il sistema immunitario riconosce questi detriti metallici come estranei e scatena una risposta infiammatoria.
I macrofagi cercano di fagocitare le particelle metalliche, ma non riescono a degradarle completamente. Questo provoca il rilascio di citochine pro-infiammatorie, che attirano altre cellule immunitarie e causano infiammazione cronica. L’infiammazione persistente può danneggiare i tessuti circostanti, portando alla morte cellulare (necrosi) e alla formazione di tessuto fibroso.
L’accumulo di detriti metallici, tessuto fibroso e liquido infiammatorio può creare una massa simile a un tumore, nota come pseudotumore.
Non tutti i pazienti reagiscono allo stesso modo ai detriti metallici. Alcuni fattori individuali possono aumentare il rischio di sviluppare uno pseudotumore MoM tra cui fattori genetici e allergia o ipersensibilità ai metalli come il cromo, il cobalto o il nichel, nota come dermatite da contatto sistemica, che può amplificare la risposta infiammatoria.
Il design della protesi e la tecnica chirurgica giocano un ruolo cruciale nello sviluppo dello pseudotumore MoM:
- angolazione della protesi: un posizionamento non ottimale della coppa acetabolare o dello stelo femorale può aumentare l’attrito e l’usura, accelerando la generazione di detriti metallici;
- dimensioni della testa femorale: le protesi con teste femorali di grandi dimensioni (≥36 mm) sono state associate a un maggiore rischio di usura e complicazioni.
- scarsa qualità dei materiali: in alcuni casi, difetti di fabbricazione o materiali di bassa qualità possono contribuire a un’usura precoce.
Alcuni pazienti sono più a rischio di sviluppare uno pseudotumore MoM a causa di caratteristiche demografiche o cliniche:
- sesso femminile: le donne sembrano essere più suscettibili, probabilmente a causa di differenze anatomiche e biomeccaniche;
- età e peso corporeo: pazienti più giovani o con un peso corporeo elevato possono sottoporre la protesi a maggiori sollecitazioni, aumentando l’usura;
- attività fisica intensa: un’attività fisica eccessiva può accelerare l’usura delle superfici metalliche.
Complicanze
In alcuni casi, i detriti metallici non rimangono confinati ai tessuti locali, ma si diffondono nel flusso sanguigno, causando una risposta sistemica:
- elevati livelli di ioni metallici nel sangue possono essere associati a effetti sistemici, come tossicità cardiaca, neurologica o endocrina.
- reazioni immunitarie sistemiche, come la linfocitosi T CD8+, una condizione in cui i linfociti T attaccano i tessuti sani.
Clinica
La presentazione clinica dello pseudotumore MoM è variabile e dipende da diversi fattori, tra cui la durata dell’esposizione ai detriti metallici, la sensibilità individuale ai metalli e l’entità del danno tissutale. I pazienti possono presentare sintomi locali, sistemici o una combinazione di entrambi.
I sintomi locali sono i più comuni e sono legati alla reazione infiammatoria nei tessuti circostanti la protesi. Questi includono:
- dolore: il sintomo principale e spesso il motivo per cui i pazienti cercano assistenza medica. È tipicamente localizzato nella regione dell’anca operata, ma può irradiarsi all’inguine, alla coscia o al gluteo. Il dolore può essere descritto come sordo e costante, ma in alcuni casi diventa acuto e lancinante, soprattutto durante il movimento o il carico sull’anca.
A differenza del dolore post-operatorio iniziale, che tende a migliorare con il tempo, il dolore associato allo pseudotumore MoM persiste o peggiora progressivamente; - gonfiore e massa palpabile: molti pazienti notano un rigonfiamento o una massa nella zona dell’anca o dell’inguine. Questa massa è causata dall’accumulo di liquido infiammatorio, tessuto fibroso o detriti metallici. In alcuni casi, la massa può essere palpabile durante l’esame fisico e risultare dolente al tatto;
- limitazione del movimento: i pazienti spesso riferiscono difficoltà a camminare, salire le scale o eseguire movimenti quotidiani. La rigidità articolare e la sensazione di “blocco” dell’anca sono comuni. La limitazione del movimento può essere dovuta al dolore, all’infiammazione o al danno meccanico causato dalla massa;
- segni di infiammazione locale: la pelle nella zona dell’anca può apparire arrossata e risultare calda al tatto. In alcuni casi, può essere presente un lieve versamento articolare, con accumulo di liquido nell’articolazione.
Sebbene meno comuni, alcuni pazienti possono presentare sintomi sistemici legati alla diffusione dei detriti metallici nel flusso sanguigno o alla risposta immunitaria sistemica. Questi includono:
- affaticamento generale: alcuni pazienti riferiscono una sensazione di stanchezza persistente, che può essere legata all’infiammazione cronica o alla tossicità sistemica dei metalli;
- sintomi neurologici: in rari casi, i detriti metallici possono raggiungere il sistema nervoso, causando sintomi come formicolio, intorpidimento o debolezza muscolare. Questi sintomi sono più comuni nei pazienti con livelli molto elevati di ioni metallici nel sangue;
- sintomi cardiaci o endocrini: livelli elevati di cromo e cobalto nel sangue sono stati associati a potenziali effetti tossici sul cuore e sul sistema endocrino, sebbene questi casi siano rari.
Now loading…
Diagnosi
La diagnosi dello pseudotumore Metal-on-Metal (MoM) è un processo che richiede un approccio multidisciplinare e l’uso di diverse tecniche per confermare la presenza della condizione, valutarne l’estensione ed escludere altre patologie. La diagnosi precoce è fondamentale per prevenire danni irreversibili ai tessuti e garantire un trattamento efficace.

Il primo passo nella diagnosi dello pseudotumore è una valutazione clinica approfondita, che include:
- anamnesi: il medico raccoglie informazioni sulla storia clinica del paziente, inclusi i dettagli dell’intervento chirurgico (tipo di protesi, data dell’impianto) e la comparsa dei sintomi.
Viene indagata la presenza di dolore persistente, gonfiore, limitazione del movimento o altri sintomi sospetti.
È importante sapere se il paziente ha una storia di allergie ai metalli o altre reazioni avverse; - esame fisico: valutando la presenza di gonfiore, masse palpabili o segni di infiammazione locale (arrossamento, calore).
Viene testata la mobilità dell’anca e la presenza di dolore durante il movimento o alla palpazione.
Si cerca di identificare eventuali segni di debolezza muscolare o atrofia.
Gli esami del sangue sono uno strumento chiave per supportare la diagnosi di pseudotumore MoM. I test più utilizzati includono:
- livelli di ioni metallici: la misurazione dei livelli di cromo e cobalto nel sangue è un indicatore importante dell’usura della protesi. Valori elevati di questi ioni suggeriscono un’eccessiva usura delle superfici metalliche e un aumento del rischio di complicazioni.
I livelli di riferimento variano, ma generalmente valori superiori a 7 µg/L per il cromo e 5 µg/L per il cobalto sono considerati anormali. - indici infiammatori: esami come la proteina C-reattiva (PCR) e la velocità di sedimentazione degli eritrociti (VES) possono indicare la presenza di infiammazione. Questi marcatori non sono specifici, ma possono supportare la diagnosi in combinazione con altri risultati.
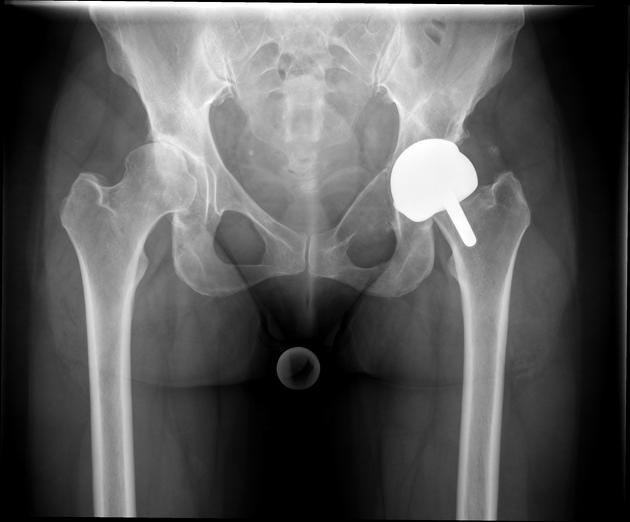
L’imaging è fondamentale per visualizzare la protesi, i tessuti circostanti e identificare la presenza di uno pseudotumore. Le tecniche più utilizzate includono:
- radiografie (RX): possono mostrare segni di usura, malposizionamento della protesi o osteolisi (perdita di tessuto osseo). Tuttavia, non sono sufficienti per identificare uno pseudotumore, poiché non forniscono dettagli sui tessuti molli;
- Risonanza Magnetica (MRI): è lo strumento più efficace per diagnosticare uno pseudotumore MoM. Grazie a sequenze specifiche, come quelle a soppressione del segnale del metallo (MARS, Metal Artifact Reduction Sequences), la MRI può fornire immagini dettagliate dei tessuti molli, identificando masse, accumuli di liquido e segni di infiammazione.
La MRI è particolarmente utile per valutare l’estensione del danno tissutale e pianificare l’intervento chirurgico; - Tomografia Computerizzata (TC): fornisce immagini dettagliate delle strutture ossee e dei tessuti molli, utili per valutare il posizionamento della protesi e l’eventuale usura delle superfici metalliche. Anche la TC può essere migliorata con tecniche di riduzione degli artefatti metallici;
- ecografia: può essere utilizzata per identificare accumuli di liquido o masse nei tessuti molli. È meno costosa e più accessibile rispetto alla MRI, ma meno precisa nella valutazione delle strutture profonde.
L’analisi del liquido sinoviale può fornire informazioni preziose per la diagnosi. L’artrocentesi consiste nel prelievo di un campione di liquido dall’articolazione dell’anca. Il liquido viene analizzato per la presenza di detriti metallici, cellule infiammatorie e segni di infezione. Questo esame è particolarmente utile per escludere altre cause di dolore, come un’infezione della protesi.
In alcuni casi, può essere utilizzata la scintigrafia ossea. Questa tecnica prevede l’iniezione di un tracciante radioattivo che si accumula nelle aree di aumentata attività metabolica. Può mostrare aree di infiammazione o usura intorno alla protesi, ma è meno specifica rispetto alla MRI o alla CT.
Diagnosi Differenziale
È importante distinguere lo pseudotumore MoM da altre condizioni che possono causare sintomi simili, tra cui:
- infezione della protesi: aausa dolore, gonfiore e infiammazione, ma è associata a febbre, elevati marcatori infiammatori e segni sistemici di infezione;
- osteolisi: perdita di tessuto osseo dovuta a una reazione ai detriti di polietilene (nelle protesi non MoM);
- tumori maligni: rari, ma devono essere esclusi attraverso biopsia e imaging avanzato.
Now loading…
Trattamento
Il trattamento è un processo complesso che richiede un approccio personalizzato, basato sulla gravità della condizione, i sintomi del paziente e l’entità del danno tissutale. L’obiettivo principale è alleviare il dolore, prevenire ulteriori danni ai tessuti e ripristinare la funzionalità dell’anca.
In alcuni casi, soprattutto quando i sintomi sono lievi e non vi è un danno tissutale significativo, il medico può optare per un approccio conservativo. Questo include:
- monitoraggio regolare: controlli periodici per valutare i livelli di ioni metallici nel sangue (cromo e cobalto) e l’evoluzione dei sintomi;
- imaging di follow-up: radiografie o risonanze magnetiche (MRI) per monitorare lo stato della protesi e dei tessuti circostanti;
- modifica dell’attività fisica: riduzione delle attività ad alto impatto per minimizzare l’usura della protesi.
Tuttavia, questo approccio è raramente definitivo, poiché lo pseudotumore MoM tende a peggiorare nel tempo senza un intervento chirurgico.
La revisione chirurgica è il trattamento principale, soprattutto nei casi sintomatici o con danno tissutale significativo. L’intervento prevede la rimozione della protesi MoM, insieme ai detriti metallici e ai tessuti necrotici, per interrompere la fonte di infiammazione, e la sua sostituzione con materiali alternativi come ceramica o polietilene, che hanno un rischio molto più basso di generare reazioni avverse rispetto alle superfici metalliche.
La scelta del materiale dipende dalle condizioni del paziente e dalle preferenze del chirurgo. In genere pazienti giovani potrebbero beneficiare di protesi più resistenti all’usura, come quelle in ceramica.
In alcuni casi, lo pseudotumore MoM può causare complicazioni che richiedono un trattamento specifico:
- infezioni: se è presente un’infezione, può essere necessario un trattamento antibiotico prolungato o un intervento chirurgico aggiuntivo per rimuovere il tessuto infetto;
- danni ai tessuti molli, come muscoli, nervi o vasi sanguigni possono richiedere una ricostruzione chirurgica o terapie riabilitative.
- tossicità sistemica: nei rari casi in cui i detriti metallici hanno causato effetti sistemici (ad esempio, tossicità cardiaca o neurologica), può essere necessario un trattamento multidisciplinare con specialisti di altre aree mediche.
Dopo l’intervento chirurgico, il paziente segue un programma di riabilitazione per ripristinare la funzionalità dell’anca e prevenire complicazioni. Questo include esercizi di fisioterapia per migliorare la forza muscolare, la flessibilità e la mobilità articolare, l’utilizzo di farmaci antinfiammatori o analgesici per controllare il dolore post-operatorio e il monitoraggio a lungo termine.
Prognosi
La prognosi dopo il trattamento dello pseudotumore MoM dipende da diversi fattori, tra cui:
- tempestività dell’intervento: una diagnosi e un trattamento precoci migliorano significativamente i risultati;
- estensione del danno tissutale: i pazienti con danni limitati hanno una prognosi migliore rispetto a quelli con danni estesi;
- qualità della revisione chirurgica: un intervento ben eseguito riduce il rischio di recidiva e complicazioni.
Nella maggior parte dei casi, i pazienti sperimentano un significativo miglioramento dei sintomi e della qualità della vita dopo la revisione chirurgica.
Ritiro e controversie legali
A causa di questa complicazione, le protesi d’anca Metal-on-Metal (MoM) hanno sollevato preoccupazioni globali. Questi problemi hanno portato a ritiri e restrizioni da parte delle autorità regolatorie, oltre a numerose controversie legali.
Nel 2017, l’EMA ha concluso che i rischi delle protesi MoM superano i benefici per la maggior parte dei pazienti. Di conseguenza, ha raccomandato il ritiro dal mercato delle protesi MoM con superfici di sfregamento in metallo, consentendone l’uso solo in casi eccezionali con monitoraggio rigoroso.
In Italia, il Ministero della Salute e l’AIFA hanno adottato linee guida simili a quelle dell’EMA. Sono state avviate campagne di monitoraggio per i pazienti con protesi MoM, con controlli regolari dei livelli di ioni metallici (cromo e cobalto) e imaging. Alcuni modelli di protesi MoM sono stati ritirati dal mercato, e i pazienti sono stati informati sui rischi e sui sintomi delle complicazioni.
Le complicazioni delle protesi MoM hanno portato a cause legali e class action in tutto il mondo. Produttori come DePuy Orthopaedics (Johnson & Johnson), Zimmer Biomet e Stryker sono stati citati in giudizio per danni causati da modelli difettosi.

Le protesi Metal-on-Metal rappresentano un capitolo controverso nella storia dell’ortopedia. Le numerose controversie legali hanno ulteriormente evidenziato i rischi associati a queste protesi, portando a un cambiamento significativo nella scelta dei materiali per le protesi d’anca. Oggi, le alternative come ceramica-ceramica o metallo-polietilene sono preferite per il loro profilo di sicurezza più favorevole. Tuttavia, i pazienti che hanno ricevuto protesi MoM in passato richiedono un monitoraggio continuo per identificare e trattare eventuali complicazioni tempestivamente.
Fonti
- American Academy of Orthopaedic Surgeons (AAOS)
Linee guida e raccomandazioni sulle protesi d’anca e le complicazioni associate.
Disponibile su: https://www.aaos.org- Food and Drug Administration (FDA)
Avvisi e report sulla sicurezza delle protesi Metal-on-Metal (MoM).
Disponibile su: https://www.fda.gov- PubMed
Studi scientifici e articoli di ricerca su pseudotumori MoM e complicazioni delle protesi d’anca.
Disponibile su: https://pubmed.ncbi.nlm.nih.gov- The Journal of Bone and Joint Surgery (JBJS)
Articoli di revisione e casi clinici sulle protesi MoM e le loro complicazioni.
Disponibile su: https://journals.lww.com/jbjsjournal/pages/default.aspx- British Orthopaedic Association (BOA)
Linee guida e documenti tecnici sulle protesi d’anca e le reazioni avverse ai metalli.
Disponibile su: https://www.boa.ac.uk- The Lancet
Pubblicazioni su studi clinici e revisioni sistematiche relative alle protesi MoM.
Disponibile su: https://www.thelancet.com- National Institute for Health and Care Excellence (NICE)
Linee guida cliniche per la gestione delle protesi d’anca e delle complicazioni associate.
Disponibile su: https://www.nice.org.uk- Smith, A. J., et al. (2012)
“Failure rates of metal-on-metal hip implants: A systematic review.”
The Lancet, 379(9822), 1199-1204.
DOI: 10.1016/S0140-6736(12)60353-5- Langton, D. J., et al. (2011)
“Adverse reaction to metal debris following hip resurfacing: The influence of component type, orientation, and volumetric wear.”
Journal of Bone and Joint Surgery, 93(12), 1649-1656.
DOI: 10.2106/JBJS.J.01193