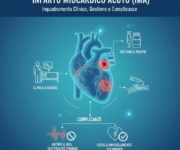
La cardiopatia ischemica è la più frequente patologia cardiovascolare nei Paesi sviluppati. Essa deriva da uno squilibrio tra il fabbisogno miocardico di ossigeno e il suo effettivo apporto, che può essere causato da una riduzione del flusso coronarico o da un aumento della richiesta di ossigeno da parte del cuore.
Il suo sviluppo è influenzato da numerosi fattori di rischio, alcuni non modificabili, legati a predisposizione genetica e fisiologica, e altri modificabili, sui quali è possibile intervenire per prevenire o rallentare la progressione della malattia.
| Fattori di rischio NON modificabili | Fattori di rischio MODIFICABILI |
|---|---|
| Età avanzata (uomini >45 anni, donne >55 anni o post-menopausa) | Ipertensione arteriosa |
| Sesso maschile | Diabete mellito |
| Familiarità per cardiopatia ischemica precoce (uomini <55 anni; donne <65 anni) | Dislipidemia (↑ LDL, ↓ HDL, ↑ trigliceridi) |
| Polimorfismi genetici (es. gene ECA) | Fumo di sigaretta |
| Obesità, in particolare viscerale | |
| Vita sedentaria | |
| Dieta non equilibrata | |
| Iperomocisteinemia | |
| Iperfibrinogenemia | |
| ↑ Lipoproteina(a) [Lp(a)] | |
| ↑ Proteina C reattiva (PCR) | |
| ↑ BNP (peptide natriuretico cerebrale) | |
| Infiammazione cronica sistemica (es. artrite reumatoide, lupus) | |
| Iperparatiroidismo |
Cause di ridotto apporto di ossigeno al miocardio
Il ridotto apporto di ossigeno rappresenta una delle principali componenti fisiopatologiche dell’ischemia miocardica. Questo squilibrio può derivare da meccanismi diversi, tra cui un’ostruzione del flusso coronarico, una riduzione della capacità del sangue di trasportare ossigeno o alterazioni della regolazione del flusso a livello microvascolare.
Aterosclerosi coronarica
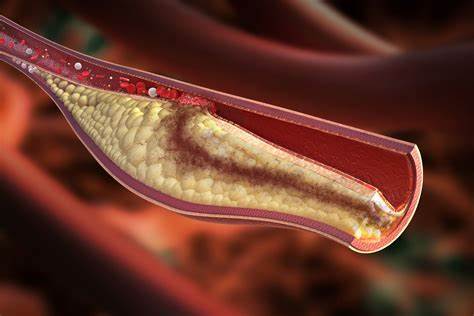
La causa più frequente di ischemia è l’aterosclerosi, una condizione cronica caratterizzata da un processo infiammatorio dell’intima vasale, con formazione di placche lipidiche che determinano stenosi o occlusione del lume arterioso. Le coronarie sono coinvolte in modo preferenziale nei tratti prossimali, soprattutto a livello della discendente anteriore e della circonflessa.
La lesione inizia con l’accumulo subendoteliale di lipoproteine aterogene (LDL, IDL, VLDL, Lp(A)), seguito da infiltrazione di monociti e linfociti T, con conseguente attivazione dell’endotelio e rilascio di citochine pro-infiammatorie (es. IL-1β, TNF-α). La disfunzione endoteliale è marcata da una ridotta produzione di ossido nitrico (NO) e dall’aumento dell’espressione di molecole di adesione come VCAM-1 e ICAM-1, che favoriscono il reclutamento di cellule infiammatorie.
Quando la placca diventa instabile, può rompersi, attivando la cascata coagulativa e portando alla formazione di un trombo occlusivo, evento responsabile dell’infarto miocardico acuto.
Cause non aterosclerotiche di ridotto flusso coronarico
Sebbene meno comuni, esistono diverse condizioni patologiche che possono compromettere il flusso ematico coronarico in assenza di aterosclerosi significativa:
- embolia coronarica: può derivare da trombi intracardiaci (es. in fibrillazione atriale), emboli settici (endocarditi) o da materiali introdotti iatrogenicamente durante procedure diagnostiche o interventistiche. Anche i tumori cardiaci (es. mixoma atriale) possono essere fonte emboligena;
- vasospasmo coronarico: tipico dell’angina di Prinzmetal, è causato da una contrazione transitoria e intensa della muscolatura liscia della parete arteriosa. Il fenomeno può verificarsi sia in arterie angiograficamente normali sia in presenza di placche aterosclerotiche. Il meccanismo è legato a una iperreattività vascolare e a disfunzione endoteliale;
- arteriti coronariche: processi infiammatori a carico delle arterie coronarie si osservano in malattie sistemiche come il lupus eritematoso sistemico, la poliarterite nodosa, l’arterite di Takayasu, ma anche in contesti infettivi (es. aortite sifilitica);
- anomalie congenite delle coronarie: includono varianti anatomiche con decorso anomalo (es. interarterioso tra aorta e polmonare), che possono determinare compressione dinamica del vaso e ischemia miocardica anche in giovani atleti;
- stenosi ostiale iatrogena: può verificarsi come complicanza tardiva di procedure chirurgiche (es. reimpianto coronarico, trapianto cardiaco) o per effetti fibrotici da radioterapia mediastinica.
Riduzione del contenuto arterioso di ossigeno
In presenza di coronarie normali o con stenosi non significative, l’ischemia può comunque manifestarsi se la capacità del sangue di trasportare ossigeno è compromessa.
- anemia: la ridotta concentrazione di emoglobina riduce il contenuto arterioso di ossigeno, rendendo il miocardio vulnerabile, soprattutto sotto sforzo o in pazienti con stenosi coronariche subcritiche;
- carbossiemoglobinemia: causata da esposizione a monossido di carbonio (CO), che si lega con alta affinità all’emoglobina, riducendone la disponibilità per l’ossigeno;
- ipossiemia: presente in condizioni respiratorie croniche (BPCO, fibrosi polmonare) o in alta quota, riduce la pressione parziale di ossigeno nel sangue arterioso e può precipitare una crisi ischemica.
Alterazioni della microcircolazione coronarica
Alcune condizioni patologiche possono alterare il meccanismo di autoregolazione del flusso a livello della microvascolatura, senza lesioni angiograficamente visibili.
- angina microvascolare (o sindrome X): si verifica prevalentemente in donne e si associa ad alterazioni funzionali del microcircolo coronarico, probabilmente legate a disfunzione endoteliale o alterazioni del tono vasale;
- angina variante (Prinzmetal): come già detto, è causata da vasospasmo, ma può interessare anche vasi di piccolo calibro.
Cause di aumento della domanda di ossigeno miocardico
Il miocardio consuma ossigeno in proporzione al lavoro che svolge: qualsiasi condizione che aumenti frequenza cardiaca, contrattilità, postcarico o precarico comporta un incremento della richiesta metabolica, che può non essere compensata da un adeguato apporto coronarico, specialmente in presenza di stenosi preesistenti. Ecco le principali condizioni che determinano questo squilibrio.
- Ipertrofia miocardica
L’ipertrofia del ventricolo sinistro, conseguenza di condizioni croniche come ipertensione arteriosa o stenosi aortica, comporta un aumento della massa muscolare cardiaca. Questo accrescimento richiede un maggior apporto di ossigeno, ma spesso non si accompagna a una crescita parallela del microcircolo coronarico. Ne consegue un disaccoppiamento tra domanda e perfusione.
L’ipertrofia contribuisce anche a una riduzione della compliance diastolica, aggravando l’ischemia subendocardica in fase di riempimento. - Tachiaritmie e aritmie ad alta frequenza
Le tachiaritmie, come la fibrillazione atriale ad alta risposta ventricolare, le tachicardie sopraventricolari o la tachicardia ventricolare non sostenuta, aumentano la frequenza cardiaca, accorciando il tempo di perfusione coronarica (che avviene in diastole) e incrementando la richiesta energetica del miocardio.
Anche in assenza di stenosi coronariche significative, una tachiaritmia può precipitare un’ischemia miocardica. - Aumento del postcarico e del precarico
Qualsiasi condizione che comporti un sovraccarico pressorio (come la stenosi aortica o l’ipertensione sistemica acuta) o di volume (come l’insufficienza aortica o mitralica severa) implica un lavoro maggiore del ventricolo sinistro, con incremento del consumo di ossigeno.
Il sovraccarico cronico induce ipertrofia, aggravando la richiesta metabolica. - Stati ipermetabolici sistemici
Condizioni che aumentano il metabolismo basale, come ipertiroidismo, febbre alta o sepsi, stati ipercinetici (es. anemie severe), gravidanza avanzata o ipossia cronica possono determinare una condizione di “stress sistemico” che spinge il cuore a un’attività aumentata per mantenere l’omeostasi, con conseguente incremento della richiesta miocardica di ossigeno. - Stimoli farmacologici e sostanze simpaticomimetiche
Farmaci e sostanze che stimolano il sistema simpatico aumentano la frequenza cardiaca e la contrattilità miocardica. Queste sostanze non solo aumentano la richiesta di ossigeno, ma possono anche provocare vasocostrizione coronarica e aritmie. Tra questi:- Catecolamine esogene (dopamina, dobutamina, adrenalina).
- Farmaci simpaticomimetici (es. salbutamolo in alte dosi).
- Sostanze d’abuso: cocaina, anfetamine, ecstasy.
- Sforzo fisico intenso o stress emotivo acuto
L’esercizio fisico intenso o uno stress acuto (ad esempio un forte spavento) stimolano il rilascio massivo di catecolamine, con aumento di frequenza e contrattilità cardiaca. In soggetti predisposti può scatenarsi ischemia miocardica, come nel caso della:- Sindrome di Takotsubo (cardiomiopatia da stress).
- Infarto da domanda in coronaropatia cronica.
Anatomia patologica dell’aterosclerosi coronarica
Come già detto, l’aterosclerosi è una malattia cronica dell’intima arteriosa caratterizzata dall’accumulo progressivo di lipidi, cellule infiammatorie, cellule muscolari lisce e matrice extracellulare. Questo processo porta alla formazione di placche ateromasiche che alterano l’anatomia e la funzionalità vascolare.
Queste placche possono determinare diversi scenari clinici: una crescita progressiva che occlude il lume vascolare, la rottura con conseguente trombosi acuta oppure un rimodellamento vasale con perdita di elasticità. A livello coronarico, le sedi più frequentemente coinvolte sono i tratti prossimali dell’arteria discendente anteriore (IVA) e della circonflessa.
Aspetti istologici della placca
Dal punto di vista microscopico, la placca aterosclerotica è composta da:
- neoangiogenesi, che può portare a microemorragie intraplacca;
- un nucleo lipidico centrale ricco di colesterolo libero, detriti cellulari e macrofagi schiumosi;
- un cappuccio fibroso, la cui stabilità è determinante nel rischio di rottura;
- infiltrato infiammatorio, prevalentemente costituito da macrofagi e linfociti T.
Stadi anatomo-patologici dell’aterosclerosi
L’evoluzione della placca è stata classificata in cinque stadi, basati sull’evidenza morfologica e sul rischio clinico.
- Stadio 1 – Lesione precoce (stria grassa)
Questa fase rappresenta il primo stadio dell’aterogenesi. Si osservano depositi di lipidi all’interno dei macrofagi, con formazione di cellule schiumose. È una lesione tipica dei giovani e può essere reversibile con il controllo dei fattori di rischio. Le strie grasse non determinano restringimenti significativi del lume arterioso. - Stadio 2 – Placca instabile (inizio dell’infiammazione attiva)
Caratterizzato da un’intensa infiltrazione infiammatoria, favorita da molecole di adesione endoteliale come VCAM-1. I lipidi iniziano ad accumularsi anche nello spazio extracellulare e il cappuccio fibroso è sottile. Queste placche sono instabili, spesso non stenosanti, ma a rischio elevato di rottura, rappresentando la causa principale degli eventi coronarici acuti. - Stadio 3 – Placca avanzata con stenosi
In questo stadio la placca cresce, il cappuccio fibroso diventa più spesso e il nucleo lipidico si stabilizza. La progressiva riduzione del lume arterioso porta a ischemia da sforzo. La formazione di circolazione collaterale può compensare parzialmente il ridotto apporto ematico. Clinicamente, è l’equivalente dell’angina stabile. - Stadio 4 – Placca complicata
Si verifica la rottura del cappuccio fibroso o l’erosione dell’endotelio, con esposizione del nucleo lipidico al sangue. Questo innesca la cascata coagulativa e la formazione di un trombo. Può verificarsi un’occlusione completa o subtotale del vaso. È la base anatomo-patologica della sindrome coronarica acuta (IMA, angina instabile). - Stadio 5 – Riorganizzazione fibrotica o occlusione cronica
Il trombo, se non completamente rimosso, può organizzarsi in tessuto fibroso. Si distinguono:- stadio 5 occlusivo, se il lume viene completamente obliterato;
- stadio 5 non occlusivo, se persiste un passaggio residuo ematico.
Queste lesioni possono determinare ischemia cronica silente o angina stabile, a seconda del grado di flusso residuo e della presenza di circoli collaterali.
Dal punto di vista clinico, è importante sottolineare che le placche più pericolose non sono sempre le più stenotiche, ma quelle instabili (stadio 2), con cappuccio sottile e ricco contenuto lipidico. La valutazione del rischio non può basarsi solo sull’entità della stenosi angiografica.
La componente infiammatoria dell’aterosclerosi è oggi riconosciuta come centrale nella sua fisiopatologia. Per questo motivo, biomarcatori come la proteina C reattiva ad alta sensibilità (hs-CRP) o la lipoproteina(a) hanno acquisito importanza nel profilo di rischio cardiovascolare.

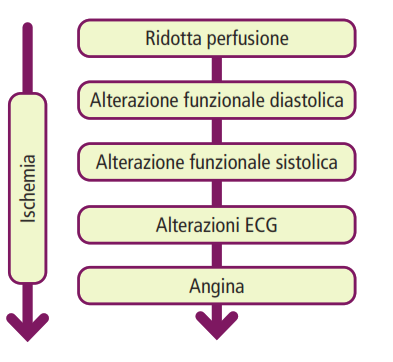
Fasi della cascata ischemica
La cascata ischemica è un insieme di eventi fisiopatologici che si verificano quando il miocardio (il muscolo cardiaco) non riceve un apporto sufficiente di ossigeno, a causa di una riduzione del flusso sanguigno coronarico. Questo fenomeno è alla base della cardiopatia ischemica, ed è fondamentale per capire la progressione del danno miocardico che porta a sintomi come angina o addirittura infarto miocardico acuto.
Le fasi principali di questa cascata sono:
- Deficit di perfusione miocardica (iperemia ischemica)
La fase iniziale della cascata ischemica si verifica quando una stenosi coronarica (riduzione del diametro del vaso) o un trombo coronarico impediscono un flusso sanguigno adeguato al miocardio. La perfusione miocardica diminuisce, portando a una riduzione dell’ossigeno disponibile per i cardiomiociti (cellule muscolari cardiache).- Fattori: aterosclerosi, trombosi, spasmo coronarico, malformazioni vascolari.
- Effetti: riduzione del flusso ematico, con ossigeno insufficiente per il corretto funzionamento dei cardiomiociti.
- Ischemia subendocardica
Il miocardio ha una distribuzione vascolare non uniforme, e la zona più vulnerabile a diventare ischemica è quella più profonda (sottocutanea) della parete ventricolare, ovvero il miocardio subendocardico.- Fattori: la ridotta perfusione si manifesta prima nelle aree più lontane dal flusso coronarico, in particolare nelle regioni più profonde.
- Effetti: le cellule cardiache subiscono un sopraccarico di sodio e calcio e una riduzione dell’ATP, con conseguente disfunzione miocardica.
- Disfunzione diastolica (Insufficienza di rilassamento miocardico)
La carenza di ossigeno danneggia la capacità del miocardio di rilassarsi correttamente, compromettendo la fase di diastole (fase di riempimento ventricolare).- Fattori: la disfunzione diastolica è uno degli stadi precoci dell’ischemia, ed è il risultato di un’incapacità del muscolo cardiaco di rilassarsi correttamente a causa della carenza di ATP e del danno a livello cellulare.
- Effetti: alterazione della compliance ventricolare, che può portare a ritenzione di liquidi e sintomi di congestione.
- Disfunzione sistolica (Diminuzione della contrattilità miocardica)
Con il persistere dell’ischemia, si sviluppa una disfunzione sistolica: la capacità di contrazione del muscolo cardiaco viene compromessa. Questo stadio è associato a una riduzione della contrattilità segmentaria del cuore.- Fattori: l’ischemia prolungata porta a danni irreversibili ai miociti (cellule muscolari cardiache), che non sono più in grado di contrarsi in modo efficace.
- Effetti: inizialmente si osserva ipocinesia (ridotta contrattilità) in alcune porzioni del cuore, che può progredire fino a akinesia (assenza di contrazione) in caso di infarto.
- Alterazioni elettrocardiografiche (ECG)
Le alterazioni nel flusso sanguigno coronarico e la disfunzione del muscolo cardiaco alterano l’attività elettrica del cuore, producendo modifiche nell’ECG.- Fattori: il danno ischemico compromette il normale potenziale d’azione dei miociti, con conseguente comparsa di onde T alte, inversione dell’onda T, o depressione del tratto ST.
- Effetti: le alterazioni dell’ECG sono spesso tra le prime manifestazioni di ischemia miocardica e precedono la comparsa di sintomi clinici evidenti come l’angina.
- Sintomi clinici (Dolore anginoso)
Il dolore anginoso (angina pectoris) è il sintomo classico che si manifesta quando la domanda di ossigeno del miocardio supera la sua fornitura. È tipicamente localizzato nel torace, ma può irradiarsi anche verso il braccio sinistro, la mandibola e la schiena.- Fattori: la diminuzione del flusso sanguigno coronarico riduce l’ossigenazione del miocardio, causando l’accumulo di metaboliti (come acido lattico) che stimolano i recettori del dolore.
- Effetti: il dolore anginoso è un segnale che il miocardio sta soffrendo e che il danno ischemico potrebbe evolvere verso un infarto se il flusso non viene ripristinato.
- Infarto miocardico (Ischemia persistente)
Se l’ischemia persiste, il danno al miocardio diventa irreversibile, portando a necrosi delle cellule cardiache. Questo stadio è conosciuto come infarto miocardico acuto (IMA).- Fattori: Occlusione completa e persistente di una coronaria, tipicamente causata da trombosi su placca aterosclerotica.
- Effetti: La necrosi miocardica è seguita dalla formazione di un tessuto cicatriziale, con conseguenti alterazioni nella funzione cardiaca a lungo termine.
La cascata ischemica è un processo che coinvolge diverse fasi, dalla riduzione della perfusione miocardica fino alla necrosi irreversibile del miocardio. La sua progressione può essere intercettata e rallentata se trattata precocemente con interventi terapeutici, che mirano a migliorare la perfusione coronarica, ridurre la domanda di ossigeno del miocardio e prevenire il danno irreversibile.
Fonte: Manuale di cardiologia, chirurgia vascolare e cardiochirurgia. Concorso Nazionale SSM.