La fibrillazione ventricolare (FV) rappresenta una delle emergenze cardiologiche più critiche e tempo-dipendenti. Si tratta di un’aritmia maligna caratterizzata da attività elettrica caotica dei ventricoli, che impedisce qualsiasi contrazione efficace del miocardio e compromette istantaneamente la gittata cardiaca. In assenza di intervento immediato, la FV conduce rapidamente ad arresto cardiaco e morte.
Fisiopatologia della fibrillazione ventricolare
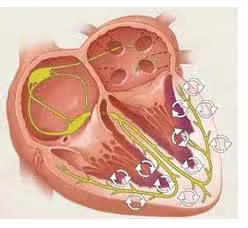
La FV è il risultato di una grave instabilità dell’attività elettrica dei ventricoli, in cui i normali meccanismi di attivazione e conduzione sono completamente sovvertiti.
In condizioni fisiologiche, l’impulso cardiaco si origina nel nodo senoatriale, si propaga ordinatamente attraverso l’atrio, il nodo atrioventricolare, il fascio di His e le fibre del Purkinje, determinando una contrazione ventricolare sincrona, efficace e coordinata.
Nella FV, questo ordine viene totalmente perso: si instaura un’attività elettrica rapida, frammentata e disorganizzata, che origina impulsi multipli, spesso localizzati in aree ischemiche o fibrotiche del miocardio, i quali si autoalimentano in circuiti di rientro multiplo (multiple wavelets).
I meccanismi principali che contribuiscono all’instaurarsi della FV includono:
- aumentata automatismo anomalo: in condizioni di ischemia acuta o stress catecolaminergico, alcune cellule miocardiche possono generare spontaneamente impulsi non fisiologici;
- attività da rientro: è il meccanismo più frequentemente implicato. Un’alterazione della conduzione (es. per ischemia, fibrosi, anomalie ioniche) crea un circuito chiuso dove l’impulso continua a girare, eccitando ripetutamente il tessuto circostante;
- attività triggered (post-potenziali): alterazioni del calcio intracellulare possono determinare scariche premature durante la fase di ripolarizzazione.
Questi impulsi caotici provocano un’attivazione continua e asincrona delle fibre muscolari ventricolari, impedendo la contrazione globale del ventricolo.
Condizioni predisponenti
La FV si sviluppa quasi sempre su un substrato patologico preesistente. Le cause principali includono:
- ischemia miocardica acuta (infarto STEMI/NSTEMI);
- cardiomiopatie (dilatative, ipertrofiche, aritmogene del ventricolo destro);
- disturbi elettrolitici (ipopotassiemia, ipomagnesiemia);
- sindrome del QT lungo (congenita o farmaco-indotta);
- canalopatie ereditarie (es. sindrome di Brugada, sindrome del QT corto, CPVT);
- tossicità da farmaci o sostanze (es. antiaritmici, cocaina, digossina);
- shock elettrico diretto o trauma toracico (commotio cordis).
Conseguenze
Dal punto di vista funzionale, durante la FV il miocardio ventricolare è in costante attività elettrica disorganizzata, ma incapace di sviluppare una contrazione meccanica efficace. Ne consegue:
- assenza di gittata cardiaca;
- caduta immediata della pressione arteriosa;
- sospensione del flusso cerebrale e coronarico;
- perdita di coscienza entro 5–10 secondi;
- anossia cerebrale e danno neuronale irreversibile dopo 4–6 minuti.
L’assenza di un ritmo meccanicamente valido rende inutile qualsiasi intervento che non sia finalizzato a ripristinare la contrattilità sincronizzata, ossia la defibrillazione.
Se non trattata, la FV evolve progressivamente verso una riduzione dell’ampiezza delle onde fibrillatorie (fibrillazione “fine”) fino alla cessazione completa dell’attività elettrica ventricolare. Questo stadio terminale, l’asistolia, è associato a un tasso di sopravvivenza estremamente basso, anche in caso di intervento avanzato.
La defibrillazione: unica terapia efficace e da eseguire subito
Nel contesto della fibrillazione ventricolare (FV), la defibrillazione elettrica rappresenta l’intervento cardine per ristabilire un ritmo cardiaco efficace. Si tratta di una manovra salvavita che agisce direttamente sull’origine elettrica dell’aritmia, ponendo fine al caos elettrofisiologico che rende il cuore incapace di pompare sangue. A differenza dei farmaci, che richiedono tempo per agire e possono risultare inefficaci in situazioni estreme, la defibrillazione ha un impatto immediato ed è l’unica strategia realmente risolutiva in caso di FV o tachicardia ventricolare senza polso (TVSP).
Dal punto di vista fisiologico, lo shock elettrico fornito dal defibrillatore induce una depolarizzazione simultanea di un ampio numero di cellule miocardiche. Questa depolarizzazione globale ha lo scopo di interrompere le onde multiple e disorganizzate di attivazione elettrica che caratterizzano la FV. Così facendo, si ottiene una sorta di “reset” elettrico che azzera i circuiti di rientro e consente al nodo senoatriale di riprendere il comando, ristabilendo un ritmo sinusale organizzato.
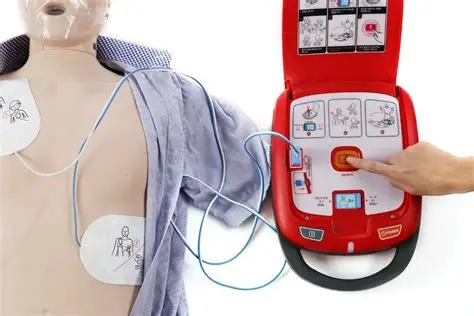
Esistono diverse modalità di defibrillazione, a seconda del tipo di dispositivo e del contesto clinico. In ambito extraospedaliero e nelle prime fasi dell’emergenza, si utilizzano defibrillatori esterni, manuali o semiautomatici. Questi ultimi, noti come DAE (defibrillatori automatici esterni), sono progettati per essere utilizzati anche da personale non ospedaliero: analizzano autonomamente il ritmo cardiaco e autorizzano lo shock solo in presenza di un’aritmia defibrillabile. In ambito intraospedaliero, o durante procedure cardiochirurgiche, si può ricorrere alla defibrillazione interna, o all’utilizzo di dispositivi impiantabili come i defibrillatori cardioverter (ICD), indicati nei pazienti a rischio di aritmie ventricolari ricorrenti.
L’efficacia della defibrillazione dipende da molteplici fattori. Innanzitutto, la tempestività è cruciale: la probabilità di sopravvivenza si riduce progressivamente con il passare dei minuti, con un calo stimato del 7–10% per ogni minuto di ritardo. Anche l’energia dello shock ha un ruolo: oggi si preferiscono defibrillatori a onda bifasica, in grado di ottenere un’adeguata depolarizzazione con energie più basse (120–200 Joule) rispetto ai vecchi modelli monofasici. Fondamentali sono inoltre il corretto posizionamento delle piastre (antero-laterale o antero-posteriore), l’impiego di gel conduttivo e la riduzione dell’impedenza toracica, tutti elementi che facilitano il passaggio della corrente e aumentano le probabilità di successo.
La defibrillazione si applica esclusivamente nei casi di fibrillazione ventricolare o di tachicardia ventricolare senza polso. Al contrario, è controindicata in presenza di asistolia o attività elettrica senza polso (PEA), condizioni che richiedono un approccio basato su massaggio cardiaco continuo, supporto ventilatorio e trattamento farmacologico, in particolare con adrenalina e ricerca delle cause reversibili.
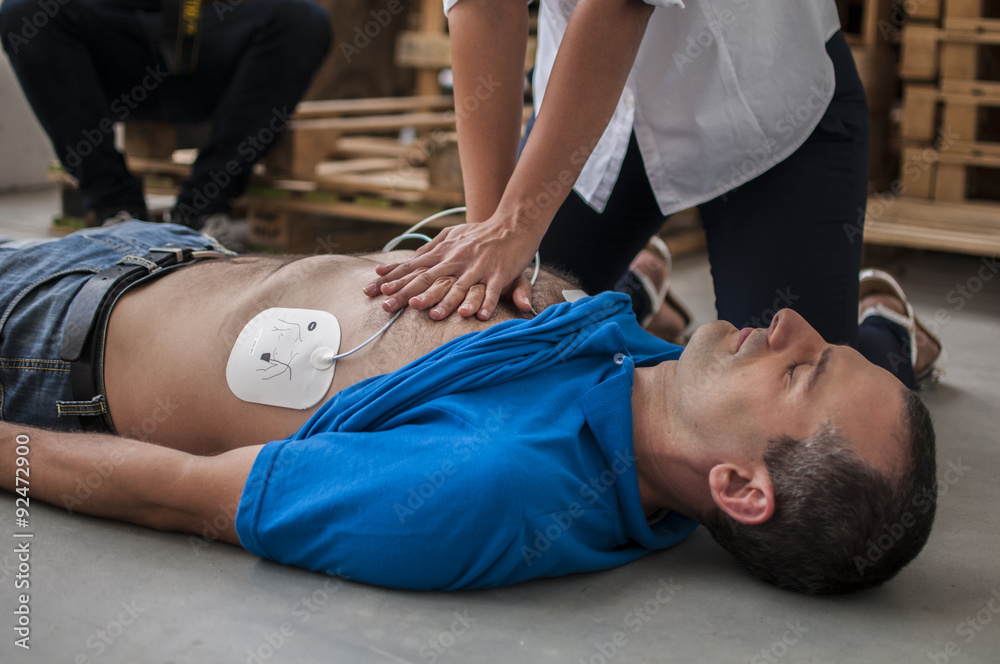
Nella pratica clinica, la defibrillazione si inserisce in una sequenza standardizzata definita dalle linee guida ACLS e BLS. Dopo aver riconosciuto un arresto cardiaco, si inizia immediatamente il massaggio toracico, mentre un altro soccorritore collega il defibrillatore. Se il ritmo analizzato risulta defibrillabile, si interrompe brevemente il massaggio per erogare lo shock e si riprende subito la rianimazione cardiopolmonare. Dopo due minuti si rivaluta il ritmo e si decide se procedere con un nuovo shock, con la somministrazione di farmaci antiaritmici (come amiodarone) o con la gestione delle cause sottostanti.
L’impatto della defibrillazione precoce sulla sopravvivenza è ben documentato. Se lo shock viene somministrato entro il primo minuto dall’arresto, le probabilità di sopravvivenza possono superare il 90%. Dopo cinque minuti, la curva di sopravvivenza si abbassa in modo drammatico, e dopo dieci minuti senza defibrillazione il tasso di esiti favorevoli è estremamente basso. Per questo motivo, la diffusione capillare dei DAE e la formazione della popolazione generale al loro utilizzo rappresentano una delle strategie più efficaci in sanità pubblica per la riduzione della mortalità extraospedaliera.
Gestione post-defibrillazione
La defibrillazione, se efficace, rappresenta solo il primo passo nel complesso percorso di recupero di un paziente colpito da arresto cardiaco. Una volta ristabilito un ritmo cardiaco organizzato, si apre una fase delicatissima in cui l’obiettivo si sposta dalla rianimazione al supporto delle funzioni vitali, alla prevenzione delle recidive aritmiche e alla valutazione delle cause sottostanti. La cosiddetta gestione post-defibrillazione è quindi un momento critico, in cui l’intervento precoce e sistematico può determinare il recupero neurologico e clinico del paziente.
Dopo l’erogazione dello shock, se il ritmo si converte in uno compatibile con la perfusione (ritmo sinusale, tachicardia a complesso stretto con polso), si deve procedere alla valutazione dei segni di ritorno della circolazione spontanea (ROSC). Tra questi, si considerano la comparsa di un polso palpabile, l’aumento della pressione arteriosa, la ripresa del respiro spontaneo, il miglioramento della saturazione e segni di coscienza.
Il ROSC, tuttavia, non deve far abbassare la guardia. È essenziale avviare subito una fase di stabilizzazione avanzata, in cui si mantengano ossigenazione, perfusione e monitoraggio continuo del ritmo.
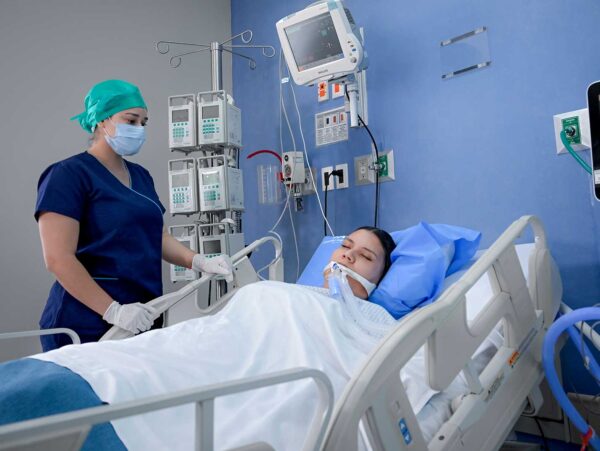
Nella maggior parte dei casi, il paziente che ha appena recuperato la circolazione richiede un supporto ventilatorio invasivo o non invasivo. L’intubazione orotracheale è spesso necessaria, soprattutto se il paziente è incosciente o in coma post-anossico. È fondamentale mantenere un’adeguata ossigenazione (SpO₂ > 94%) ed evitare l’iperossia, che potrebbe aggravare il danno ischemico-riperfusione.
Dal punto di vista emodinamico, può essere necessario il supporto con farmaci vasopressori (come noradrenalina o dopamina) per garantire una pressione arteriosa media adeguata (MAP > 65 mmHg). Il monitoraggio continuo dell’ECG, della pressione invasiva, della diuresi e della lattacidemia aiuta a valutare l’efficacia della perfusione e l’evoluzione del quadro.
Uno degli aspetti più critici del post-ROSC è la protezione del sistema nervoso centrale. Il cervello è l’organo più sensibile all’ipossia, e ogni minuto di arresto può comportare un danno progressivo e spesso irreversibile. Nei pazienti in coma post-arresto, è raccomandato il controllo mirato della temperatura (TTM), ovvero l’induzione di una leggera ipotermia terapeutica (tra 32 e 36 °C) per almeno 24 ore. Questa strategia ha dimostrato di migliorare gli esiti neurologici a lungo termine nei pazienti selezionati.
Va inoltre mantenuta una normoglicemia rigorosa, evitando sia l’iperglicemia che l’ipoglicemia, entrambe associate a prognosi peggiore. L’elettroencefalogramma può essere utile per valutare l’attività cerebrale e identificare eventuali convulsioni non evidenti clinicamente.
Una delle finalità principali della gestione post-defibrillazione è individuare la causa reversibile che ha scatenato l’aritmia. L’approccio diagnostico deve essere tempestivo e orientato. Nei pazienti con FV o TV senza polso, le cause più frequenti sono l’infarto miocardico acuto, l’ipossia, le alterazioni elettrolitiche (in particolare ipokaliemia e ipomagnesiemia), l’embolia polmonare massiva e l’intossicazione da farmaci o sostanze.
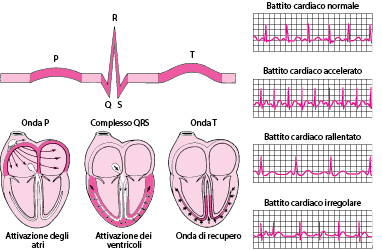
Il primo esame da eseguire è l’ECG a 12 derivazioni, che può mostrare segni di ischemia acuta (sopraslivellamento ST) e guidare verso un’eventuale coronarografia urgente. Altri esami utili includono emogasanalisi arteriosa, dosaggi ematici di elettroliti, troponina, lattato, tossicologici e imaging toracico (radiografia, ecografia o TAC, a seconda del sospetto clinico).
Una volta stabilizzato il quadro emodinamico e trattata la causa acuta, si deve valutare la necessità di una profilassi antiaritmica. Nei pazienti con instabilità elettrica persistente (TV/FV ricorrenti), può essere indicato l’impiego di farmaci come amiodarone o lidocaina. Nei casi selezionati si può considerare l’impianto di un defibrillatore automatico (ICD), soprattutto in presenza di disfunzione ventricolare sinistra o cardiomiopatie strutturali.
I pazienti che hanno avuto un arresto cardiaco con defibrillazione devono essere ricoverati in terapia intensiva cardiologica (UTIC o ICU) per il monitoraggio continuo e la gestione delle complicanze. La durata della degenza dipende dalla causa dell’arresto, dalla stabilità clinica e dalla risposta neurologica.
Dopo la dimissione, è fondamentale avviare un follow-up strutturato, che comprenda valutazioni cardiologiche, neurologiche e psicologiche. Molti pazienti sopravvissuti riferiscono sintomi da stress post-traumatico, deficit cognitivi o ansia anticipatoria di recidiva. L’approccio deve essere quindi multidisciplinare e centrato sul paziente.
Fonti: