Le patologie tiroidee rappresentano un ampio spettro di condizioni cliniche che possono influenzare significativamente la salute e il benessere dei pazienti. Tra queste, l’adenoma tossico e il gozzo tossico multinodulare (MTG) emergono come cause importanti di ipertiroidismo, una condizione caratterizzata da un’eccessiva produzione di ormoni tiroidei.
Questa condizione può svilupparsi partendo da gozzi multinodulari non tossici (MNG) che evolvono in tossici in seguito a un’esposizione eccessiva allo iodio, con ipertiroidismo che può essere subclinico o manifesto.
Il gozzo tossico multinodulare (MTG) rappresenta la seconda causa più comune di ipertiroidismo dopo la malattia di Graves. Quando è presente un singolo nodulo, si parla di adenoma tossico (noto anche come malattia di Plummer).
Epidemiologia e fattori di rischio
La prevalenza del gozzo tossico multinodulare (MTG) aumenta con l’età e in presenza di carenza di iodio. In popolazioni anziane residenti in aree con carenza iodica, il gozzo multinodulare può essere più comune della malattia di Graves. La prevalenza di MNG che evolve in MTG è in media del 5% nelle aree con sufficiente apporto di iodio e del 20% nelle aree con carenza iodica. La carenza di iodio stimola la proliferazione delle cellule tiroidee, portando eventualmente allo sviluppo di mutazioni somatiche attivanti del recettore del TSH.
Oltre alla carenza di iodio, altri fattori di rischio per lo sviluppo di MTG includono il background genetico e il sesso femminile. Uno studio epidemiologico prospettico condotto di recente in Danimarca, in un’area con carenza di iodio da lieve a moderata, ha riportato la seguente prevalenza tra le cause più frequenti di ipertiroidismo: MTG 44%, malattia di Graves 37% e adenoma tossico 6%.
Le donne, in particolare, hanno un rischio più elevato, probabilmente a causa dell’influenza degli ormoni sessuali sulla crescita tiroidea.
Patogenesi
L’adenoma tossico è causato da una mutazione somatica attivante che colpisce una parte del recettore del TSH (ormone tireostimolante). Questa mutazione porta a un’attivazione costante del recettore, come se fosse continuamente stimolato dal TSH. Poiché la mutazione interessa solo uno o più cloni cellulari (quelli che originano l’adenoma) e non la maggior parte delle altre cellule tiroidee, il parenchima tiroideo non affetto dalla mutazione mantiene una fisiologia normale di risposta al TSH.
In condizioni di TSH soppresso, il parenchima tiroideo circostante l’adenoma rimane in uno stato di quiescenza funzionale. Questo spiega perché, alla scintigrafia tiroidea, si osserva un aumentato uptake di radioiodio nel nodulo adenomatoso e un ridotto uptake nel tessuto circostante.
Il gozzo tossico multinodulare, invece, è una condizione in cui più noduli tiroidei acquisiscono la capacità di produrre ormoni tiroidei in modo autonomo. La patogenesi è più complessa e multifattoriale, come già detto, spesso associata a una lunga storia di carenza di iodio e a una predisposizione genetica.
In condizioni di carenza iodica, la tiroide cerca di compensare aumentando la captazione di iodio e stimolando la proliferazione cellulare. Questo processo, protratto nel tempo, favorisce la formazione di noduli. Alcuni di questi noduli possono sviluppare mutazioni somatiche simili a quelle osservate nell’adenoma tossico, diventando iperfunzionanti.
Anche nel MTG, mutazioni attivanti del recettore del TSH o di altre componenti della via di segnalazione del TSH (come la proteina Gsα) possono portare a un’attivazione autonoma della funzione tiroidea. Tuttavia, a differenza dell’adenoma tossico, nel MTG queste mutazioni sono presenti in più noduli.
Il passaggio da un gozzo multinodulare non tossico a uno tossico è un processo graduale. Inizialmente, i noduli sono dipendenti dal TSH, ma con il tempo, a causa di mutazioni somatiche o di alterazioni nella vascolarizzazione nodulare, alcuni noduli acquisiscono autonomia funzionale. Questo processo è accelerato in condizioni di carenza di iodio, che favorisce la proliferazione cellulare e l’instabilità genetica.
Clinica
Le manifestazioni cliniche dell’adenoma tossico e del gozzo tossico multinodulare sono principalmente legate all’ipertiroidismo, una condizione caratterizzata da un’eccessiva produzione di ormoni tiroidei (T3 e T4). Tuttavia, le due condizioni possono presentare alcune differenze nella sintomatologia, nella progressione della malattia e nelle caratteristiche fisiche riscontrabili all’esame obiettivo.
I sintomi dell’ipertiroidismo sono dovuti all’effetto sistemico degli ormoni tiroidei in eccesso, che accelerano il metabolismo e aumentano la sensibilità alle catecolamine. I pazienti possono presentare:
Caricamento….
- sintomi cardiovascolari: tachicardia, palpitazioni, ipertensione sistolica, aritmie (come la fibrillazione atriale), e in casi gravi, scompenso cardiaco;
- sintomi neuromuscolari: tremori, debolezza muscolare, affaticamento e intolleranza al calore;
- sintomi psichici: ansia, irritabilità, insonnia e labilità emotiva;
- sintomi metabolici: aumento dell’appetito con perdita di peso, sudorazione eccessiva e intolleranza al caldo;
- sintomi gastrointestinali: diarrea o aumento della frequenza delle evacuazioni;
- alterazioni cutanee: pelle calda e umida, unghie fragili e, in alcuni casi, alopecia.
Nei casi di gozzo di grandi dimensioni, possono verificarsi sintomi da compressione delle strutture vicine, come disfagia, dispnea o raucedine e disfonia.
Se non trattato, l’ipertiroidismo da adenoma tossico o MTG può portare a complicanze gravi, tra cui:
- crisi tireotossica: una condizione rara ma pericolosa per la vita, caratterizzata da un’esacerbazione acuta dei sintomi di ipertiroidismo, con febbre, tachicardia grave, agitazione e alterazioni dello stato mentale.
- complicanze cardiache: fibrillazione atriale, scompenso cardiaco e aumento del rischio di eventi tromboembolici.
- osteoporosi: l’eccesso di ormoni tiroidei può accelerare il turnover osseo, portando a una riduzione della densità minerale ossea e a un aumentato rischio di fratture.
Diagnosi
La diagnosi di adenoma tossico e gozzo tossico multinodulare richiede un approccio integrato che combina l’analisi clinica, gli esami di laboratorio e le tecniche di imaging. L’obiettivo è confermare la presenza di ipertiroidismo, identificarne la causa e valutare le caratteristiche morfologiche e funzionali della tiroide.
La diagnosi inizia con un’attenta anamnesi e un esame obiettivo per valutare la presenza di sintomi suggestivi di ipertiroidismo (tachicardia, perdita di peso, intolleranza al calore, tremori, ansia) e sulla storia di gozzo o patologie tiroidee. È importante valutare l’esposizione a carenza di iodio, l’uso di farmaci (es. amiodarone) e la familiarità per malattie tiroidee.
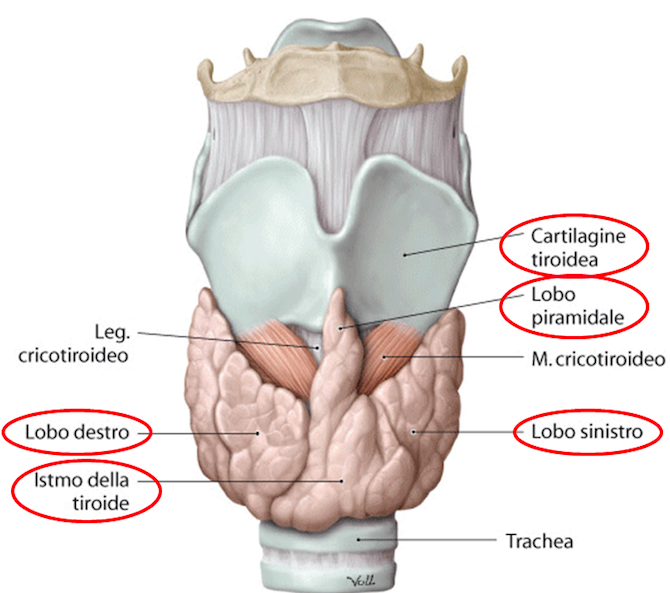
Inoltre, la palpazione della tiroide può rivelare un nodulo singolo (adenoma tossico) o multiple nodularità.
Gli esami ematici sono fondamentali per confermare l’ipertiroidismo e valutarne la gravità:
- TSH: è il test di primo livello. In caso di ipertiroidismo, il TSH è soppresso (< 0,4 mU/L) a causa del feedback negativo esercitato dagli ormoni tiroidei in eccesso;
- T4 libero (FT4) e T3 libero (FT3): sono elevati nell’ipertiroidismo manifesto. In alcuni casi, può essere presente un’ipertiroidismo subclinico, con TSH soppresso ma FT4 e FT3 ancora nei limiti di norma;
- anticorpi anti-tiroide: utili per escludere altre cause di ipertiroidismo, come la malattia di Graves. Nell’adenoma tossico e nel MTG, gli anticorpi anti-recettore del TSH (TRAb) sono generalmente negativi.
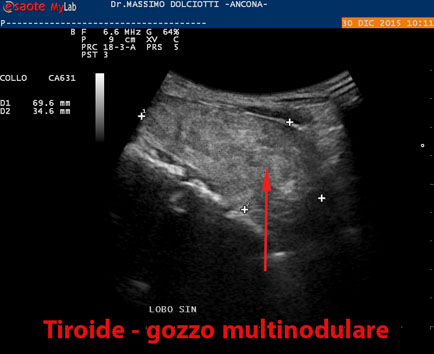
Le tecniche di imaging sono essenziali per caratterizzare la struttura e la funzione della tiroide. Prima di tutto è essenziale l’ecografia tiroidea che fornisce informazioni dettagliate sulla morfologia della tiroide, come le dimensioni, la presenza di noduli e le loro caratteristiche (ecogenicità, margini, vascolarizzazione). Nell’adenoma tossico, si osserva un nodulo singolo, ben delimitato e ipoecogeno.
Nel MTG, si riscontrano multiple nodularità di dimensioni e caratteristiche variabili.
L’ecografia è utile anche per guidare eventuali procedure di agoaspirato (FNA) in caso di noduli sospetti per malignità.
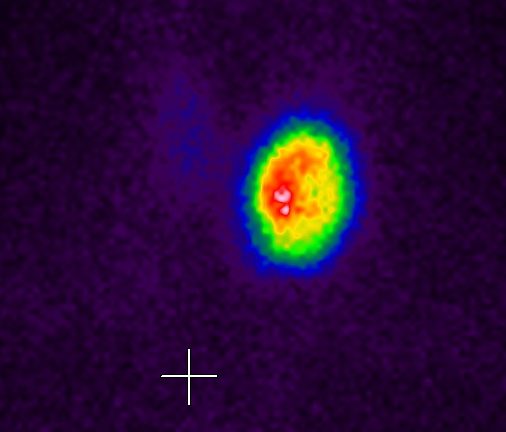
L’esame chiave per distinguere tra adenoma tossico e MTG è la scintigrafia tiroidea che utilizza radioisotopi come il tecnezio-99m o lo iodio-123, che vengono captati dalle cellule tiroidee.
Nell’adenoma tossico, come già detto, mostra un aumentato uptake nel nodulo iperfunzionante e un ridotto uptake nel resto della ghiandola (pattern “caldo” con soppressione del tessuto circostante).
Nel caso di MTG si evidenzia un pattern eterogeneo, con multiple aree di ipercaptazione corrispondenti ai noduli iperfunzionanti e aree di ipocaptazione nel tessuto non interessato.
L’agoaspirato non è routinariamente indicato per la diagnosi di adenoma tossico o MTG, ma può essere considerato in presenza di noduli con caratteristiche sospette alla ecografia (es. margini irregolari, microcalcificazioni, crescita rapida). L’FNA aiuta a escludere una neoplasia tiroidea, che può coesistere con noduli iperfunzionanti.
Diagnosi differenziale
La diagnosi di adenoma tossico e MTG deve essere differenziata da altre cause di ipertiroidismo, tra cui:
- malattia di Graves: caratterizzata da oftalmopatia, mixedema pretibiale e un pattern scintigrafico di diffusamente aumentato uptake;
- tiroidite subacuta: associata a dolore tiroideo, febbre e un pattern scintigrafico di ridotto uptake.
- tiroidite di Hashimoto in fase iperfunzionante: rara, ma può presentarsi con sintomi transitori di ipertiroidismo;
- assunzione di ormoni tiroidei esogeni (tireotossicosi factitia): il TSH è soppresso, ma la scintigrafia mostra un uptake assente o molto ridotto.
Gestione terapeutica
La gestione terapeutica mira a controllare l’ipertiroidismo, ridurre i sintomi e prevenire le complicanze a lungo termine. La scelta del trattamento dipende da diversi fattori, tra cui l’età del paziente, la gravità dei sintomi, le dimensioni del gozzo, la presenza di complicanze e le preferenze del paziente. Le opzioni terapeutiche includono la terapia medica, la terapia radiometabolica con iodio radioattivo e l’intervento chirurgico.
La terapia medica è spesso utilizzata come trattamento iniziale per controllare i sintomi dell’ipertiroidismo, specialmente in attesa di un trattamento definitivo (es. terapia radiometabolica o chirurgia). Si utilizzano farmaci antitiroidei come Metimazolo e propiltiouracile (PTU) che inibiscono la sintesi degli ormoni tiroidei bloccando l’organificazione dello iodio e la formazione di T3 e T4.
Sono particolarmente utili nei pazienti con ipertiroidismo severo o in preparazione alla terapia radiometabolica o chirurgica. Non rappresentano una cura definitiva, poiché l’adenoma tossico e il MTG sono condizioni autonome che non rispondono al feedback del TSH. Inoltre possono dare alcuni effetti collaterali quali rash cutaneo, artralgie, agranulocitosi (rara ma grave) ed epatotossicità.
Per controllare i sintomi adrenergici dell’ipertiroidismo, come tachicardia, palpitazioni, tremori e ansia si usano beta-bloccanti quali propranololo e atenololo.
La terapia con iodio radioattivo è una delle opzioni terapeutiche più comuni e efficaci per l’adenoma tossico e il MTG. Lo iodio radioattivo (I-131) viene captato selettivamente dalle cellule tiroidee iperfunzionanti, distruggendole attraverso l’emissione di radiazioni beta.
Le cellule dell’adenoma tossico o dei noduli iperfunzionanti nel MTG captano avidamente lo iodio radioattivo, mentre il tessuto tiroideo sano, in quiescenza funzionale, è protetto dagli effetti citotossici.
Questo porta alla riduzione o alla scomparsa del nodulo iperfunzionante e al ripristino della normale funzione tiroidea.
Tale trattamento non invasivo è efficace nel controllo dell’ipertiroidismo nella maggior parte dei pazienti. Inoltre può essere ripetuto in caso di recidiva. Tuttavia, nel lungo termine, potrebbe provocare ipotiroidismo (meno comune rispetto alla malattia di Graves) e più facile da gestire con terapia sostitutiva rispetto all’ipertiroidismo.
L’approccio chirurgico è indicato in casi specifici, specialmente quando la terapia radiometabolica non è appropriata o non desiderata. Si può procedere con la rimozione del lobo contenente l’adenoma tossico (lobectomia) o con una tiroidectomia subtotale o totale, indicata nel MTG di grandi dimensioni, in presenza di sintomi compressivi o sospetto di malignità.
L’intervento consente una risoluzione immediata dell’ipertiroidismo con eliminazione del rischio di recidiva.
Gli svantaggi di una chirurgia sono il rischio di complicanze chirurgiche, come ipoparatiroidismo (danno alle ghiandole paratiroidi) e lesione del nervo laringeo ricorrente (con raucedine) e la necessità di terapia sostitutiva con levotiroxina in caso di tiroidectomia totale.
Indipendentemente dal trattamento scelto, è essenziale un attento monitoraggio per valutare l’efficacia della terapia e prevenire complicanze.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.