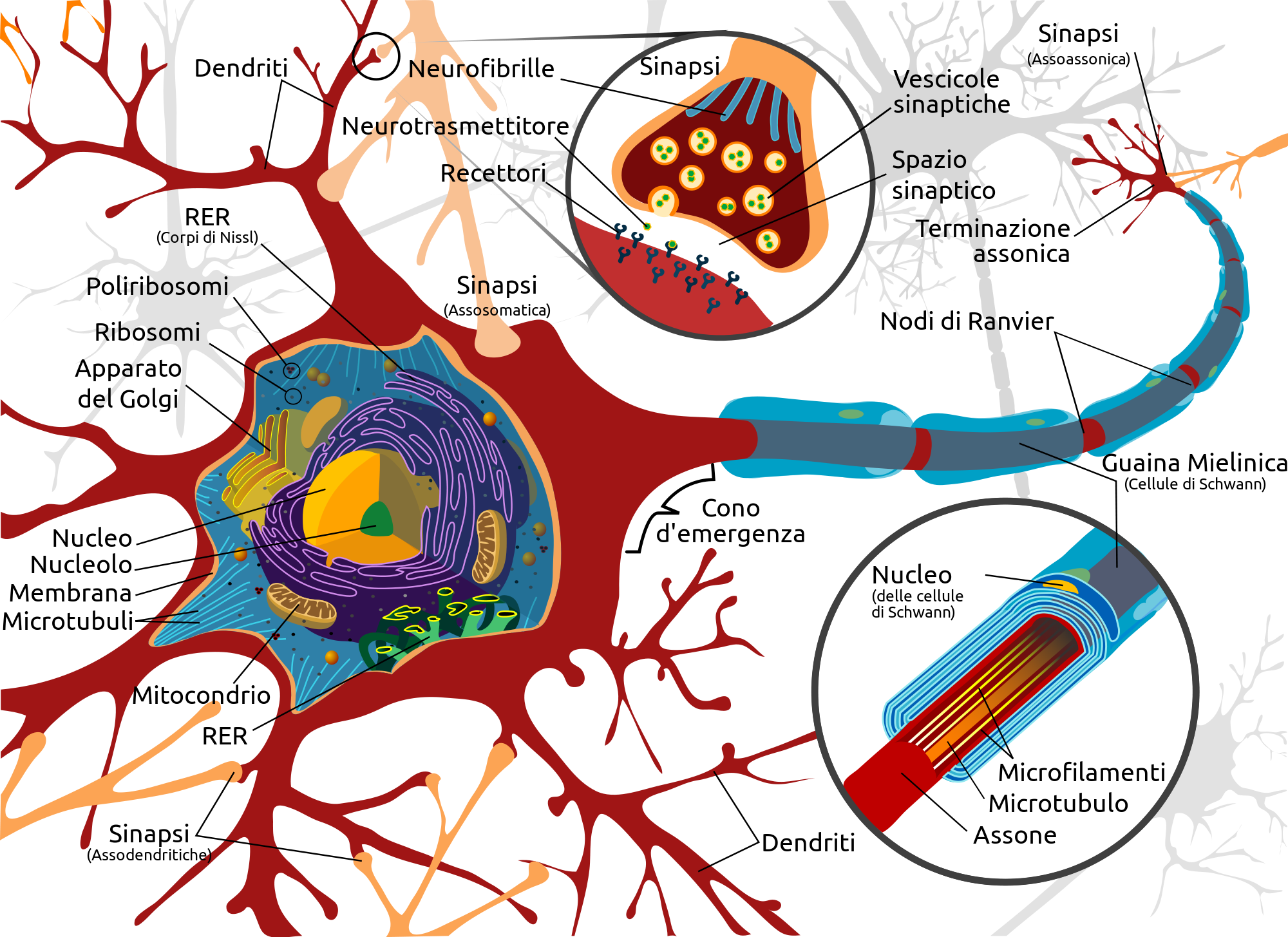
L’anestesia endovenosa rappresenta una componente fondamentale nella pratica anestesiologica moderna, offrendo un controllo preciso sull’induzione e sul mantenimento dello stato di incoscienza durante le procedure chirurgiche. Gli anestetici generali somministrati per via endovenosa agiscono principalmente modulando il recettore GABA-A, un canale ionico che, una volta attivato, permette l’ingresso di ioni cloro nel neurone post-sinaptico. Questo flusso ionico induce un’iperpolarizzazione della membrana neuronale, inibendo l’attività neuronale e promuovendo uno stato di sedazione e amnesia.
Il modo in cui i diversi anestetici endovenosi determinano l’apertura o la modificazione strutturale del recettore è diversa a seconda dell’agente utilizzato. Tra gli agenti endovenosi più utilizzati troviamo:
- propofol: caratterizzato da un rapido onset e una breve durata d’azione, è ampiamente utilizzato sia per l’induzione che per il mantenimento dell’anestesia;
- benzodiazepine: come il midazolam, sono utilizzate per le loro proprietà ansiolitiche, sedative e amnesiche, spesso in combinazione con altri agenti anestetici;
- ketamina: un agente dissociativo che, oltre a indurre anestesia, possiede proprietà analgesiche e mantiene la funzione respiratoria, rendendola utile in specifici contesti clinici;
- etomidate: apprezzato per la sua stabilità emodinamica durante l’induzione, sebbene il suo uso prolungato sia limitato a causa di effetti collaterali come la soppressione corticosurrenalica;
- dexmedetomidina: un agonista dei recettori alfa-2 adrenergici che fornisce sedazione senza depressione respiratoria significativa, utilizzata in particolari situazioni cliniche.
I barbiturici, un tempo pilastri dell’anestesia endovenosa, sono ormai caduti in disuso a causa del loro profilo di effetti collaterali e della disponibilità di agenti più sicuri ed efficaci.
L’introduzione e la diffusione della Total Intravenous Anesthesia (TIVA) hanno rivoluzionato l’approccio anestesiologico, permettendo la somministrazione continua di ipnotici e oppioidi per via endovenosa senza l’uso di agenti inalatori come il desflurano o il sevoflurano. Questo approccio offre vantaggi come una ridotta incidenza di nausea e vomito post-operatori e un recupero più rapido delle funzioni cognitive.
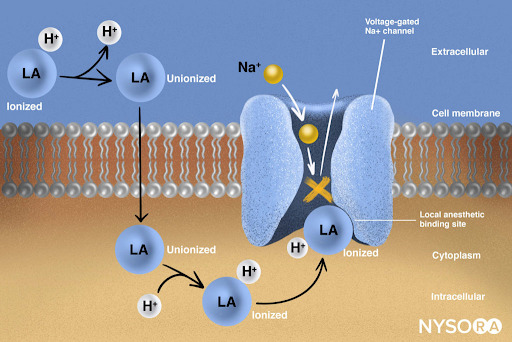
La farmacocinetica degli anestetici endovenosi è influenzata dalla loro elevata liposolubilità, che consente un rapido attraversamento della barriera emato-encefalica dopo la somministrazione in bolo. L’inizio dell’azione è rapido, ma l’interruzione dell’effetto è principalmente dovuto alla ridistribuzione del farmaco dal sistema nervoso centrale ai tessuti periferici, come muscoli e tessuto adiposo, piuttosto che al metabolismo o all’eliminazione. Tuttavia, con somministrazioni ripetute o infusioni prolungate, i tessuti periferici possono saturarsi, prolungando i tempi di risveglio. Questo fenomeno è descritto dal concetto di “emivita contesto-sensibile“, che rappresenta il tempo necessario affinché la concentrazione plasmatica del farmaco si riduca del 50% dopo l’interruzione di un’infusione continua, variando in base alla durata dell’infusione stessa.
Caricamento…
Propofol
Il propofol è un anestetico generale endovenoso ampiamente utilizzato nella pratica clinica, sia per l’induzione che per il mantenimento dell’anestesia, in particolare nell’ambito della Total Intravenous Anesthesia (TIVA). A causa della sua insolubilità in acqua, viene formulato in un’emulsione lipidica di colore bianco contenente lecitina d’uovo e/o olio di semi di soia, il che può comportare reazioni di ipersensibilità in pazienti allergici a questi componenti.
Il meccanismo d’azione del propofol si basa sulla modulazione del recettore GABA-A, potenziando la corrente di cloruro mediata da questo complesso recettoriale. Questo effetto induce un’iperpolarizzazione neuronale, determinando una potente azione ipnotica senza proprietà analgesiche. Inoltre, il propofol possiede attività antiepilettica, riducendo la pressione intracranica e il consumo di ossigeno cerebrale, rendendolo il farmaco di scelta nella gestione di traumi cranici, lesioni ischemiche o emorragiche e nello stato di male epilettico refrattario.
La farmacocinetica del propofol è caratterizzata da un rapido onset e offset, con una cinetica prevedibile che ne favorisce l’uso nella maggior parte delle anestesie generali. La dose di induzione varia da 1,0 a 2,5 mg/kg somministrata in bolo, con un inizio d’azione inferiore a 60 secondi e una durata dell’ipnosi di 5-10 minuti in pazienti con normale funzionalità epatica. Per la sedazione, le dosi variano tra 25 e 75 microgrammi/kg/min. Il metabolismo avviene principalmente a livello epatico, con escrezione renale dei metaboliti.
Tra gli effetti emodinamici, il propofol può causare una diminuzione del post-carico e della contrattilità cardiaca, portando a ipotensione, particolarmente evidente in pazienti cardiopatici, ipovolemici o anziani. Tuttavia, presenta anche vantaggi come proprietà antiemetiche e antistaminiche, riducendo il prurito indotto dagli oppioidi, e non è associato all’insorgenza di ipertermia maligna.
Gli effetti avversi includono reazioni allergiche in soggetti sensibili a uova o soia, irritazione venosa nel sito di iniezione (per la quale è consigliata la premedicazione con lidocaina), disordini lipidici come iperlipemia e pancreatiti, mioclono e singhiozzo. Una rara ma grave complicanza è la sindrome da infusione di propofol (PRIS), descritta principalmente in pazienti critici e pediatrici sottoposti a sedazione con alte dosi di propofol. La PRIS è caratterizzata da bradicardia acuta resistente che può progredire fino all’asistolia, accompagnata da acidosi metabolica (deficit di base >10 mmol/l), rabdomiolisi, iperlipidemia ed epatomegalia steatosica. Esiste un’associazione tra la PRIS e infusioni di propofol a dosi superiori a 4 mg/kg/h per una durata superiore a 48 ore.
Grazie alla sua rapidità e delicatezza d’azione, il propofol è comunemente utilizzato per l’induzione dell’anestesia generale. Inoltre, può essere somministrato in infusione continua insieme a un oppioide a breve emivita, come il remifentanil, per la conduzione di un’anestesia totalmente endovenosa (TIVA). La conoscenza approfondita della farmacocinetica del propofol ha permesso lo sviluppo di modelli per la somministrazione in modalità TCI (Target Controlled Infusion). In questa modalità, l’anestesista, dopo aver inserito i parametri antropometrici del paziente, imposta la concentrazione target del farmaco da raggiungere nel sito effettore (SNC), e la pompa infusionale elabora un programma di infusione personalizzato per il paziente, finalizzato al raggiungimento e al mantenimento di una concentrazione stabile nel sito effettore. Questo approccio consente di mantenere la stabilità del piano anestetico, evitare sovradosaggi pericolosi e prevedere i tempi di risveglio.
Ketamina
La ketamina è un anestetico generale appartenente alla classe delle arilcicloesilamine, noto per le sue peculiari proprietà dissociative. A livello clinico, induce uno stato di anestesia dissociativa, caratterizzato da apparente catatonia, analgesia e amnesia, senza una completa perdita di coscienza. Questo stato è particolarmente utile in procedure chirurgiche superficiali, come interventi cutanei.
La ketamina agisce principalmente come antagonista dei recettori NMDA del glutammato, un neurotrasmettitore eccitatorio del sistema nervoso centrale. Inibendo questi recettori, la ketamina deprime il sistema talamo-corticale e stimola il sistema limbico, inclusa la formazione reticolare e l’ippocampo, provocando l’effetto dissociativo. Inoltre, interagisce con i recettori muscarinici, colinergici e monoaminergici, contribuendo alla sua complessa azione farmacologica.
Per l’induzione dell’anestesia, la ketamina può essere somministrata per via endovenosa (1-2 mg/kg) o intramuscolare (4-8 mg/kg). La somministrazione endovenosa induce la perdita di coscienza in 30-60 secondi, mentre quella intramuscolare richiede un tempo maggiore. La durata dell’effetto anestetico dopo una singola somministrazione varia tra 10 e 20 minuti.
Una delle peculiarità della ketamina è la capacità di mantenere i riflessi protettivi delle vie aeree, rendendola utile in situazioni in cui è preferibile evitare la depressione respiratoria, come nei pazienti con rischio di aspirazione. Tuttavia, la ketamina aumenta la pressione intracranica e intraoculare, pertanto è controindicata in pazienti con traumi cranici o patologie oculari che comportano elevata pressione. Inoltre, stimola il sistema cardiovascolare, incrementando la pressione arteriosa e la frequenza cardiaca, rendendola indicata in stati di ipotensione o shock, ma richiedendo cautela nei pazienti con patologie cardiache.
Tra gli effetti avversi più comuni si annoverano disforia, allucinazioni e incubi durante il risveglio dall’anestesia. Per mitigare questi effetti, è pratica comune somministrare benzodiazepine in concomitanza. L’uso prolungato o a dosi elevate può portare ad accumulo sistemico, causando tossicità. Recentemente, l’infusione di basse dosi di ketamina (0,06-0,12 mg/kg/h) è stata proposta come strategia per la gestione del dolore post-operatorio, grazie alle sue proprietà analgesiche.
Farmaci adiuvanti
Gli agonisti dei recettori alfa-2 adrenergici, come la clonidina e la dexmedetomidina, svolgono un ruolo significativo come farmaci adiuvanti in anestesia generale. Questi agenti agiscono principalmente a livello del locus coeruleus, una regione del tronco encefalico coinvolta nella modulazione della vigilanza e della risposta allo stress.
La clonidina e la dexmedetomidina agiscono inibendo il rilascio di noradrenalina, riducendo l’attività simpatica e inducendo effetti sedativi, ansiolitici e analgesici. Questa modulazione permette di potenziare l’efficacia degli anestetici generali, consentendo una riduzione dei dosaggi necessari e, di conseguenza, una diminuzione degli effetti collaterali associati.
Caricamento…
Oltre alle proprietà sedative e analgesiche, gli agonisti alfa-2 adrenergici presentano effetti emodinamici, tra cui bradicardia e ipotensione, dovuti alla diminuzione del tono simpatico. Tuttavia, hanno un impatto minimo sulla funzione respiratoria, rendendoli utili in contesti clinici in cui è importante preservare la ventilazione spontanea. Inoltre, l’aggiunta di questi agenti agli anestetici locali può prolungare la durata e l’efficacia del blocco sensitivo e motorio.
La dexmedetomidina, più recente e selettiva rispetto alla clonidina, è ampiamente utilizzata per la sedazione durante procedure chirurgiche e in terapia intensiva. Induce una “sedazione collaborativa“, in cui i pazienti possono essere facilmente risvegliati e comunicare, se necessario. Durante sedazioni prolungate, la dexmedetomidina è in grado di mimare il pattern del sonno fisiologico, offrendo un effetto protettivo nei confronti del delirium post-operatorio, specialmente in pazienti a rischio.
Oppiodi
Gli oppioidi sono una classe di farmaci analgesici derivati dall’oppio, strutturalmente simili alla morfina, che svolgono un ruolo cruciale nella pratica anestesiologica. La loro principale funzione è quella di fornire analgesia durante le procedure chirurgiche, riducendo le risposte neurovegetative come l’aumento della pressione arteriosa (PA) e della frequenza cardiaca (FC) durante manovre invasive come l’intubazione tracheale.
Gli oppioidi esercitano la loro azione legandosi ai recettori specifici presenti sia a livello del sistema nervoso centrale (SNC) che periferico. Questo legame modula la trasmissione del dolore, inibendo i neuroni responsabili della percezione dolorosa a livello spinale e favorendo la liberazione di oppioidi endogeni a livello sovraspinale.
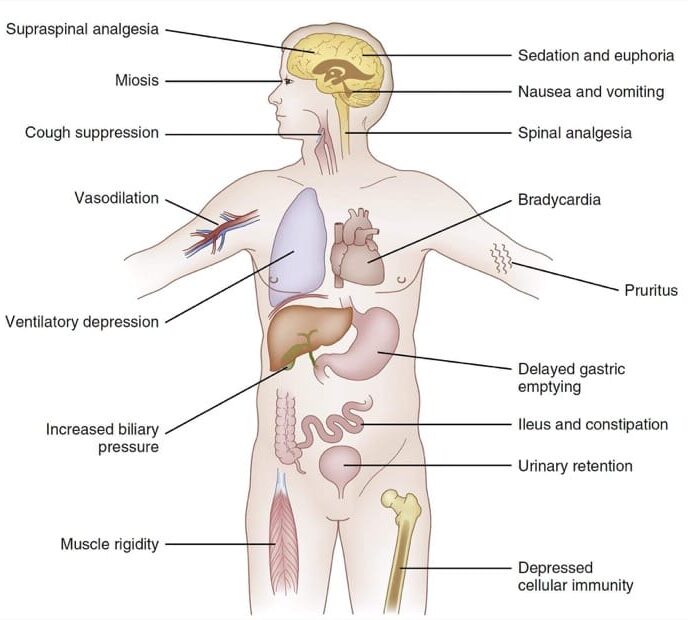
L’uso degli oppioidi in anestesia generale comporta diversi effetti fisiologici:
- depressione respiratoria: riduzione della frequenza respiratoria fino all’apnea;
- effetti emodinamici: diminuzione della frequenza cardiaca e della pressione arteriosa;
- rigidità muscolare: possibile insorgenza di rigidità toracica, soprattutto con somministrazioni rapide o dosi elevate;
- effetti gastrointestinali: rallentamento della peristalsi intestinale, che può portare a stipsi;
- nausea e vomito post-operatori (PONV): gli oppioidi sono tra i principali responsabili di questi sintomi nel periodo post-operatorio.
In anestesia generale, gli oppioidi più comunemente impiegati sono quelli a breve emivita, che consentono un controllo più preciso dell’analgesia intraoperatoria:
- Fentanil: somministrato in bolo alla dose di 1-2 μg/kg, ha un impatto emodinamico minore rispetto ad altri oppioidi, rendendolo indicato in pazienti con tendenza all’ipotensione. Tuttavia, dosi ripetute possono portare ad accumulo e prolungamento dei tempi di risveglio a causa della lunga emivita contesto-sensibile.
- Alfentanil: somministrato in bolo alla dose di 15 μg/kg, ha un’azione rapida ma una durata più breve rispetto al fentanil, utile per procedure di breve durata.
- Remifentanil: somministrato in infusione continua a dosaggi variabili da 0,01 a 0,25 μg/kg/min, è metabolizzato da esterasi plasmatiche e tissutali, indipendentemente dalla funzione renale ed epatica. Ha un’emivita contesto-sensibile molto breve (3-5 minuti), evitando l’accumulo anche in infusioni prolungate. Tuttavia, può causare ipotensione e bradicardia, specialmente in pazienti anziani o con compromissione cardiovascolare.
- Sufentanil: può essere somministrato in bolo o in infusione continua ed è approvato anche per l’analgesia peridurale. Ha un impatto emodinamico intermedio tra fentanil e remifentanil.
La scelta dell’oppioide e del regime di somministrazione deve essere attentamente calibrata in base alle caratteristiche del paziente e al tipo di intervento chirurgico. È fondamentale monitorare attentamente gli effetti collaterali, in particolare la depressione respiratoria e le alterazioni emodinamiche, per garantire la sicurezza e l’efficacia dell’anestesia.
Inoltre, la gestione del dolore post-operatorio richiede un approccio multimodale, che può includere l’uso di oppioidi a lunga durata d’azione come la morfina, oltre a tecniche analgesiche aggiuntive per ottimizzare il controllo del dolore e minimizzare gli effetti avversi.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.
Altre fonti: