La malattia tiroidea autoimmune (AITD) è un prototipo di malattia autoimmune organo-specifica. L’eziologia delle patologie tiroidee autoimmuni è multifattoriale, poiché l’interazione tra fattori genetici e ambientali predisponenti porta a una disfunzione della tolleranza immunitaria.
La prevalenza dell’AITD è stimata intorno al 5%; tuttavia, la prevalenza degli autoanticorpi antitiroidei nella popolazione generale potrebbe essere ancora più alta.
Il morbo di Graves e la tiroidite di Hashimoto sono le principali manifestazioni cliniche dell’AITD, caratterizzate rispettivamente da infiltrazione linfocitaria del parenchima tiroideo e, clinicamente, da tireotossicosi e ipotiroidismo.
La predisposizione genetica, il sesso femminile e i fattori ambientali rappresentano i principali elementi che contribuiscono allo sviluppo di queste patologie.
Morbo di Graves
Il morbo di Graves (o gozzo tossico diffuso) è stato descritto per la prima volta nel XIX secolo dal Dr. Robert James Graves in Irlanda. È noto anche come malattia di Basedow-Flaiani, in seguito alla descrizione della tipica presentazione clinica con oftalmopatia e palpitazioni fatta dal Dr. Karl Adolph von Basedow (in Germania) e dal Dr. Giuseppe Flaiani (in Italia) nello stesso periodo.
Il morbo di Graves rappresenta fino al 60-80% dei casi di tireotossicosi (ossia lo stato di eccesso di ormoni tiroidei nel sangue), ma la sua prevalenza varia tra le diverse popolazioni, principalmente in base all’assunzione di iodio (un elevato apporto di iodio è associato a un aumento della prevalenza del morbo di Graves). Questa malattia colpisce fino al 2% delle donne, mentre negli uomini è circa dieci volte meno frequente. Raramente esordisce prima dell’adolescenza e si manifesta tipicamente tra i 20 e i 50 anni, ma può verificarsi anche negli anziani.
La maggior parte dei ricercatori concorda sul fatto che il morbo di Graves sia una malattia multifattoriale causata da una complessa interazione tra fattori genetici e ambientali. Sono stati identificati diversi geni di suscettibilità, che possono essere classificati in geni regolatori del sistema immunitario (HLA-DR, CTLA4, CD40, PTPN22) e geni specifici della tiroide (tireoglobulina, TSHR). Tuttavia, la penetranza dei determinanti genetici sembra essere piuttosto bassa, come suggerito dal fatto che il morbo di Graves non è una malattia ereditaria, sebbene tenda a ripresentarsi, insieme alla tiroidite autoimmune in generale, all’interno delle stesse famiglie.
Tra i fattori non genetici coinvolti nella sua eziologia, sono stati ipotizzati infezioni, assunzione di iodio, fumo e stress psicologico, sebbene non vi siano prove definitive.
L’ipertiroidismo del morbo di Graves è dovuto alla presenza di autoanticorpi stimolanti la tiroide che bersagliano il recettore del TSH (TRAb).
I segni e i sintomi includono sia manifestazioni comuni alla tireotossicosi di qualsiasi origine, sia caratteristiche specifiche del morbo di Graves. La presentazione clinica dipende dalla gravità della tireotossicosi, dalla durata della malattia, dalla suscettibilità individuale all’eccesso di ormoni tiroidei e dall’età del paziente.
La tireotossicosi può causare:
- perdita di peso inspiegabile (nonostante un aumento dell’appetito dovuto al metabolismo accelerato);
- iperattività, nervosismo, irritabilità, affaticamento, insonnia, difficoltà di concentrazione;
- tremore fine (più evidente facendo distendere le dita e palpando i polpastrelli con il palmo);
- tachicardia sinusale, spesso associata a palpitazioni, fibrillazione atriale, peggioramento dell’angina o scompenso cardiaco negli anziani o in pazienti con patologie cardiache preesistenti;
- sudorazione, intolleranza al caldo, prurito, orticaria, alopecia;
- disturbi gastrointestinali (spesso diarrea, occasionalmente lieve steatorrea);
- oligomenorrea o amenorrea nelle donne, disfunzioni sessuali e ginecomastia negli uomini;
- disturbi ossei, con osteopenia nella tireotossicosi di lunga durata, lieve ipercalcemia e ipercalciuria.
Le manifestazioni specifiche del morbo di Graves comprendono:
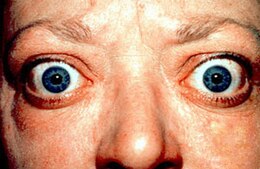
- oftalmopatia di Graves, con sensazione di corpo estraneo negli occhi, fastidio oculare e lacrimazione eccessiva. Circa un terzo dei pazienti presenta esoftalmo, rilevabile osservando la sclera tra il bordo inferiore dell’iride e la palpebra inferiore in posizione primaria dello sguardo. Nei casi più gravi possono comparire diplopia, compressione del nervo ottico, papilledema, difetti del campo visivo e, se non trattata, perdita permanente della vista. L’oftalmopatia compare entro un anno prima o dopo la diagnosi di tireotossicosi nel 75% dei pazienti, ma in alcuni casi può precederla o seguirla di diversi anni, determinando oftalmopatia eutiroidea;
- dermopatia tiroidea (5% dei pazienti), nota anche come mixedema pretibiale, caratterizzata da edema e placche indurite non infiammate, di colore rosa scuro o violaceo con un aspetto “a buccia d’arancia” sulle gambe;
- acropachia tiroidea (1% dei pazienti), caratterizzata da gonfiore dei tessuti molli delle mani e dita a bacchetta di tamburo, fortemente associata alle manifestazioni cutanee e oculari.
Dal punto di vista laboratoristico, il profilo biochimico mostra livelli soppressi di TSH con incremento dei livelli sierici di fT4 e fT3. Alterazioni biochimiche associate che possono generare confusione diagnostica includono aumento di bilirubina, enzimi epatici e ferritina. Possono essere presenti anche anemia microcitica e trombocitopenia.
L’ecografia tiroidea mostra tipicamente un aumento diffuso delle dimensioni della tiroide (fino a due-tre volte il normale). L’esame obiettivo può rivelare un fremito o un soffio dovuto all’aumentata vascolarizzazione della ghiandola e alla circolazione iperdinamica.
Il trattamento mira a normalizzare i livelli ormonali e alleviare i sintomi, attraverso diverse opzioni terapeutiche:
- terapia farmacologica: i farmaci antitiroidei, come il propiltiouracile e il metimazolo, inibiscono la sintesi degli ormoni tiroidei. Il propiltiouracile è utilizzato da oltre quarant’anni nel trattamento dell’ipertiroidismo associato al morbo di Graves ed è considerato un farmaco di prima scelta. Il trattamento farmacologico richiede un monitoraggio regolare della funzione tiroidea e dell’emocromo, con una durata che varia da 6 mesi a 2 anni. In alcuni casi, la malattia può risolversi definitivamente;
- terapia con iodio radioattivo (radioiodio): questa opzione prevede la somministrazione orale di iodio-131, che si accumula nella tiroide e ne distrugge parzialmente il tessuto iperfunzionante nel corso di settimane o mesi. L’ipotiroidismo risultante viene trattato con ormoni tiroidei sintetici;
- intervento chirurgico (tiroidectomia): la rimozione parziale o totale della tiroide è indicata in pazienti con recidive dopo terapia farmacologica, in coloro che rifiutano il radioiodio, nei casi di gozzo voluminoso o quando i farmaci antitiroidei non sono tollerati. L’intervento può essere considerato anche in pazienti giovani con adenoma tossico o gozzo multinodulare;
- terapia sintomatica: i beta-bloccanti, come il propranololo, sono utilizzati per controllare sintomi quali tachicardia, ansia e tremori, agendo sul sistema cardiovascolare senza influenzare direttamente la produzione di ormoni tiroidei.
La scelta del trattamento più appropriato dipende da vari fattori, tra cui l’età del paziente, la gravità dell’ipertiroidismo, la presenza di altre condizioni mediche e le preferenze individuali.
Tiroidite di Hashimoto
La tiroidite di Hashimoto è un’infiammazione cronica della tiroide, descritta per la prima volta oltre un secolo fa, ma con un’eziopatogenesi ancora non completamente definita. Attualmente, è considerata la malattia autoimmune più comune, il disturbo endocrino più frequente e la causa più frequente di ipotiroidismo.
In base all’eziologia, la tiroidite di Hashimoto può essere classificata in forma primaria e secondaria. La tiroidite di Hashimoto primaria è la forma più comune di tiroidite e include i casi senza una causa identificabile. Questa condizione comprende uno spettro clinico-patologico che si articola in sei principali varianti:
- forma classica;
- variante fibrosa;
- variante correlata a IgG4;
- forma giovanile;
- hashitossicosi;
- tiroidite indolore (o silente), che può manifestarsi in modo sporadico o nel periodo post-partum.
Nelle fasi iniziali, la tiroidite di Hashimoto può essere asintomatica. Clinicamente, la manifestazione più comune è l’aumento di volume della tiroide (gozzo), con o senza ipotiroidismo. Tra i segni di ipotiroidismo rientrano: aumento di peso, affaticamento, intolleranza al freddo, pelle secca, depressione, stipsi, diradamento dei capelli, voce rauca e debolezza muscolare.
Dal punto di vista patologico, il denominatore comune a tutte le varianti è un’infiltrazione linfocitaria marcata della tiroide.
La tiroidite di Hashimoto primaria può presentarsi isolatamente o essere associata ad altre malattie autoimmuni (ad esempio, diabete mellito di tipo 1, sindrome di Sjögren, gastrite atrofica cronica) o ad altre patologie tiroidee.
La diagnosi della tiroidite di Hashimoto si basa su:
- ecografia tiroidea: può evidenziare un aumento delle dimensioni della ghiandola e una struttura ecografica alterata;
- esami del sangue: valutazione dei livelli di ormoni tiroidei (TSH, FT4) e presenza di anticorpi anti-tiroide (anti-TPO, anti-tireoglobulina).
Il trattamento principale consiste nella terapia ormonale sostitutiva con levotiroxina, un ormone tiroideo sintetico che compensa la ridotta produzione ormonale della tiroide. La dose viene personalizzata in base alle esigenze del paziente e monitorata nel tempo attraverso controlli periodici dei livelli ormonali.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Altre fonti:
- Farmaci per Curare il Morbo di Graves – Basedow;
- LA MALATTIA DI GRAVES;
- Malattia di Basedow-Graves;
- Morbo di Graves: sintomi, cause e possibili trattamenti;
- Tiroidite di Hashimoto;
- La tiroidite di Hashimoto: sintomi, conseguenze, patologie correlate, diagnosi e cure;
- Tiroidite di Hashimoto (Tiroidite linfocitaria).















