L’emergere della Realtà Virtuale (VR) in ambito sanitario segna un punto di svolta, trasformando una tecnologia percepita primariamente come intrattenimento in un potente strumento clinico. La sua integrazione non rappresenta un mero aggiornamento tecnologico, ma una decisione strategica volta a migliorare l’esperienza e il benessere psicologico del paziente.
Offrendo strumenti immersivi per la gestione del dolore, dell’ansia e dello stress, la VR si afferma come una componente fondamentale per un’assistenza più umana, empatica ed efficace, in grado di agire direttamente sulla qualità della degenza e del percorso terapeutico.
Il progetto “Inner Healing“
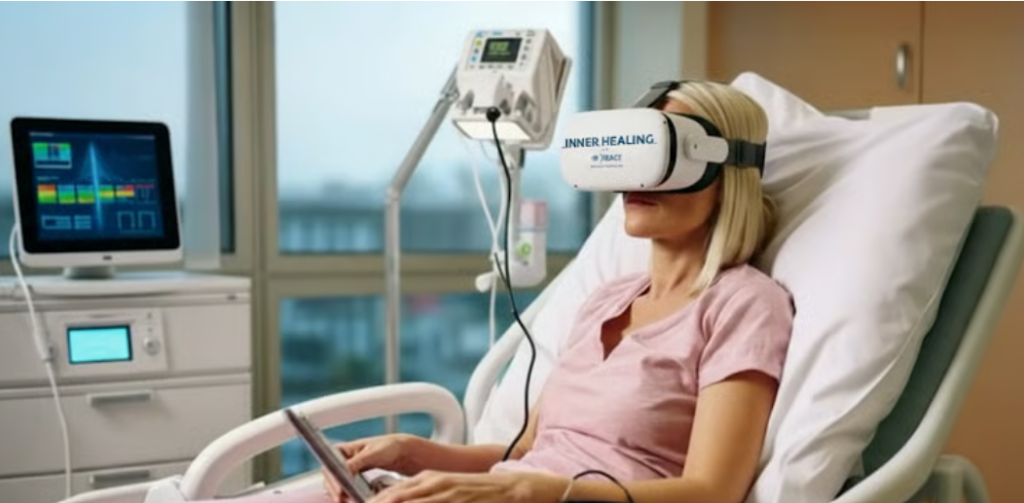
Il progetto “Inner Healing” incarna l’applicazione clinica della VR, con un’implementazione mirata a migliorare la qualità della vita dei pazienti, in particolare in ambito oncologico; un’implementazione che si posiziona come prima nel suo genere in Europa nel contesto della medicina nucleare. L’iniziativa si distingue per un approccio pragmatico e centrato sulle reali necessità di pazienti e operatori sanitari.1
Il progetto mira ad elevare la qualità della degenza dei pazienti oncologici offrendo opportunità concrete di rilassamento, stimolazione intellettuale e arricchimento culturale durante i periodi di terapia, isolamento per radioprotezione o ricovero.
Vengono impiegati visori leggeri e programmati per un utilizzo immediato, una caratteristica essenziale per garantirne l’accessibilità anche a pazienti anziani o poco avvezzi alla tecnologia. Il sistema è progettato per minimizzare l’impegno degli operatori sanitari, evitando che l’innovazione si traduca in un ulteriore carico di lavoro.
L’offerta di esperienze è diversificata e include:
- ambienti rilassanti come spiagge, montagne, boschi e fondali marini;
- esperienze culturali immersive, come una visita alla Basilica di San Pietro;
- viaggi virtuali, ad esempio nello spazio.
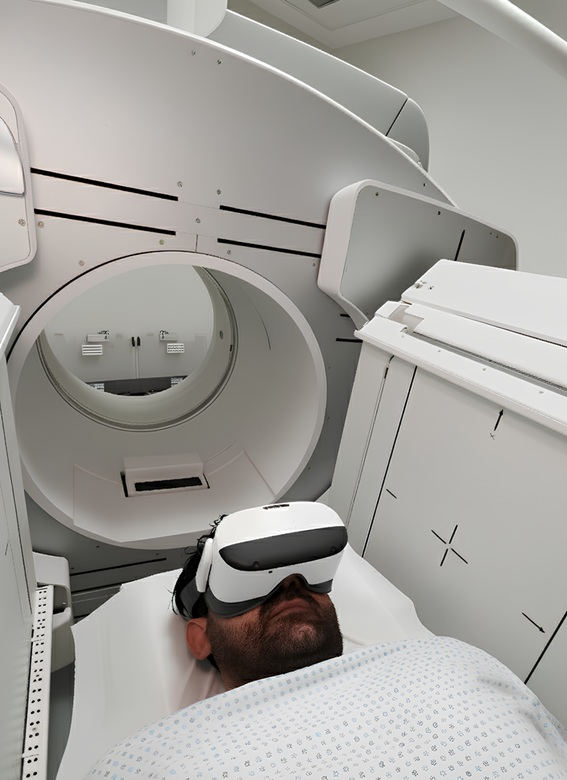
L’elemento più innovativo è la creazione di riprese a 360 gradi personalizzate per ogni centro clinico. Questa funzionalità permette al paziente di familiarizzare in anticipo con il percorso terapeutico, visualizzando gli ambienti di cura, le macchine diagnostiche e conoscendo virtualmente il personale che incontrerà. L’obiettivo dichiarato è ridurre l’ansia anticipatoria legata all’ignoto.
La validità del sistema è dimostrata dalla sua implementazione di successo in una rete di istituzioni sanitarie italiane di primo piano, tra cui l’oncologia di Bolzano, la medicina nucleare dello IEO, il San Martino di Genova, l’Humanitas Catanese, l’Istituto Don Calabria a Negrar e la radioterapia del Policlinico Gemelli. Questo network testimonia la validazione clinica e la scalabilità del progetto.
Validazione scientifica e impatto misurabile
L’efficacia del progetto non si basa su mere intuizioni, ma è supportata da un crescente corpo di evidenze scientifiche che ne validano l’impatto clinico.
Una metanalisi condotta su 825 pazienti oncologici ha dimostrato una riduzione significativa di ansia, dolore e stress grazie all’uso della VR. Un ulteriore studio, realizzato durante l’infusione chemioterapica ambulatoriale, ha confermato una diminuzione misurabile di stress, dolore e frequenza cardiaca, accompagnata da un miglioramento dell’umore.
Una ricerca condotta in collaborazione con l’unità di riabilitazione del Policlinico Gemelli su 15 pazienti con cerebrolesioni acquisite ha fornito risultati preliminari incoraggianti. Si è osservata una riduzione dell’attività elettrodermica (EDA), un indicatore fisiologico che si abbassa in stati di calma e immersione. Questi dati hanno spinto a pianificare un’estensione dello studio per coinvolgere anche famiglie e caregiver.
È stata avviata una collaborazione strategica con l’unità di psico-oncologia dello IEO per raccogliere e analizzare sistematicamente dati sull’impatto psicologico del sistema, rafforzando ulteriormente le basi scientifiche del progetto.
Principi di implementazione strategica
Il successo dell’adozione del progetto “Inner Healing” si fonda su due principi strategici fondamentali, essenziali per l’integrazione di qualsiasi innovazione nel complesso ecosistema sanitario.
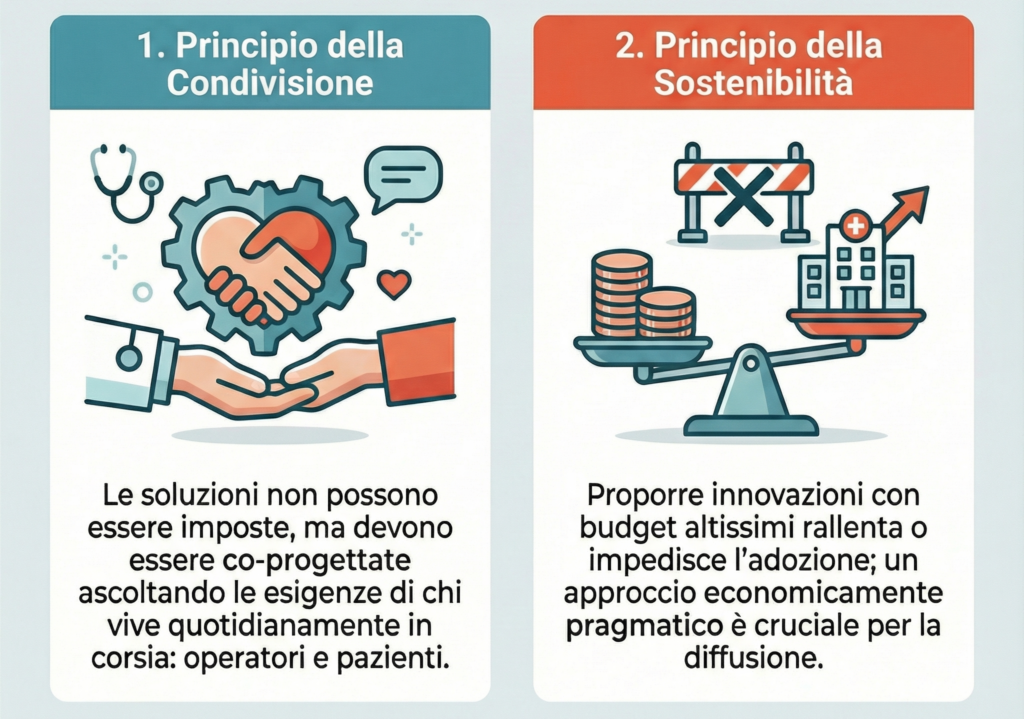
Il principio della “condivisione” è centrale. È impossibile imporre soluzioni innovative senza progettarle in stretta collaborazione con “chi vive in corsia quotidianamente”. L’ascolto delle esigenze non soddisfatte degli operatori e dei pazienti è il prerequisito per creare strumenti realmente utili ed efficaci.
Le soluzioni tecnologiche proposte devono essere economicamente sostenibili. Proporre innovazioni con budget “altissimi” rappresenta un ostacolo significativo che rallenta o impedisce l’adozione nel contesto del sistema sanitario italiano. Un approccio economicamente pragmatico è quindi cruciale per favorire una diffusione su larga scala.
La rivoluzione dell’Intelligenza Artificiale
L’Intelligenza Artificiale (AI) si sta affermando come un catalizzatore di efficienza e precisione senza precedenti nel settore sanitario. Al di là delle applicazioni più visibili, questa tecnologia sta silenziosamente ma inesorabilmente ridefinendo i flussi di lavoro, potenziando la diagnostica per immagini e accelerando la ricerca farmacologica. L’AI non è solo un nuovo strumento, ma il motore di un cambio di paradigma che promette di rendere i meccanismi sanitari più intelligenti, reattivi e personalizzati: l’incarnazione di “The Smart Thing” applicata al cuore della medicina.
L’impiego strategico dell’AI ottimizza molteplici fasi del lavoro medico, liberando risorse preziose:

- automazione dei task amministrativi: l’integrazione di sistemi di AI, anche “concettualmente semplici”, permette di delegare compiti ripetitivi e burocratici. Questo rappresenta il primo passo per incorporare “The Smart Thing” nel workflow clinico e riallocare intelligentemente il capitale umano, liberando tempo medico da dedicare ai pazienti;
- supporto alla visita e anamnesi: l’AI può integrare dati da fonti eterogenee per generare report sintetici che supportano sia il medico nucleare che l’oncologo. Applicazioni già in uso in USA e Australia registrano, trascrivono e strutturano il report di una visita medica in tempo reale. Questo primo passo di delega costituisce l’anello iniziale di una “catena di montaggio” uomo-macchina, costruendo la fiducia necessaria per collaborazioni più complesse;
- refertazione assistita: algoritmi avanzati sono in grado di generare automaticamente report strutturati (es. report PSMA), includendo tabelle riassuntive e applicando criteri di valutazione standardizzati, con un notevole guadagno in termini di efficienza e coerenza.
- sistemi di supporto decisionale: l’AI può integrare dati da dispositivi indossabili (wearables) e analizzare in tempo reale la letteratura scientifica per suggerire nuovi trial clinici o opzioni terapeutiche, diventando un potente alleato nel processo decisionale medico.
Potenziare la precisione diagnostica
L’impatto dell’AI sull’imaging medico è particolarmente profondo e si articola in due aree critiche.
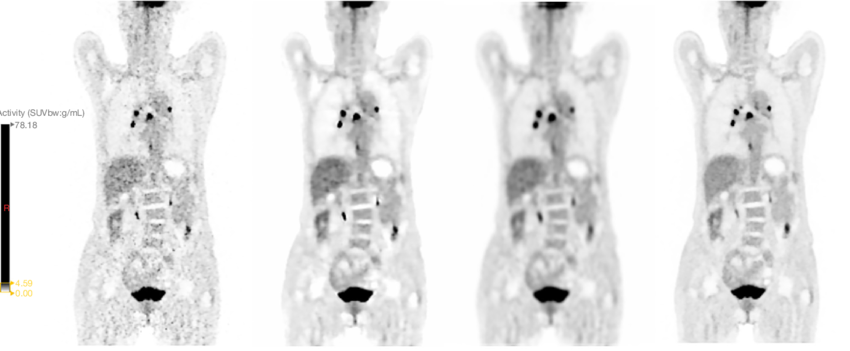
Ricostruzione e miglioramento dell’immagine: grazie al deep learning (es. modelli 3D U-Net), è possibile ottenere immagini diagnostiche di alta qualità partendo da dati acquisiti con dosi di tracciante ridotte fino a un centesimo. Il processo di addestramento consiste nel fornire al modello un’immagine a bassa dose (“brutta”) e l’immagine finale ad alta risoluzione, lasciando che l’algoritmo impari autonomamente la trasformazione. Questo, sebbene rivoluzionario, solleva il problema della “scatola nera”, in quanto il processo decisionale interno del modello non è trasparente.
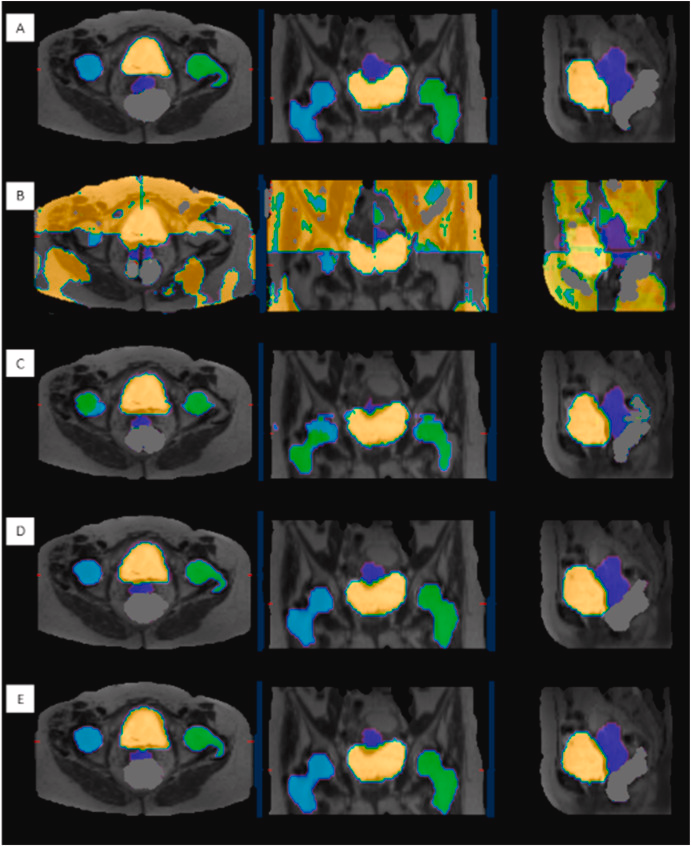
Contouring automatizzato del volume tumorale: il contouring manuale, descritto come “indaginoso, laborioso, time consuming, operatore dipendente”, viene trasformato dall’AI. I tempi si riducono drasticamente, passando da 2 ore a 20 minuti, fino a 2 minuti per paziente. Questo non solo genera un enorme guadagno di efficienza, ma introduce un livello di oggettività senza precedenti, permettendo di identificare, misurare e confrontare le lesioni nel tempo per una valutazione più accurata della risposta alla terapia.
L’utilità del contouring basato su AI (come le reti U-Net) risiede in un paradosso apparente: il suo successo si misura proprio dalla sua indistinguibilità dal lavoro manuale.
Quando addestriamo questi algoritmi, utilizziamo come ‘Gold Standard’ i contorni tracciati da medici esperti. L’AI impara a replicare quelle stesse curve, includendo correttamente il GTV (volume tumorale) e risparmiando gli organi a rischio (OAR), esattamente come farebbe un operatore umano.
Dal punto di vista qualitativo, quindi, non cambia molto: il risultato finale è clinicamente sovrapponibile. La rivoluzione è nel flusso di lavoro. Il contouring manuale è un compito ripetitivo, ‘time-consuming’ e soggetto a stanchezza. L’AI trasforma il ruolo del medico nucleare o del radioterapista: non più ‘disegnatore’ che parte da un foglio bianco, ma ‘supervisore’ che valida un lavoro già fatto.
L’AI fornisce una bozza ad alta fedeltà. Se la differenza geometrica è minima, il guadagno in termini di tempo e la standardizzazione del metodo (riducendo la variabilità inter-operatore) rappresentano il vero valore aggiunto per il sistema sanitario.
Il ruolo dell’AI nella ricerca medica
L’AI sta rivoluzionando anche il campo della ricerca, comprimendo i tempi e aprendo nuove frontiere.
Il progetto AlphaFold, vincitore del premio Nobel per la Chimica nel 2024, ha ridotto i tempi per l’identificazione di nuovi target farmacologici da anni a pochi giorni. Un esempio emblematico del processo tradizionale è il passaggio da un target identificato nel 1998 a un radiofarmaco utilizzabile nel 2016 (18 anni). In netto contrasto, l’AI di Google Co-Assistant ha identificato potenziali target per la fibrosi epatica in soli 5 giorni.
L’AI può generare dati sintetici di alta qualità per creare “bracci di controllo sintetici” nei trial clinici, amplificare i set di dati per le malattie rare e risolvere i limiti statistici degli studi. Il concetto di “synthetic twin” (gemello sintetico) è già una realtà applicata; farmaci approvati sulla base di trial che includono dati sintetici sono già in commercio, dimostrando che non si tratta di un’ipotesi futura ma di una pratica consolidata.
L’adozione di queste potenti innovazioni, tuttavia, non è priva di ostacoli. È indispensabile analizzare le sfide tecniche, etiche e strategiche che accompagnano questa trasformazione per governarla con successo.
Navigare il paesaggio dell’innovazione: sfide, collaborazione e strategia
Per capitalizzare appieno i benefici offerti da VR e AI, le strutture sanitarie devono affrontare un nesso di sfide interconnesse che legano l’infrastruttura tecnologica, i quadri normativi e il capitale umano. Il dibattito attuale può essere contestualizzato attraverso la Legge di Amara: tendiamo a sovrastimare l’impatto a breve termine della tecnologia, per poi sottostimarlo drasticamente nel lungo periodo. Comprendere questa dinamica è fondamentale per pianificare una transizione strategica e sostenibile.
L’adozione su larga scala dell’AI è frenata da barriere concrete che richiedono investimenti e pianificazione strategica.

I modelli di AI più avanzati dipendono da supercomputer, caratterizzati da elevati costi di acquisto e mantenimento (es. sistemi di raffreddamento) e da una rapida obsolescenza. Un sistema come Leonardo può diventare obsoleto in soli 4-5 anni. I principi di co-progettazione e sostenibilità economica, critici per il successo di strumenti rivolti al paziente come ‘Inerivi’, diventano ancora più vitali nella scalabilità di infrastrutture AI ad alta intensità di capitale, dove il mancato allineamento con le esigenze cliniche può tradursi in un’obsolescenza da svariati milioni di euro.
La risorsa più preziosa per l’AI è una grande quantità di dati strutturati e di alta qualità. È cruciale che questi dati siano rappresentativi della popolazione di riferimento per evitare bias e garantire che i modelli siano efficaci e sicuri per i pazienti locali.
Emerge la necessità di figure professionali ibride, con competenze “tra la medicina e l’informatica”. Non è realistico aspettarsi che i medici diventino programmatori; serve piuttosto un ponte tra i due mondi per tradurre le esigenze cliniche in soluzioni tecnologiche efficaci.
La narrativa della sostituzione dell’uomo da parte della macchina è fuorviante. Il futuro risiede in un modello di collaborazione sinergica.
Sia l’uomo che l’AI commettono errori, ma di natura diversa. L’AI può inventare dati (“allucinazioni”), compiere errori di ragionamento o mostrare tendenza a compiacere l’utente. L’errore umano è spesso legato a stanchezza o dati di partenza errati. Un benchmark di riferimento considera “buono” un modello che sbaglia una volta su 30, sottolineando la necessità di una supervisione umana.
L’efficacia di un modello di AI dipende criticamente dalla qualità delle istruzioni fornite. Per ottenere risultati affidabili è necessario fornire all’AI un ruolo chiaro, un obiettivo preciso, dettagli contestuali e persino un processo di pensiero da seguire “Prompt Engineering”.
L’AI non sostituirà il medico, ma ne aumenterà l’efficienza. Il modello operativo più efficace è quello della “catena di montaggio”: l’AI, con la sua alta sensibilità, segnala potenziali anomalie, mentre il medico, con la sua esperienza e specificità, valida, interpreta e prende la decisione finale.
Dati, privacy e quadri Normativi
Le implicazioni normative e di privacy rappresentano una delle sfide più delicate.

L’AI Act europeo si pone come un documento legislativo fondamentale per governare lo sviluppo e l’uso dell’AI. Allo stesso tempo, il GDPR, pur essendo una tutela fondamentale per i cittadini, rallenta l’adozione di alcune tecnologie in Europa.
La cautela normativa europea, seppur protettiva, sta creando un “deficit di dati” che alimenta direttamente il rischio di bias. Con i modelli di AI addestrati principalmente su dati americani, cinesi o indiani, la loro accuratezza e sicurezza per i pazienti europei è una preoccupazione strategica.
La scelta tra l’utilizzo di sistemi locali (on-premise) o su cloud solleva questioni cruciali di sicurezza dei dati. Le strategie di implementazione devono, quindi, prioritizzare la sicurezza e l’affidabilità lungo l’intera “supply chain” dell’intelligenza artificiale.
Nonostante queste sfide, l’adozione strategica di queste tecnologie non è un’opzione, ma un imperativo per garantire la sostenibilità e l’evoluzione del sistema sanitario.
Governare questa transizione non è un mero esercizio tecnologico, ma l’atto di leadership che definirà le istituzioni sanitarie di successo del prossimo decennio. La scelta non è se adottare queste tecnologie, ma se guidarne l’integrazione con la visione strategica necessaria per trasformare “The Smart Thing” in una pratica clinica standard.
Fonti:
- Inner Healing – Virtual Reality for Patients’ Wellbeing in Hospitals ↩︎
- Hu, Yiyi & Lv, Doudou & Jian, Shaojie & Lang, Limin & Cui, Caozhe & Liang, Meng & Song, Liwei & Li, Sijin & Wu, Zhifang. (2023). Comparative study of the quantitative accuracy of oncological PET imaging based on deep learning methods. Quantitative Imaging in Medicine and Surgery. 13. 10.21037/qims-22-1181. ↩︎
- Atallah Baydoun, Ke Xu, Latoya A. Bethell, Feifei Zhou, Jin Uk Heo, Kaifa Zhao, Elisha T. Fredman, Rodney J. Ellis, Pengjiang Qian, Raymond F. Muzic, Bryan J. Traughber,
Auto-contouring FDG-PET/MR images for cervical cancer radiation therapy: An intelligent sequential approach using focally trained, shallow U-Nets,
Intelligence-Based Medicine, Volume 5, 2021, 100026, ISSN 2666-5212,
https://doi.org/10.1016/j.ibmed.2021.100026
↩︎- AlphaFold Machine learning ↩︎
- Supercomputer Leonardo ↩︎