La terapia con iodio-131 radioattivo (RAI) è utilizzata per il trattamento dell’ipertiroidismo da oltre 80 anni, da quando il dottor Saul Hertz somministrò con successo la prima dose terapeutica di radioiodio-131 (I-131) ad un paziente affetto da malattia di Basedow-Graves (GD) all’inizio del 1941.
La logica alla base della terapia con RAI si fonda sulla capacità delle cellule follicolari tiroidee di captare il Na[¹³¹I]I, esattamente come lo iodio stabile (¹²⁷I) assorbito attraverso la dieta.
Dopo la Seconda Guerra Mondiale, la terapia con I-131 divenne un trattamento standard per l’ipertiroidismo e successivamente per il carcinoma tiroideo differenziato.
Il radioiodio è l’agente classico utilizzato per la diagnosi e il trattamento delle patologie tiroidee benigne, basato sull’espressione del simportatore sodio-iodio (NIS) nel tessuto tiroideo normale. Il suo ampio utilizzo medico rappresenta la prima applicazione del concetto teragnostico in medicina, rimanendo ancora oggi una pietra miliare della terapia radiometabolica.
L’uso della terapia RAI ha drasticamente ridotto il numero di pazienti che necessitano di intervento chirurgico per il trattamento definitivo dell’ipertiroidismo, diminuendo così sia il rischio di complicanze chirurgiche (es. paralisi del nervo laringeo ricorrente e superiore, ipoparatiroidismo, emorragia) che i costi sanitari.
Caricamento…
- Indicazioni
- Criteri che favoriscono la scelta del RAI
- Controindicazioni
- Trattamenti alternativi
- 💊 Farmaci antitiroidei
- 🔪 Chirurgia tiroidea
- 👀 Sorveglianza attiva (“Watchful waiting”)
- Caratteristiche dell’isotopo Na[¹³¹I]I
- 🧬 Biodistribuzione e metabolismo
- Preparazione del paziente
- 💊 Preparazione farmacologica
- 🍽️ Dieta povera di iodio
- 🥼 Preparazione diagnostica
- Metodi di somministrazione
- Esecuzione della terapia radiometabolica con ¹³¹I
- Approcci terapeutici
- Approccio funzionale
- Approccio ablativo
- Dosimetria
- Metodo a dose fissa
- Dosimetria personalizzata
- Effetti collaterali
- Effetti acuti
- Effetti tardivi
- Raccomandazioni post-terapia
- Follow-up
- Controlli clinici e laboratoristici
- Valutazione dell’efficacia terapeutica
- Prospettive future
Caricamento…
Indicazioni
L’uso terapeutico del Na[¹³¹I]I ha due principali applicazioni:
- Trattare l’ipertiroidismo in pazienti con:
- Malattia di Graves (GD);
- Gozzo tossico uninodulare o multinodulare (TNG/TMNG);
- Ridurre il volume della ghiandola (es. in GD o gozzo non tossico – NTG) o dei noduli iperfunzionanti.
Nel contesto della Malattia di Graves (GD), la terapia con iodio radioattivo può rappresentare una valida opzione nei pazienti che presentano controindicazioni all’uso dei farmaci antitiroidei (ATD), oppure in caso di recidiva dell’ipertiroidismo dopo trattamento medico. È particolarmente indicata nei pazienti anziani o in presenza di comorbidità cardiovascolari, dove il trattamento farmacologico o chirurgico può comportare rischi aumentati. La scelta può inoltre essere orientata dalla preferenza del paziente, soprattutto nei casi in cui si desideri una soluzione definitiva.
Nel Gozzo Tossico Nodulare (TNG o TMNG), il trattamento con RAI è indicato in presenza di noduli iperfunzionanti che determinano ipertiroidismo subclinico o conclamato, soprattutto quando si desidera evitare la chirurgia o in presenza di condizioni cliniche che aumentano il rischio operatorio.
Anche nel caso di Gozzo Non Tossico (NTG), la terapia radiometabolica può essere presa in considerazione quando si desidera ottenere una riduzione del volume tiroideo in pazienti sintomatici, ad esempio con disfagia o dispnea legata alla compressione da parte del gozzo, e quando vi siano controindicazioni alla chirurgia.
Criteri che favoriscono la scelta del RAI
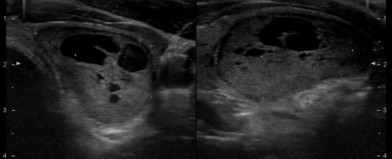
La terapia con iodio radioattivo è particolarmente efficace in presenza di un gozzo di dimensioni piccole o medie (volume inferiore a 80 mL) e/o con estensione intratoracica.
Risultati migliori si ottengono anche nei casi con un elevato uptake tiroideo di iodio (RAIU).
Nel contesto della Malattia di Graves, è importante che non vi sia oftalmopatia attiva grave.
L’età superiore ai 10 anni è un ulteriore requisito per la sicurezza del trattamento.
Nei pazienti con gozzi voluminosi, si può considerare l’impiego combinato di RAI e rhTSH, sebbene si tratti di un uso off-label.
Nei pazienti anziani, infine, la terapia radiometabolica è spesso preferibile alla chirurgia, poiché consente di ridurre i rischi legati all’intervento.
Controindicazioni
La RAI è controindicata in modo assoluto in alcune situazioni cliniche ben definite. Innanzitutto, la gravidanza rappresenta una condizione in cui il trattamento è vietato, a causa del rischio di danni al feto. Prima di ogni trattamento, è obbligatorio eseguire un test β-hCG ematico per escludere una gravidanza in corso; il test ha una validità massima di 72 ore. In caso di incertezza o ritardi nell’accertamento, la terapia deve essere rinviata. Inoltre, è fondamentale che la paziente eviti gravidanze nei 4-6 mesi successivi al trattamento, per prevenire potenziali effetti avversi sulla futura gravidanza.
Anche l’allattamento costituisce una controindicazione assoluta: deve essere sospeso almeno sei settimane prima della somministrazione del radioiodio per ridurre il rischio di danno al tessuto mammario.
Un’altra condizione in cui la RAI non deve essere eseguita è il sospetto di carcinoma tiroideo, diagnosticato oppure in presenza di citologia tiroidea indeterminata, in quanto richiede un approccio terapeutico completamente diverso.
Infine, l’età inferiore ai 5 anni rappresenta una controindicazione assoluta, in quanto nei bambini molto piccoli esiste un rischio teorico, ma significativo, di sviluppare neoplasie a lungo termine dopo esposizione a radiazioni.
Oltre alle controindicazioni assolute, esistono anche controindicazioni relative, che richiedono una valutazione caso per caso del bilancio tra rischi e benefici. Nei bambini tra 5 e 10 anni, ad esempio, è generalmente preferibile ricorrere alla chirurgia o prolungare la terapia medica.
In presenza di oftalmopatia attiva di Graves, vi è un rischio concreto di peggioramento dopo RAI: in questi casi, se la terapia è ritenuta necessaria, è indicata l’associazione con steroidi a scopo profilattico.
Anche i gozzi voluminosi (superiori a 80 mL) rappresentano una sfida: l’efficacia del trattamento può essere limitata e vi è il rischio di peggioramento della sintomatologia compressiva.
Sebbene rara, va inoltre tenuta in considerazione la possibilità di ipersensibilità allo iodio, che potrebbe complicare la somministrazione.
La sicurezza della terapia con radioiodio dipende da un’attenta selezione dei pazienti. È fondamentale valutare ogni singolo caso con scrupolo e, quando i rischi superano i potenziali benefici, non esitare a optare per trattamenti alternativi.
Caricamento….
Trattamenti alternativi
Quando la terapia con iodio radioattivo non è indicata o preferita, esistono diverse opzioni terapeutiche alternative per la gestione dell’ipertiroidismo, da valutare in base al quadro clinico, all’età del paziente e alle sue preferenze.
💊 Farmaci antitiroidei
Tra i principali farmaci utilizzati troviamo tiamazolo, propiltiouracile e metimazolo. Questi farmaci sono utili soprattutto nella fase iniziale del trattamento, per ottenere un rapido controllo dei sintomi ipertiroidei. Sono la terapia di prima scelta in gravidanza, durante l’allattamento e nei pazienti giovani, dove le terapie definitive possono essere rimandate. Tuttavia, è importante ricordare che non rappresentano una soluzione curativa a lungo termine: le recidive dopo sospensione sono frequenti. Inoltre, sebbene rari, vanno considerati i potenziali eventi avversi, come epatotossicità e agranulocitosi, che richiedono monitoraggio clinico e laboratoristico regolare.
🔪 Chirurgia tiroidea
La tiroidectomia subtotale o totale rappresenta una valida alternativa, in particolare in età pediatrica o in presenza di gozzo voluminoso e/o con sintomi compressivi (volume >80 mL), quando vi è sospetto di malignità o nei casi di oftalmopatia attiva in cui la RAI è controindicata.
La chirurgia è anche indicata quando non è possibile ricorrere al radioiodio per altri motivi clinici. È però un trattamento invasivo che richiede ospedalizzazione e comporta rischi chirurgici, tra cui ipoparatiroidismo e disfonia legata a danno del nervo ricorrente.
👀 Sorveglianza attiva (“Watchful waiting“)
In alcuni casi selezionati, soprattutto nei pazienti anziani o fragili, o in presenza di noduli autonomi asintomatici o ipertiroidismo subclinico, può essere indicato un approccio conservativo.
La sorveglianza attiva prevede un monitoraggio regolare della funzione tiroidea (TSH) e un follow-up ecografico per valutare l’evoluzione del quadro clinico. Questa strategia è utile quando il rischio legato al trattamento supera quello della malattia stessa.
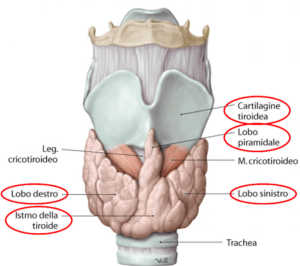
Caratteristiche dell’isotopo Na[¹³¹I]I
Il radioiodio Na[¹³¹I]I è un isotopo largamente utilizzato nella terapia dell’ipertiroidismo e di alcune patologie tiroidee, grazie alle sue proprietà fisiche e biologiche favorevoli.
L’isotopo ha una emivita fisica di circa 8 giorni (8.02 giorni), il che consente un’attività terapeutica efficace nel tempo, pur garantendo un progressivo decadimento della radioattività.
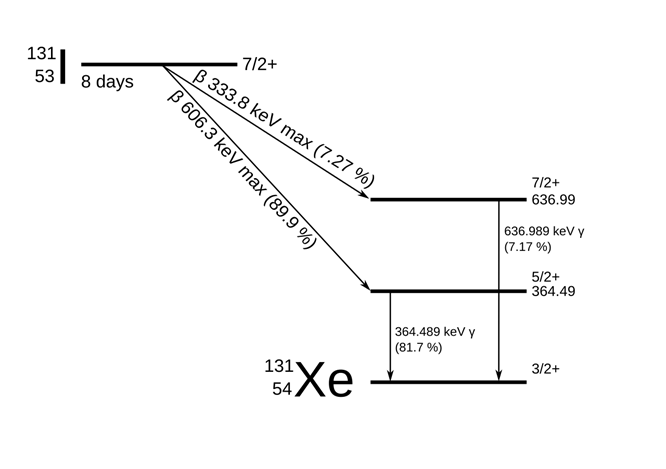
Il decadimento avviene principalmente per emissione di particelle beta (β⁻), che rappresentano il 90% dell’energia rilasciata. Le particelle β⁻ hanno un’energia media di 192 keV e un range tessutale compreso tra 0.4 e 2 mm, sufficiente ad esercitare un effetto citotossico localizzato, mirato a distruggere selettivamente il tessuto tiroideo iperfunzionante.
Accanto a ciò, il radioiodio emette anche raggi gamma, in particolare con un’energia di 364 keV (circa il 10% dell’energia totale), che consente il monitoraggio della biodistribuzione attraverso imaging gamma (es. scintigrafia), pur contribuendo in minima parte all’effetto terapeutico.
L’impiego di Na[¹³¹I]I offre numerosi vantaggi:
- precisione terapeutica: colpisce selettivamente il tessuto tiroideo captante, con basso rischio di danneggiare le strutture circostanti come le paratiroidi o il nervo ricorrente.
- approccio mininvasivo: a differenza della chirurgia, la somministrazione avviene per via orale, senza necessità di incisioni o ricovero prolungato.
- costo-efficacia: il trattamento comporta generalmente minori costi e ospedalizzazioni rispetto all’intervento chirurgico, rendendolo una scelta sostenibile ed efficiente nei casi appropriati.
🧬 Biodistribuzione e metabolismo
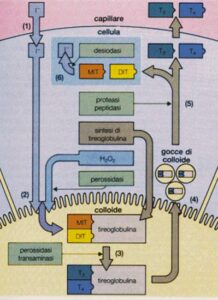
Il successo della terapia radiometabolica si basa sull’alta affinità del tessuto tiroideo per lo iodio, elemento essenziale per la sintesi degli ormoni tiroidei. Lo iodio radioattivo ¹³¹I viene captato attivamente dai tireociti attraverso il trasportatore sodio-iodio (NIS), espresso selettivamente sulla membrana basolaterale delle cellule follicolari.
L’effetto è selettivo sulle cellule funzionanti, le aree non funzionanti (fredde) non captano lo I-131 e non vengono irradiate.
Una volta all’interno del tessuto tiroideo, il radioiodio si concentra nei follicoli tiroidei, dove rilascia le sue radiazioni β⁻. Queste inducono danni citotossici a livello del DNA e dei mitocondri, provocando apoptosi cellulare e successiva fibrosi del tessuto trattato.
Il risultato clinico della terapia si manifesta in genere entro 3–6 mesi, con una progressiva riduzione della funzione tiroidea. L’esito può essere il raggiungimento dell’eutiroidismo oppure l’instaurarsi di un ipotiroidismo, che viene successivamente gestito con terapia sostitutiva ormonale.
L’eliminazione dell’isotopo avviene principalmente per via renale (attraverso le urine) e in parte attraverso le ghiandole salivari, motivo per cui è importante una buona idratazione e l’adozione di misure per ridurre l’esposizione delle ghiandole salivari dopo il trattamento.
Caricamento….
Preparazione del paziente
Una corretta preparazione del paziente è fondamentale per il successo della terapia radiometabolica. L’obiettivo principale è ottimizzare la captazione del radioiodio da parte del tessuto tiroideo, migliorando l’efficacia terapeutica e riducendo al minimo l’esposizione inutile di altri organi. La preparazione si basa su due pilastri principali: l’ottimizzazione farmacologica e la restrizione alimentare dello iodio.
💊 Preparazione farmacologica
1. Sospensione della terapia tireostatica
I farmaci antitiroidei come metimazolo, propiltiouracile (PTU) e tiamazolo, pur essendo essenziali per il controllo iniziale dei sintomi ipertiroidei, devono essere sospesi alcuni giorni prima del trattamento con ¹³¹I (in genere 3–7 giorni prima).
Questo passaggio è cruciale perché questi farmaci non solo bloccano la sintesi degli ormoni tiroidei, ma inibiscono anche l’espressione del trasportatore NIS (simportatore sodio-iodio), responsabile della captazione attiva dello iodio radioattivo da parte dei tireociti.
2. Sospensione di altri farmaci o sostanze interferenti
Oltre agli antitiroidei, è necessario interrompere l’assunzione di sostanze ricche di iodio che possono saturare la tiroide e ridurre l’efficacia della terapia:
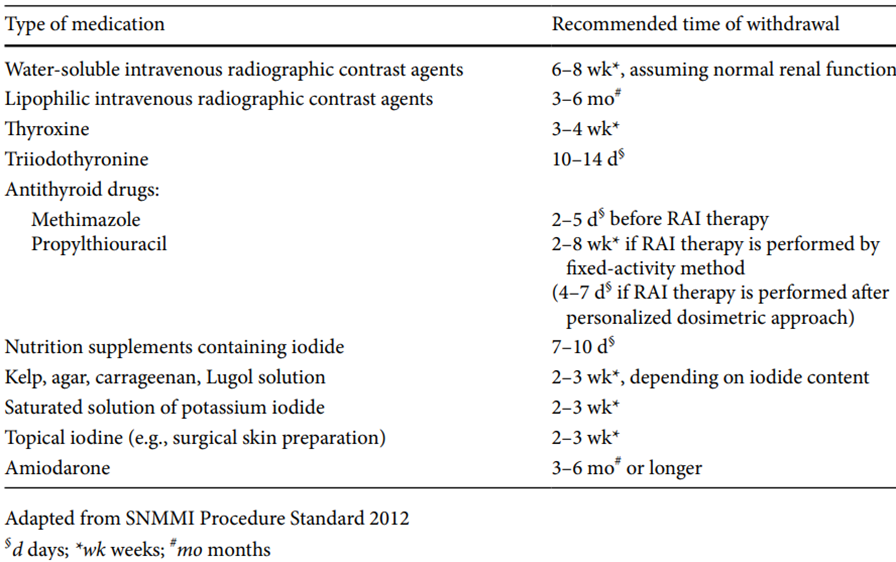
- integratori a base di iodio: sospendere almeno 7–10 giorni prima;
- mezzi di contrasto iodati (usati in TC o angiografie): richiedono una sospensione di almeno 6 settimane;
- amiodarone: farmaco antiaritmico ad alto contenuto iodato e lunga emivita, può alterare il metabolismo tiroideo per mesi; sospensione consigliata 3–6 mesi prima, se clinicamente possibile.
🍽️ Dieta povera di iodio
Un altro aspetto essenziale della preparazione è la restrizione dietetica dello iodio, da seguire per 5–14 giorni prima della somministrazione del radioiodio.
Questa dieta ha lo scopo di deprivare l’organismo dello iodio “non radioattivo”, aumentando così l’espressione del NIS e, di conseguenza, la captazione preferenziale del ¹³¹I da parte del tessuto tiroideo.

Alimenti da evitare:
- pesce e frutti di mare (comprese alghe);
- latticini e uova;
- alimenti industriali contenenti sale iodato;
- integratori o farmaci contenenti iodio.
Alimenti consentiti:
- carni fresche non lavorate;
- cereali semplici (pane senza sale iodato, riso, pasta);
- verdure (non in salamoia o trattate con iodio);
- sale non iodato (da usare con moderazione).
🥼 Preparazione diagnostica
Prima di procedere con la somministrazione del radioiodio, è fondamentale eseguire una valutazione diagnostica completa, che consenta di confermare l’indicazione alla terapia, definire le caratteristiche del tessuto tiroideo da trattare e garantire la sicurezza del paziente. Questa fase preparatoria si basa su una serie di esami mirati di laboratorio e strumentali.
1. Esami di funzionalità tiroidea
I test ormonali servono a valutare lo stato funzionale della tiroide e a confermare la presenza di ipertiroidismo:
- TSH (Thyroid Stimulating Hormone);
- FT3 e FT4 (frazioni libere degli ormoni tiroidei);
- TRAb (anticorpi anti-recettore del TSH): utili in particolare nella Malattia di Graves, per confermare la natura autoimmune della patologia.
Questi esami sono fondamentali per determinare la fase della malattia e per programmare la sospensione di eventuali terapie antitiroidee.
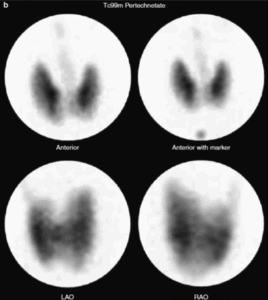
2. Scintigrafia tiroidea
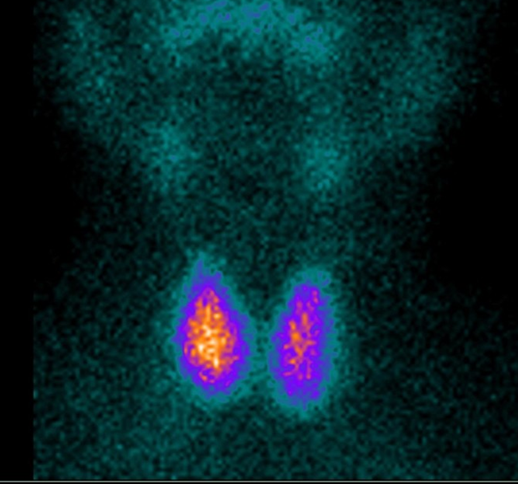
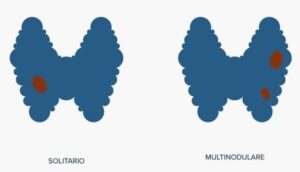
La scintigrafia con Tc-99m o I-123 consente di visualizzare la distribuzione del tessuto tiroideo funzionante e identificare eventuali aree iperfunzionanti (noduli autonomi) o assenza di captazione.
Questa informazione è essenziale per distinguere tra Morbo di Basedow (captazione diffusa) e gozzo multinodulare tossico (captazione disomogenea), oltre che per escludere sospetti di neoplasia, in cui la captazione può essere assente.
3. Ecografia tiroidea
L’ecografia tiroidea rappresenta lo strumento di riferimento per valutare:
- il volume della ghiandola (utile per il dosaggio del radioiodio);
- la morfologia tiroidea (presenza di noduli, cisti, calcificazioni);
- eventuali segni sospetti per malignità.
È un esame non invasivo, ampiamente disponibile e complementare alla scintigrafia.
4. Radioiodine Uptake (RAIU)
Il test di captazione del radioiodio (RAIU) misura quanto iodio viene assorbito dalla tiroide in un dato intervallo di tempo, di solito a 2, 6 e 24 ore.
È utile per:
- quantificare l’attività tiroidea;
- stabilire il dosaggio terapeutico del ¹³¹I;
- prevedere la risposta al trattamento.
Un RAIU elevato è indicativo di alta attività tiroidea e generalmente si associa a migliore efficacia terapeutica.
5. Test di gravidanza (β-hCG ematico)
In tutte le donne in età fertile, è obbligatorio eseguire un test di gravidanza su sangue (β-hCG), preferibilmente nelle 72 ore precedenti alla terapia. In caso di dubbio, la somministrazione va sempre rinviata.
Metodi di somministrazione
La somministrazione del radioiodio avviene quasi sempre per via orale, sotto forma di capsula o soluzione liquida. In casi molto particolari, si può ricorrere alla via endovenosa. La scelta dipende dalle condizioni cliniche del paziente, dalla praticità del trattamento e dalla necessità di garantire un assorbimento efficace e sicuro.

Nella grande maggioranza dei casi, il radioiodio viene assunto per bocca. Il paziente si presenta in ambulatorio, e dopo una breve preparazione riceve il farmaco, solitamente in forma di capsula. È importante che sia in posizione eretta al momento dell’assunzione, per facilitare la deglutizione e ridurre il rischio di reflusso.
Le capsule o le soluzioni vengono conservate in contenitori schermati, per proteggere il personale sanitario dalle radiazioni. Dopo l’assunzione, si utilizza un contatore Geiger per controllare che il farmaco sia stato ingerito correttamente e che non ci siano residui radioattivi all’esterno del corpo o nell’ambiente.
Ci sono due principali forme orali del radioiodio:
- la capsula è la forma più utilizzata, scelta in oltre il 90% dei casi. È pratica, ben tollerata e riduce al minimo il rischio di contaminazione. Tuttavia, ha un costo leggermente superiore rispetto alla soluzione;
- la soluzione liquida è impiegata quando è necessario adattare con precisione la dose, ad esempio nei bambini, nei pazienti molto anziani o in condizioni cliniche particolari. Ha però qualche svantaggio: è più facile che si verifichi una perdita accidentale, e il rischio di contaminazione ambientale è maggiore, richiedendo quindi una gestione più attenta.
In casi rari, quando il paziente non è in grado di deglutire (ad esempio per problemi neurologici o chirurgici) oppure ha problemi di assorbimento intestinale, si può optare per la somministrazione per via endovenosa. Iniettando il radioiodio direttamente in vena, si garantisce un assorbimento completo e immediato.
Questa procedura richiede però un ambiente controllato, personale esperto e particolari precauzioni radioprotezionistiche. È una modalità più complessa, ma resta indispensabile in alcune situazioni cliniche delicate.
| Forma | Vantaggi | Svantaggi | Uso tipico |
| Capsula | Minor rischio contaminazione | Costo più elevato | Routine (95% dei casi) |
| Soluzione | Dose personalizzabile | Rischio perdite/spillage | Pazienti difficili |
| Endovenosa | Assorbimento garantito | Procedure complesse | Rari casi speciali |
Esecuzione della terapia radiometabolica con ¹³¹I
La somministrazione del radioiodio deve avvenire in un ambiente protetto e controllato, nel pieno rispetto delle norme di radioprotezione, sia per la sicurezza del paziente che del personale sanitario.
La stanza destinata alla terapia con radioiodio è appositamente attrezzata. Le pareti e gli arredi devono essere schermati con materiali contenenti piombo (≥2 mm di spessore), per ridurre al minimo la dispersione di radiazioni verso l’esterno.
È inoltre fondamentale che sia presente un sistema di ventilazione forzata con filtri HEPA, che permette di trattenere eventuali particelle radioattive aerodisperse. All’uscita della stanza viene predisposta una zona di controllo contaminazione, dove il personale può effettuare i controlli necessari per verificare che non vi siano residui radioattivi sul paziente o sugli oggetti portati con sé.
Per garantire un’esecuzione sicura ed efficace, vengono utilizzati diversi strumenti, tra cui:

- un contatore Geiger, per rilevare eventuali contaminazioni ambientali o superficiali post-somministrazione;
- dosimetri sia ambientali che personali, per monitorare costantemente i livelli di esposizione alle radiazioni;
- un kit d’emergenza che include farmaci antiemetici (contro nausea e vomito), corticosteroidi, e materiale per la decontaminazione, nel caso si verifichino incidenti o reazioni avverse.
Una complicanza possibile, sebbene non frequente, è il vomito poco dopo la somministrazione della dose di radioiodio. La gestione dipende dal tempo trascorso dall’ingestione:
- se il vomito si verifica entro un’ora: si valuta la possibilità di ripetere la somministrazione, poiché è probabile che gran parte del radioiodio non sia stato assorbito;
- se il vomito avviene dopo un’ora: in genere si preferisce monitorare il residuo di attività tiroidea tramite imaging, piuttosto che ripetere la dose, dato che l’assorbimento è verosimilmente già avvenuto.
Caricamento….
Approcci terapeutici
Nel trattamento con radioiodio (Na[¹³¹I]I), l’obiettivo terapeutico può variare a seconda delle caratteristiche del paziente, della patologia tiroidea e delle preferenze cliniche. Esistono infatti due approcci principali, detti funzionale e ablativo, ciascuno con finalità e strategie differenti.
La scelta tra approccio funzionale e ablativo dipende da numerosi fattori:
- il tipo di patologia (Graves, gozzo multinodulare tossico, ecc.);
- la gravità dell’ipertiroidismo;
- l’età e le condizioni generali del paziente;
- le sue preferenze;
- le prospettive di aderenza alla terapia e al follow-up.
In ogni caso, l’obiettivo comune resta quello di ripristinare un equilibrio ormonale sicuro e sostenibile nel tempo, minimizzando il rischio di complicanze e ottimizzando la qualità di vita del paziente.
Approccio funzionale
Questo approccio mira a correggere l’ipertiroidismo riportando il paziente a una condizione di eutiroidismo, cioè una funzione tiroidea normale, senza necessariamente arrivare all’ipotiroidismo. Si punta anche a ottenere una riduzione del volume della ghiandola tiroidea, soprattutto in presenza di gozzo.
L’efficacia dell’approccio funzionale è buona, ma non assoluta: si osserva un successo terapeutico in circa il 60–70% dei casi. Per questo motivo, è possibile che alcuni pazienti richiedano una seconda somministrazione di radioiodio, tipicamente dopo un intervallo di almeno 3–6 mesi, per completare il trattamento.
Approccio ablativo
L’approccio ablativo ha invece come obiettivo quello di distruggere in modo definitivo il tessuto tiroideo funzionante, portando volutamente il paziente a una condizione di ipotiroidismo controllato, facilmente gestibile con terapia sostitutiva a base di levotiroxina.
Rispetto all’approccio funzionale, la strategia ablativa consente una maggiore riduzione volumetrica della ghiandola e presenta un’efficacia molto elevata, con un tasso di successo superiore al 90%.
Uno dei principali vantaggi di questo approccio è la bassa probabilità di recidiva dell’ipertiroidismo, rendendolo la scelta preferita in molte situazioni cliniche, in particolare nei casi di malattia di Graves con elevato rischio di ricaduta, nei pazienti giovani o in quelli difficili da monitorare nel lungo termine.
| Malattia | Dose assorbita | Obiettivo |
| GD | 100–150 Gy | Normalizzare la funzione tiroidea (concetto di dose funzionale) |
| GD | 200–300 Gy | Ipotiroidismo e sostituzione (concetto di dose ablativa) |
| TNG | 300–400 Gy | Normalizzare la funzione tiroidea (concetto di dose funzionale) |
| TMNG | 150–300 Gy | Normalizzare la funzione tiroidea (concetto di dose funzionale) |
Dosimetria
Nel trattamento con radioiodio (Na[¹³¹I]I) per l’ipertiroidismo, la determinazione della dose da somministrare rappresenta un passaggio cruciale, in quanto influenza direttamente l’efficacia terapeutica e il rischio di effetti collaterali. Esistono due principali strategie: il metodo a dose fissa e la dosimetria personalizzata.
Metodo a dose fissa
Il metodo a dose fissa è da tempo uno degli approcci più utilizzati, soprattutto per la sua semplicità operativa. Nella forma originaria, prevedeva la somministrazione di una stessa quantità standard di iodio radioattivo a tutti i pazienti, senza considerare le caratteristiche individuali. Oggi, però, questo approccio si è evoluto verso una forma più raffinata, in cui la dose viene ottimizzata in base a fattori clinici semplici ma rilevanti.
Ad esempio, si possono considerare:
- le dimensioni della tiroide, stimate con palpazione, ecografia o scintigrafia;
- il grado di captazione del radioiodio da parte della ghiandola (RAIU);
- la velocità di eliminazione dello iodio (turnover), che può ridurre l’efficacia se troppo elevata.
Questo approccio consente di semplificare l’iter pre-terapeutico e organizzare la terapia con maggiore rapidità. Tuttavia, non è privo di limiti: la somministrazione di una dose non calibrata con precisione può comportare un rischio di sottodosaggio (e quindi di fallimento terapeutico) oppure di sovradosaggio, con esposizione radiologica superiore al necessario.
Il metodo a dose fissa risulta comunque efficace e adeguato nella maggior parte dei casi clinici semplici, come nei pazienti adulti con gozzo di dimensioni moderate (tra 20 e 50 mL) e un uptake tiroideo tra il 30% e il 70%. In questi casi, è spesso sufficiente per ottenere buoni risultati, senza la necessità di calcoli più complessi.
Dosimetria personalizzata
Nei casi più complessi, o quando si desidera una maggiore accuratezza nel trattamento, si può ricorrere alla dosimetria personalizzata, un metodo che permette di calcolare l’attività di Na[¹³¹I]I da somministrare in modo mirato. Questo approccio tiene conto di diverse variabili individuali del paziente, al fine di personalizzare la terapia e ottimizzare i risultati.
Il calcolo si basa su una formula fisica ma si possono utilizzare dei software che facilitano il calcolo. Tuttavia una formula semplificata può essere la seguente:
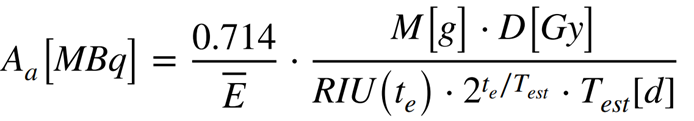
Dove:
- A: Attività da somministrare (MBq);
- M: massa tiroidea (misurata con ecografia/TC);
- D: dose assorbita desiderata, espressa in Gray (Gy);
- RIU: captazione massima del radioiodio (% di ¹³¹I nella tiroide, misurata a 24h, es. 60% → 0.60);
- Test: emivita effettiva, cioè il tempo in cui il radioiodio resta attivo nella ghiandola (se non misurata, usare 5.5 giorni);
- Ē = Costante di energia depositata, che tiene conto del tipo di radiazione emessa (0.192 Gy·g/MBq·giorno).
📊 Esempio:
In un paziente con malattia di Graves, tiroide di 30 g, uptake del 50% e una Test di 5.5 giorni, per ottenere una dose terapeutica di 250 Gy, sarà necessario somministrare circa 568 MBq di iodio-131.
Questa metodica è indicata in diverse situazioni cliniche, ad esempio:
- gozzi molto grandi (>50 mL) o molto piccoli (<20 mL);
- uptake estremamente basso (<20%) o elevato (>80%);
- pazienti giovani o in età pediatrica;
- presenza di comorbidità, in particolare cardiopatie o oftalmopatia di Graves;
- situazioni con turnover iodico accelerato, in cui il radioiodio viene eliminato troppo rapidamente dalla tiroide (in questi casi si consiglia di aumentare la dose calcolata del 20%).
| Approccio | Quando usarlo | Punti di forza | Limiti principali |
|---|---|---|---|
| Dose fissa ottimizzata | Pazienti adulti con gozzi medi e senza comorbidità | Semplice, veloce, ampiamente usato | Meno preciso, rischio recidiva o ipotiroidismo precoce |
| Dosimetria personalizzata | Gozzi voluminosi o piccoli, uptake estremo, pazienti pediatrici o fragili | Alta precisione e adattamento individuale | Richiede calcoli, tempo e strumenti dedicati |
Effetti collaterali
La terapia con radioiodio (RAI) è un trattamento efficace per diverse patologie tiroidee, ma come ogni terapia può presentare alcuni effetti collaterali che è importante conoscere per gestirli al meglio.
Effetti acuti
Nei primi giorni o settimane dopo la terapia, è abbastanza comune avvertire un lieve gonfiore o fastidio nella zona della tiroide. Questo succede perché il radioiodio provoca una reazione infiammatoria locale. Se il paziente aveva già un gozzo voluminoso, potrebbe addirittura percepire una certa difficoltà a respirare, anche se si tratta di casi rari. Per alleviare questi disturbi, di solito si ricorre a semplici antinfiammatori, mentre nei casi più seri il medico potrebbe prescrivere cortisonici per breve tempo.
Un altro effetto precoce è la cosiddetta “tiroidite da radiazioni“, che può causare un temporaneo peggioramento dei sintomi dell’ipertiroidismo. Questo accade perché le cellule tiroidee danneggiate rilasciano improvvisamente gli ormoni che contenevano. In questi casi, il paziente potrebbe avvertire più tachicardia, nervosismo o sudorazione del solito. Nei casi più seri, addirittura si può verificare una rara ma pericolosa “tempesta tiroidea“, con febbre alta e alterazioni dello stato mentale. Per prevenire questi problemi, spesso vengono prescritti beta-bloccanti e, in alcuni casi, farmaci antitiroidei per qualche settimana.
Le ghiandole salivari, soprattutto le parotidi, possono infiammarsi perché assorbono una piccola parte del radioiodio. Questo può portare a gonfiore, dolore alla mandibola e persino a una fastidiosa secchezza delle fauci. Per ridurre questo rischio, molti medici consigliano di succhiare caramelle acide o bere succo di limone subito dopo la terapia, per stimolare la produzione di saliva e “pulire” le ghiandole.
Effetti tardivi
Passando agli effetti tardivi, il più comune è senza dubbio l’ipotiroidismo. Nelle prime settimane può essere transitorio e spesso non dà sintomi, ma quando è permanente (soprattutto con i trattamenti più intensivi) richiederà l’assunzione quotidiana di ormone tiroideo sostitutivo. Per questo è fondamentale fare regolari controlli della tiroide nei mesi successivi al trattamento.
Per i pazienti con malattia di Graves, c’è un’attenzione particolare all’occhio. In alcuni casi, infatti, la terapia con radioiodio può peggiorare l’orbitopatia, soprattutto in chi fuma o ha livelli elevati di anticorpi anti-tiroide. Per questo, nei pazienti a rischio si può valutare una profilassi con cortisonici per qualche settimana.
Un aspetto interessante è la cosiddetta sindrome di Marine-Lenhart, una condizione rara in cui dopo il trattamento possono comparire noduli iperfunzionanti in pazienti con Graves. In questi casi, potrebbe essere necessario un ulteriore ciclo di terapia.
È importante sottolineare che, contrariamente a quanto alcuni pensano, non c’è alcuna evidenza che il radioiodio aumenti il rischio di tumori o riduca l’aspettativa di vita quando usato nelle dosi appropriate.
Raccomandazioni post-terapia
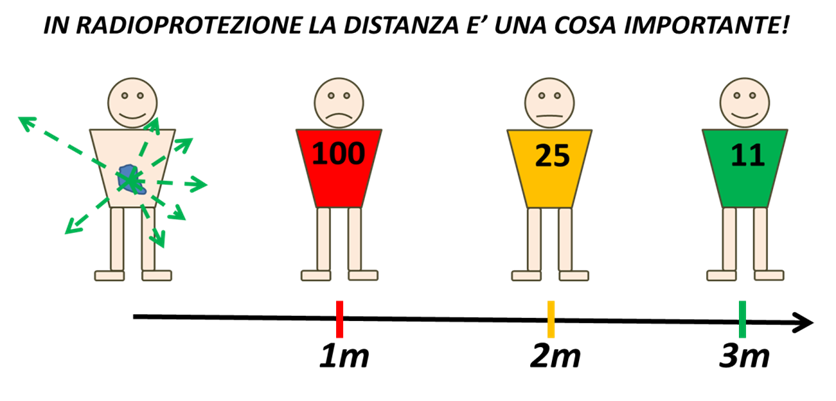
Dopo aver ricevuto il trattamento con iodio-131, è importante adottare alcune precauzioni fondamentali per garantire la sicurezza del paziente e, soprattutto, delle persone che gli stanno vicino. Questo perché, anche se l’effetto terapeutico è dovuto principalmente alle radiazioni beta (che hanno un’azione locale e limitata), una piccola parte del radioiodio emette radiazioni gamma, capaci di attraversare i tessuti e potenzialmente esporre gli altri a basse dosi di radiazioni.
Nei giorni successivi alla terapia, il corpo del paziente emette ancora una quantità di radioattività che, pur bassa, può rappresentare un rischio per chi gli sta vicino, soprattutto per bambini piccoli e donne in gravidanza. Per questo motivo, si consiglia di ridurre al minimo i contatti stretti con altre persone, soprattutto nei primi 3–7 giorni dopo la somministrazione.
In particolare, è utile:
- dormire in una stanza separata;
- evitare di abbracciare o tenere in braccio bambini;
- stare a una distanza di almeno un paio di metri da altre persone, soprattutto nei primi giorni;
- evitare viaggi in treno, autobus o aereo durante questo periodo.

Solitamente si raccomanda un breve periodo di isolamento domiciliare, che dura tra i 2 e i 3 giorni, a seconda della dose ricevuta. Questo non significa un isolamento totale, ma piuttosto adottare delle attenzioni: mangiare separatamente, usare asciugamani e posate personali, e possibilmente un bagno dedicato (oppure pulire accuratamente il bagno dopo ogni utilizzo).
Un altro consiglio molto semplice ma efficace è quello di mantenere una buona idratazione. Bere almeno 2 litri di acqua al giorno, soprattutto nei primi 3 giorni dopo la terapia, aiuta l’organismo ad eliminare più rapidamente lo iodio in eccesso, soprattutto attraverso le urine. Questo riduce non solo l’esposizione per il paziente stesso (soprattutto a livello di reni e vescica), ma anche il tempo necessario per tornare ad una radioattività “sicura” per gli altri.
Follow-up
Dopo aver eseguito la terapia, è fondamentale un attento monitoraggio clinico per valutare l’efficacia del trattamento e prevenire o riconoscere tempestivamente eventuali complicanze.
Un aspetto importante è la possibile insorgenza o peggioramento di alcune complicanze, come l’orbitopatia di Graves. In questo caso, è necessario monitorare attentamente eventuali sintomi oculari, quali esoftalmo o diplopia, e, in presenza di peggioramento, è consigliabile collaborare con un oftalmologo specializzato per una gestione appropriata.
Un’altra possibile complicanza è la scialoadenite cronica, che può manifestarsi con secchezza orale persistente; in questi casi, può essere utile valutare l’uso di stimolanti salivari per migliorare la sintomatologia.
Un’attenzione particolare va riservata allo sviluppo di ipotiroidismo, che può comparire dopo la terapia. Se i livelli di TSH risultano elevati, è indicato iniziare la terapia sostitutiva con levotiroxina, regolando il dosaggio in base sia ai sintomi riferiti dal paziente sia ai valori ematici di TSH. In alcuni casi, tuttavia, l’ipotiroidismo può essere transitorio: in questi pazienti si preferisce monitorare senza avviare immediatamente la terapia per un periodo di 2-3 mesi, in attesa di un possibile recupero spontaneo della funzione tiroidea.
Controlli clinici e laboratoristici
Il primo controllo va effettuato generalmente tra 4 e 8 settimane dopo la somministrazione del radioiodio. In questa fase si eseguono gli esami di laboratorio per dosare TSH, FT4 e FT3, oltre a un’attenta valutazione dei sintomi di ipotiroidismo o ipertiroidismo residuo.
Successivamente, i controlli proseguiranno con cadenza di circa 2-3 mesi fino a quando la funzione tiroidea si stabilizzerà, per poi passare a controlli ogni 6-12 mesi nel lungo termine. Durante questi follow-up, oltre alla funzione tiroidea (TSH e FT4), si valuta anche la presenza di eventuali noduli residui con l’ecografia, se indicata.
Attenzione particolare va posta a:
- possibili recidive di ipertiroidismo;
- comparsa di nuovi noduli tiroidei.
Valutazione dell’efficacia terapeutica

Il successo del trattamento si valuta principalmente attraverso gli esami tiroidei: un risultato ottimale è rappresentato dall’eutiroidismo, ovvero normali valori di TSH, FT3 e FT4.
In molti pazienti con malattia di Graves, è invece atteso un ipotiroidismo post-trattamento.
Se, al contrario, persiste l’ipertiroidismo, ciò indica un fallimento o una risposta parziale alla terapia, e potrebbe essere necessario valutare una seconda dose di radioiodio.
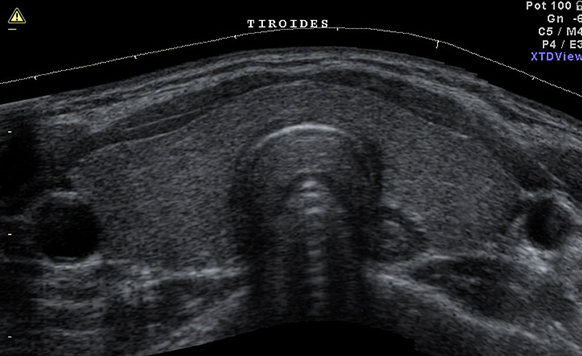
A distanza di 6-12 mesi è utile eseguire un’ecografia tiroidea per valutare volume e morfologia della ghiandola, e, se indicato, una scintigrafia post-RAI per verificare una riduzione della captazione o la scomparsa delle aree ipercaptanti.
Indicazioni di successo terapeutico includono:
- scomparsa della tireotossicosi e dei sintomi associati, come palpitazioni, tremori e astenia;
- riduzione del volume del gozzo, con conseguente risoluzione dei sintomi compressivi.
Prospettive future

La gestione della terapia con radioiodio si sta sempre più orientando verso un approccio personalizzato, abbandonando l’uso di dosi standardizzate e empiriche per adottare metodi basati sulla dosimetria individuale. L’obiettivo principale di questa transizione è quello di massimizzare l’efficacia terapeutica, garantendo al contempo una riduzione significativa del rischio di sviluppare ipotiroidismo post-trattamento.
Un ruolo cruciale in questa evoluzione è svolto dai modelli predittivi basati sull’intelligenza artificiale (AI). Questi algoritmi, integrando dati clinici come il volume tiroideo, la captazione del radioiodio e la clearance renale, permettono di ottimizzare con precisione l’attività terapeutica, adattandola al profilo di ciascun paziente.
Un’innovazione tecnologica molto promettente è rappresentata dall’utilizzo della PET/CT con Iodio-124, un radiofarmaco già impiegato in ambito oncologico. Questa metodica consente una valutazione tridimensionale della distribuzione del radioiodio nella tiroide, con un calcolo della dose assorbita con un margine di errore inferiore al 5%, molto più preciso rispetto ai metodi tradizionali, che possono presentare errori del 20-30%. Tra gli studi clinici attivi, il trial THYROPET (NCT04489446) sta valutando proprio l’applicazione clinica di questa tecnologia nel campo della terapia nel tumore tiroideo.
Dal punto di vista biologico, un’ulteriore frontiera riguarda i biomarcatori genetici. Polimorfismi specifici, come quelli nei geni TSHR e DUOX2, sembrano influenzare la risposta alla terapia con RAI e possono identificare pazienti con un rischio più basso di sviluppare ipotiroidismo, aprendo la strada a trattamenti sempre più mirati.
Le prospettive terapeutiche future includono anche l’uso di combinazioni di terapie. Per esempio, l’associazione di RAI con anticorpi monoclonali come il teprotumumab si sta studiando per il trattamento dell’orbitopatia di Graves grave. Inoltre, l’impiego successivo di terapie adiuvanti potrebbe aiutare a prevenire l’insorgenza di ipotiroidismo dopo RAI.
Altre combinazioni innovative prevedono l’uso di molecole target, come inibitori di MEK o HDAC, che hanno il potenziale di aumentare l’espressione del NIS (simportatore di iodio), migliorando così la captazione del radioiodio e l’efficacia del trattamento. Infine, l’integrazione di RAI con tecniche ablative percutanee, quali radiofrequenza o laser, può rappresentare una strategia interessante per il trattamento selettivo di noduli tiroidei specifici.