L’ipertermia maligna rappresenta una delle più temibili emergenze in ambito anestesiologico, una vera e propria tempesta metabolica che si scatena in individui geneticamente predisposti in seguito all’esposizione a specifici agenti anestetici.
Questa condizione, sebbene rara con un’incidenza inferiore a 1 caso ogni 10.000 anestesie generali, mantiene un tasso di mortalità significativo intorno al 7% nonostante i progressi terapeutici, dimostrando quanto sia cruciale il tempestivo riconoscimento e trattamento.
Le radici genetiche del disordine
Caricamento….
Alla base dell’ipertermia maligna vi è un difetto genetico a carico del complesso sistema di regolazione del calcio nelle cellule muscolari scheletriche. La maggior parte dei casi è associata a mutazioni del gene RYR1, localizzato sul cromosoma 19, che codifica per i canali del calcio rianodinici del reticolo sarcoplasmatico. Queste mutazioni, trasmesse con modalità autosomica dominante, creano una sorta di “interruttore difettoso” che in condizioni normali può rimanere silente, ma che viene attivato in modo catastrofico dall’esposizione a determinati anestetici.
Oltre alle mutazioni del gene RYR1 (presenti nel 50-70% dei casi), recenti studi hanno identificato altre alterazioni genetiche coinvolte:
- mutazioni del gene CACNA1S che codifica per il canale del calcio di tipo L;
- alterazioni della calsequestrina-1 (CASQ1);
- varianti patologiche del gene STAC3.
Queste scoperte spiegano perché circa il 30% dei casi clinicamente confermati non presenti mutazioni RYR1 identificabili, suggerendo una maggiore complessità genetica del disturbo.
La cascata fisiopatologica
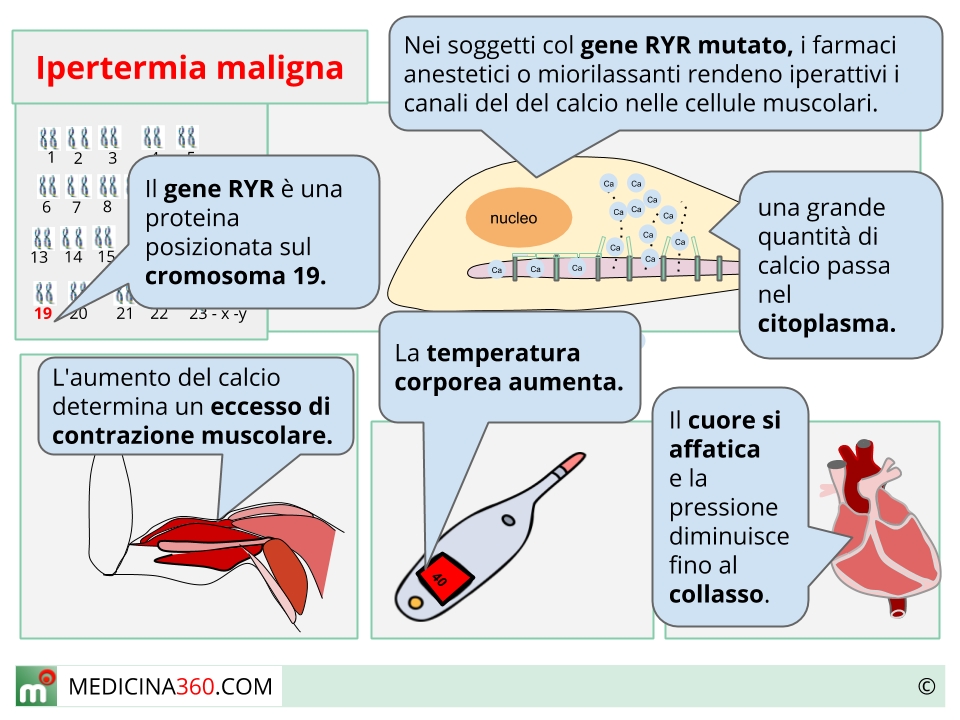
Quando un soggetto suscettibile viene esposto agli agenti scatenanti, tipicamente gli anestetici volatili alogenati e la succinilcolina, si innesca una reazione a catena devastante. I canali rianodinici difettosi si aprono in modo incontrollato, riversando enormi quantità di calcio nel citoplasma delle cellule muscolari. Questo eccesso di calcio attiva continuamente i meccanismi contrattili, trasformando il muscolo in una fornace metabolica che consuma ossigeno e nutrienti a ritmi insostenibili.
I farmaci potenzialmente scatenanti una crisi d’ipertermia maligna sono:
- gli alogenati;
- la succinilcolina;
- l’alotano;
- il decametonio.
Clinica
L’ipertermia maligna può insorgere immediatamente dopo l’esposizione agli agenti scatenanti oppure comparire nel periodo post-operatorio immediato, anche dopo che tali agenti sono stati sospesi.
Un fatto significativo è che i pazienti suscettibili all’ipertermia possono essere sottoposti numerose volte ad anestesie generali con l’utilizzo di farmaci scatenanti senza presentare conseguenze apparenti.
Tuttavia, un episodio di ipertermia maligna non è mai autolimitante: una volta innescata la crisi, questa progredisce inesorabilmente fino al decesso, a meno che non venga riconosciuta e trattata tempestivamente.
Inizialmente, l’anestesista può notare un aumento inspiegabile dell’anidride carbonica espirata (end-tidal CO2) nonostante una ventilazione adeguata, spesso accompagnato da tachicardia e instabilità pressoria. Un segno precoce particolarmente suggestivo è lo spasmo del massetere, che può rendere difficoltosa l’intubazione o la ventilazione del paziente.
Man mano che la crisi progredisce, compaiono rigidità muscolare generalizzata e un’imponente ipertermia, con temperature corporee che possono superare i 43°C. A livello biochimico, l’iperattività muscolare porta a grave acidosi mista (respiratoria e metabolica), iperkaliemia per massiccia fuoriuscita di potassio dalle cellule danneggiate, e rabdomiolisi con conseguente insufficienza renale acuta da mioglobinuria.
Trattamento
Il trattamento dell’ipertermia maligna è una corsa contro il tempo che richiede un approccio multidisciplinare. Il primo passo fondamentale è l’immediata sospensione di tutti gli agenti scatenanti e la rapida conclusione dell’intervento chirurgico.
Parallelamente, deve essere avviata la somministrazione di dantrolene sodico, un farmaco che agisce specificamente bloccando i recettori rianodinici difettosi, interrompendo così il circolo vizioso del rilascio incontrollato di calcio.
Il farmaco va somministrato per via endovenosa, dopo essere stato diluito e filtrato con aghi appositi, utilizzando acqua sterile per preparazioni iniettabili.
La dose iniziale raccomandata è di 2–2,5 mg/kg, sia per l’adulto che per il bambino, non appena viene diagnosticata l’ipertermia maligna.
La somministrazione deve essere ripetuta ogni 5 minuti fino a quando il paziente non raggiunge la stabilità respiratoria e cardiovascolare.
La gestione del paziente in crisi richiede anche un aggressivo controllo della temperatura corporea attraverso mezzi fisici (applicazione di ghiaccio, infusioni fredde) e farmacologici, il trattamento dell’acidosi con bicarbonato, e la correzione degli squilibri elettrolitici. Fondamentale è il supporto respiratorio con ossigenazione al 100% e iperventilazione per contrastare l’accumulo di CO2, nonché il mantenimento di una diuresi forzata per prevenire il danno renale da mioglobinuria.
Oltre al dantrolene, nuove strategie terapeutiche sono:
- ryanodina: in fase sperimentale per bloccare selettivamente i canali difettosi;
- carvedilolo: potenziale effetto stabilizzante sul reticolo sarcoplasmatico;
- terapie anti-infiammatorie mirate: per contrastare il danno da stress ossidativo.
Prevenzione
Data la gravità della sindrome, la prevenzione rappresenta l’arma più efficace contro l’ipertermia maligna. Durante la valutazione preoperatoria, l’anestesista deve indagare accuratamente la storia familiare del paziente, ricercando eventuali episodi di complicanze anestesiologiche inspiegate o morti sospette durante interventi chirurgici.
Per i pazienti a rischio accertato o sospetto, l’anestesia deve essere condotta evitando rigorosamente tutti gli agenti scatenanti, optando invece per protocolli alternativi basati su propofol, oppiacei e benzodiazepine. Particolare attenzione deve essere posta alla preparazione della sala operatoria, dove è necessario eseguire un accurato wash-out del circuito del ventilatore per eliminare ogni traccia di anestetici volatili.
Prospettive future
L’ipertermia maligna rimane una sfida significativa in anestesiologia, che mette alla prova la prontezza e la competenza dell’intero team operatorio. Mentre la ricerca genetica continua a identificare nuove mutazioni associate alla sindrome, lo sviluppo di test diagnostici più accurati e accessibili rappresenta una frontiera importante per la medicina personalizzata.
La disponibilità del dantrolene e la standardizzazione dei protocolli di trattamento hanno certamente migliorato la prognosi, ma la vera differenza resta la capacità di riconoscere precocemente i segnali d’allarme e di intervenire con decisione.
In questo senso, la formazione continua degli operatori e la diffusione di linee guida aggiornate rimangono strumenti indispensabili per ridurre ulteriormente la mortalità associata a questa temibile complicanza anestesiologica.
Frontiere promettenti:
- terapie geniche per correggere le mutazioni;
- nanotecnologie per rilascio mirato di dantrolene;
- intelligenza artificiale per predizione del rischio pre-operatorio.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.