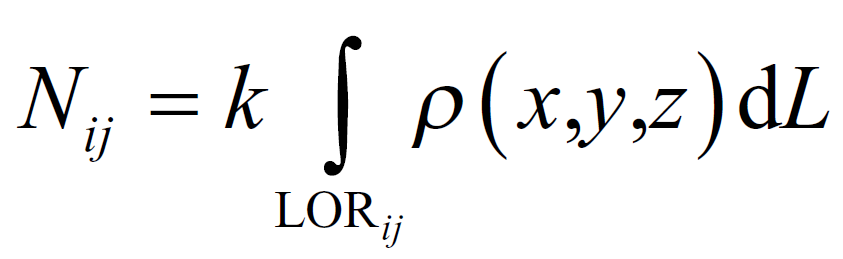La medicina nucleare è una specialità relativamente nuova e in rapida evoluzione, basata sull’utilizzo della radioattività a fini diagnostici e terapeutici. Dal punto di vista diagnostico, questo campo di imaging permette di valutare le funzioni fisiologiche degli organi, a differenza delle modalità morfologiche o strutturali della radiologia diagnostica, come i raggi X convenzionali e la tomografia computerizzata (TC).
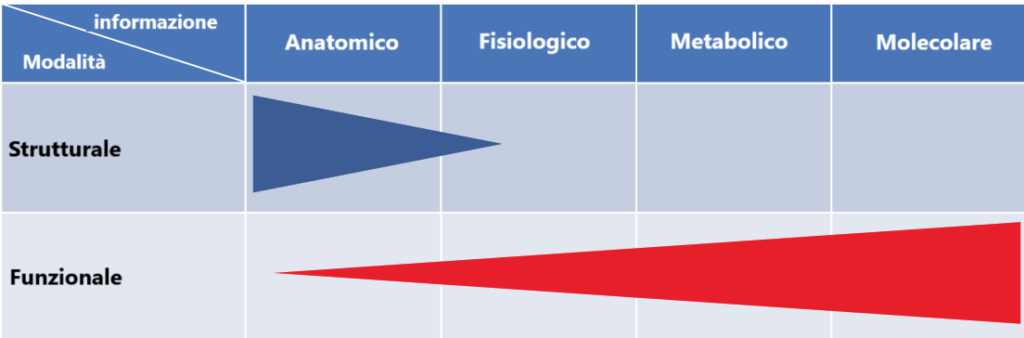
L’imaging in medicina nucleare è funzionale per natura, poiché rileva i cambiamenti fisiopatologici della malattia, valutando alterazioni fisiologiche, metaboliche e, più recentemente, molecolari. Tecniche come la tomografia a emissione di singolo fotone (SPECT) e la tomografia a emissione di positroni (PET) forniscono informazioni preziose che non possono essere ottenute con le modalità morfologiche.
Negli ultimi anni, la disciplina si è evoluta verso l’imaging molecolare e la terapia.
Dal punto di vista diagnostico, le metodiche di medicina nucleare completano, piuttosto che competere, con altre modalità di imaging radiologico (come TC, risonanza magnetica ed ecografia). Mentre le anomalie anatomiche sono meglio identificate attraverso tecniche ad alta risoluzione come TC e risonanza magnetica, gli esami di medicina nucleare sono particolarmente utili quando le informazioni ricercate sono di natura fisiologica e biochimica.
Vantaggi delle procedure di medicina nucleare:
- non invasive e a basso rischio: utilizzano radiofarmaci che non sono nefrotossici e non inducono reazioni allergiche;
- monitoraggio continuo nel tempo: consentono osservazioni prolungate, da pochi minuti a diverse ore, senza somministrare dosi eccessive di radiazioni;
- quantificazione dei dati: grazie all’integrazione con sistemi informatici, è possibile ottenere informazioni quantitative;
- diagnosi precoce: poiché i cambiamenti fisiologici spesso precedono quelli morfologici, queste tecniche permettono di identificare patologie in stadi iniziali.
Caricamento….
Contesto storico
Lo sviluppo dell’imaging in medicina nucleare affonda le sue radici nella scoperta dei raggi X da parte di Wilhelm Röntgen nel 1895, evento che segnò l’inizio delle scoperte nel campo delle radiazioni ionizzanti e aprì la strada alle moderne applicazioni mediche delle radiazioni.
Nel 1896, Henri Becquerel scoprì la radioattività, concetto fondamentale per l’imaging fisiologico, successivamente approfondito e definito da Antoine e Marie Curie. Queste scoperte gettarono le basi per lo sviluppo di diverse modalità diagnostiche.
Negli anni ’50 fu introdotta l’ecografia (US), seguita dalla tomografia computerizzata (TC) negli anni ’70 e dalla risonanza magnetica (MRI) negli anni ’80. L’uso della radioattività in medicina si è evoluto nel tempo, passando dall’impiego di semplici sonde di rilevazione a dispositivi più avanzati come gli scanner per imaging e le gamma camere.
La gamma camera, sviluppata negli anni ’50, ha subito un progressivo perfezionamento, acquisendo capacità tomografiche, rilevatori multipli e, infine, integrandosi con la TC in sistemi ibridi.
Una svolta significativa si è avuta con l’introduzione della tomografia a emissione di positroni (PET), che ha segnato la nascita dell’imaging molecolare. Questo approccio si è ulteriormente rafforzato grazie alla fusione tra tecniche morfologiche e funzionali.
Infine, le capacità funzionali dell’ecografia e l’imaging ottico basato sulle nanotecnologie hanno ampliato ulteriormente le potenzialità della tecnologia di imaging molecolare.
L’integrazione tra PET e TC (PET/TC) e, successivamente, tra PET e risonanza magnetica (PET/RM) ha rivoluzionato la diagnostica, permettendo una correlazione diretta tra alterazioni metaboliche e anatomia. Questi sistemi ibridi sono oggi fondamentali in oncologia, neurologia e cardiologia.
Basi scientifiche della medicina nucleare
Struttura stomica
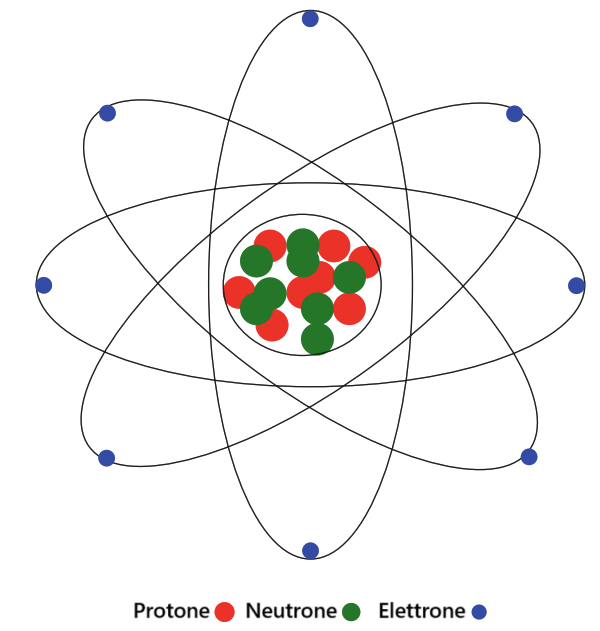
Ogni atomo è composto da un nucleo e da elettroni che orbitano attorno ad esso. Il nucleo, a sua volta, è formato da protoni (carica positiva) e neutroni (privi di carica), collettivamente chiamati nucleoni. La maggior parte della massa atomica è concentrata nel nucleo, mentre gli elettroni, dotati di carica negativa, vi orbitano intorno a causa dell’attrazione elettromagnetica esercitata dai protoni.
All’interno del nucleo, i protoni tenderebbero a respingersi reciprocamente a causa della loro carica positiva, ma la forza nucleare forte mantiene i nucleoni strettamente legati tra loro.
Isotopi
L’identità chimica di un elemento è determinata dal numero di protoni nel nucleo, che ne definisce anche la carica complessiva. I neutroni, essendo neutri, contribuiscono solo alla massa atomica e aiutano a ridurre la repulsione elettrostatica tra i protoni.
Tuttavia, variazioni nel numero di neutroni danno origine agli isotopi, ovvero atomi dello stesso elemento (stesso numero di protoni) ma con massa atomica diversa. Ad esempio, il piombo ha sempre 82 protoni, ma può presentare un diverso numero di neutroni a seconda dell’isotopo considerato.
Radioattività
Quando un nucleo contiene un eccesso di protoni o neutroni, diventa instabile a causa dell’insufficiente energia di legame. Per raggiungere una condizione di stabilità, emette particelle o energia in eccesso attraverso un processo chiamato decadimento radioattivo.
Esistono tre tipi principali di decadimento:
Caricamento….
- Decadimento alfa (α):
- emissione di una particella α (nucleo di elio: 2 protoni + 2 neutroni);
- eiduce il numero atomico di 2 e la massa atomica di 4 (es.: uranio-238 → torio-234);
- viene bloccato da pochi centimetri d’aria o un foglio di carta.
- decadimento beta (β):
- β−: un neutrone si trasforma in un protone ed un elettrone, aumentando il numero atomico di 1;
- β+ (emissione di positrone): un protone si trasforma in un neutrone e un positrone, diminuendo il numero atomico di 1;
- i raggi beta sono schermati da pochi millimetri di alluminio;
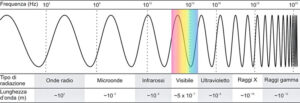
- decadimento gamma (γ):
- emissione di fotoni ad alta energia (raggi γ) da un nucleo eccitato, senza variazione del numero atomico o di massa;
- estremamente penetranti, richiedono diversi centimetri di piombo per essere schermati.
Quando un radionuclide viene legato a un composto chimico e somministrato a un paziente, il composto risultante è chiamato radiofarmaco. Questi agenti permettono di studiare processi fisiologici e metabolici attraverso tecniche di imaging come la PET e la SPECT.
Radiofarmaci
Uno dei traguardi più significativi della medicina nucleare è lo sviluppo dei radiofarmaci, composti costituiti da molecole biologiche legate a radionuclidi. Grazie all’emissione di radiazioni, questi farmaci possono essere tracciati all’interno dell’organismo, permettendo di studiarne la farmacocinetica e la biodistribuzione.
Le procedure diagnostiche in medicina nucleare si basano su quattro principali tipi di misurazioni fisiologiche:
- flusso sanguigno regionale, trasporto e localizzazione cellulare di molecole specifiche;
- metabolismo e bioenergetica dei tessuti;
- funzione fisiologica degli organi;
- comunicazione intracellulare e intercellulare.
L’uptake e la ritenzione dei radiofarmaci avvengono attraverso diversi meccanismi, tra cui:
- diffusione semplice;
- trasporto attivo;
- diffusione facilitata;
- fagocitosi;
- intrappolamento metabolico;
- proliferazione cellulare;
- sequestro e migrazione cellulare.
| Radiofarmaco | Utilizzo Clinico | Meccanismo d’azione |
|---|---|---|
| Tc-99m pertecnetato | Imaging tiroideo | Intrappolamento nella ghiandola tiroidea |
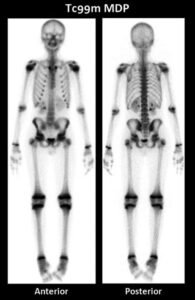
| Tc-99m MDP | Imaging osseo | Adsorbimento sui cristalli di idrossiapatite |
| Tc-99m IDA | Imaging epatobiliare | Assorbimento attivo da parte degli epatociti ed escrezione biliare |
| Tc-99m MAA | Perfusione polmonare | Ostruzione di capillari e arteriole |
| Tc-99m MAG-3 | Imaging renale dinamico | Escrezione tubulare |
| Gallio-67 citrato | Imaging di tumori e infezioni | Legame con globuline contenenti ferro |
| Tc-99m/In-111 leucociti marcati | Imaging di infezioni | Migrazione cellulare |
| Fluoro-18 FDG | Imaging tumorale | Trasporto attivo (analogo del glucosio) |
| Fluoro-18 NaF | Imaging osseo | Scambio ionico |
| Gallio-68 PSMA | Imaging del cancro alla prostata | Legame recettoriale |
| Gallio-68 NOC/TOC | Imaging di tumori neuroendocrini | Legame recettoriale |
Principi tecnici della medicina nucleare
Dopo la somministrazione di un radiofarmaco al paziente, questo si accumula nell’organo di interesse, emettendo raggi gamma in tutte le direzioni. Solo i fotoni diretti verso la gamma camera possono attraversare il collimatore e interagire con il cristallo di NaI(Tl), generando scintillazioni luminose.
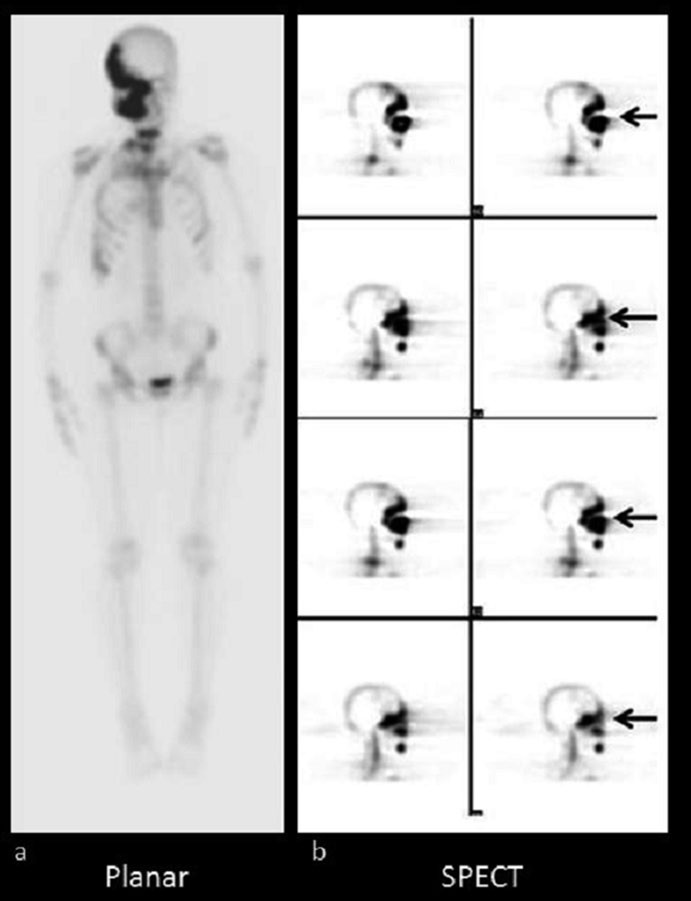
b) immagini tomografiche dello scheletro dello stesso paziente che mostrano le diverse fette dello scheletro fornendo maggiori dettagli dell’anomalia.
Ogni scintillazione viene convertita in un segnale elettrico e visualizzata sullo schermo di un oscilloscopio a raggi catodici (CRO), in una posizione corrispondente al punto di interazione nel cristallo. In questo modo si ottiene un’immagine planare, che rappresenta una proiezione bidimensionale della distribuzione del radiofarmaco nell’organo.
Tuttavia, le immagini planari presentano un limite fondamentale: la mancanza di informazioni sulla profondità, con possibili sovrapposizioni di strutture anatomiche che possono mascherare o ridurre la visibilità di alcune aree (analogamente a quanto avviene nelle radiografie tradizionali).
Per superare questa limitazione, si ricorre a tecniche tomografiche, in cui la gamma camera o un sistema PET acquisisce immagini da molteplici angolazioni attorno al paziente. Questi dati vengono poi elaborati digitalmente per ricostruire sezioni trasversali, ottenendo una rappresentazione tridimensionale nota come:
- SPECT (Single-Photon Emission Computed Tomography) per i radionuclidi a decadimento gamma;
- PET (Positron Emission Tomography) per quelli a emissione di positroni.
Le tecnologie più avanzate combinano PET/SPECT con TC o risonanza magnetica (RM), generando immagini ibride (PET/TC, SPECT/TC, PET/RM) che integrano:
- informazioni funzionali (dal radiofarmaco);
- dettagli anatomici ad alta risoluzione (dalla TC o RM).
Questo approccio consente una diagnosi più accurata rispetto all’uso isolato delle singole modalità, soprattutto in ambito oncologico, neurologico e cardiologico.
Vantaggi dell’Imaging ibrido
- migliore localizzazione delle lesioni, grazie alla correlazione diretta tra alterazioni metaboliche e strutture anatomiche;
- riduzione dei falsi positivi/negativi, con un impatto significativo sulla pianificazione terapeutica;
- ampliamento delle applicazioni cliniche, dalla stadiazione tumorale alla valutazione di malattie infiammatorie e neurodegenerative.
Ambiti di applicazione della Medicina Nucleare
Nonostante sia ancora spesso sottovalutata e poco utilizzata dalla comunità medica, la medicina nucleare continua a offrire progressi significativi nella diagnosi e nel trattamento di numerose patologie, oltre a fornire preziose informazioni sui complessi meccanismi fisiologici del corpo umano. Sebbene la maggior parte delle applicazioni sia di natura diagnostica, negli ultimi anni si è registrata una crescente espansione anche nel campo terapeutico.
Medicina Nucleare Diagnostica
Secondo i più recenti dati della Society of Nuclear Medicine and Molecular Imaging (SNMMI), ogni anno vengono eseguite oltre 40 milioni di procedure di medicina nucleare a livello globale. Il tecnezio-99m rimane il radioisotopo più utilizzato, impiegato in circa l’80% degli esami diagnostici:
- Stati Uniti: 20 milioni di procedure/anno (dati SNMMI 2023);
- Europa: 12 milioni di procedure/anno (dati EANM 2023);
- Asia-Pacifico: rapida crescita, con +15% annuo (dati IAEA 2023).
La medicina nucleare diagnostica si basa sull’uso di radiofarmaci emettitori gamma o beta meno (utilizzando la PET) somministrati per via endovenosa, inalatoria o orale. Questi traccianti, costituiti da isotopi a emivita breve legati a molecole biologicamente attive, si accumulano nell’organo bersaglio, permettendo di valutarne la funzionalità.
L’acquisizione delle immagini avviene tramite una gamma camera, che rileva i fotoni emessi da diverse angolazioni. I dati vengono elaborati da un computer e visualizzati su un monitor, consentendo al medico di identificare eventuali alterazioni patologiche. Stessa cosa avviene con la PET che rappresenta oggi il fiore all’occhiello della medicina nucleare moderna, offrendo una visione unica dei processi metabolici a livello molecolare.
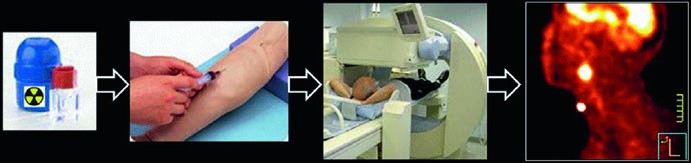
L’avvento dei sistemi ibridi PET/CT e PET/MRI ha ampliato le possibilità diagnostiche, consentendo una precisa correlazione tra alterazioni metaboliche e anatomia e la quantificazione dei parametri funzionali (es. SUV nella PET).
I moderni protocolli prevedono:
- imaging total-body: nuovi scanner PET a campo esteso;
- radiofarmaci innovativi: PSMA, FAPI, DOTATOC;
- Intelligenza Artificiale: per l’ottimizzazione delle immagini.
L’interpretazione ottimale degli esami richiede la collaborazione di un team specializzato mediante approccio multidisciplinare, comprendente:
- medici nucleari;
- tecnici;
- radiofarmacisti;
- fisici sanitari.
Il processo diagnostico si completa con l’analisi della storia clinica, degli esami di laboratorio, delle precedenti indagini radiologiche/nucleari e, quando necessario, con un esame obiettivo del paziente.
Terapia in Medicina Nucleare
La medicina nucleare terapeutica rappresenta un campo in rapida espansione, offrendo opzioni di trattamento per diverse patologie con un approccio mirato e minimamente invasivo. Le principali applicazioni includono:
- ipertiroidismo e tumori tiroidei: lo iodio-131 (¹³¹I) rimane il gold standard per il trattamento del carcinoma tiroideo e di alcune patologie benigne della tiroide;
- palliazione del dolore osseo: nei pazienti con metastasi scheletriche, i radiofarmaci come il ¹⁵³Sm-EDTMP (Samario) o il ¹⁸⁶Re-HEDP (Renio) riducono significativamente il dolore;
- tumori neuroendocrini e della prostata: l’uso di peptidi marcati con ¹⁷⁷Lu-DOTATATE (terapia PRRT) e il ¹⁷⁷Lu-PSMA ha rivoluzionato il trattamento di queste neoplasie, mostrando tassi di risposta elevati;
- linfomi e malattie ematologiche: l’¹⁹⁰Y-ibritumomab tiuxetan (radioimmunoterapia) è utilizzato in alcuni linfomi non-Hodgkin.
Terapia interna con radionuclidi (teranostica) li classifichiamo in:
- beta-emettitori (es. ¹³¹I, ¹⁷⁷Lu): utilizzati per la loro capacità di penetrazione tissutale (2-10 mm);
- alfa-emettitori (es. ²²⁵Ac-PSMA): ideali per lesioni molto piccole grazie all’elevato trasferimento di energia (LET).
L’accoppiamento di diagnostica (PET/CT con ⁶⁸Ga) e terapia (¹⁷⁷Lu/²²⁵Ac) permette trattamenti personalizzati. Per questo motivo oggi si parla di teranostica.
Tecniche avanzate di dosimetria interna migliorano l’efficacia e riducono gli effetti collaterali.
Vantaggi e sicurezza:
- minimi effetti collaterali: i radiofarmaci agiscono selettivamente sul tessuto target;
- singola somministrazione: spesso sufficiente, con possibilità di cicli aggiuntivi se necessario;
- monitoraggio integrato: sfruttando il decadimento gamma può essere effettuata una scintigrafia post somministrazione, oppure può essere effettuata una PET/CT post-terapia per valutare precocemente la risposta.
Fonte: A Concise Guide to Nuclear Medicine (Abdelhamid H. Elgazzar e Saud Alenezi)