I lipidi costituiscono una classe vasta ed eterogenea di molecole biologiche, accomunate da una proprietà fisica fondamentale: la loro insolubilità in acqua. Questa caratteristica idrofobica, che ne determina il comportamento in ambiente acquoso, è alla base delle loro molteplici e indispensabili funzioni all’interno degli organismi viventi. Comprendere la loro struttura chimica e la loro classificazione è un prerequisito essenziale per poter analizzare i complessi e finemente regolati percorsi metabolici in cui sono coinvolti, dal loro ruolo come riserva energetica a quello di componenti strutturali e molecole di segnale.
Le funzioni dei lipidi possono essere raggruppate in tre categorie principali, che evidenziano la loro versatilità e centralità nella fisiologia cellulare e dell’intero organismo:

- elementi strutturali: i lipidi sono i mattoni fondamentali delle architetture biologiche. I fosfolipidi e il colesterolo sono i principali costituenti delle membrane cellulari, dove creano una barriera selettiva. Nei tessuti nervosi, un ruolo cruciale è svolto dagli sfingolipidi (legati a zuccheri, proteine, fosfati). Inoltre, il tessuto adiposo bruno, formato da trigliceridi, funge non solo da riserva ma anche da isolante termico e da cuscinetto meccanico per la protezione degli organi;
- elementi funzionali: nonostante siano presenti in quantità minori, queste molecole svolgono ruoli regolatori di primaria importanza. Sono i precursori per la biosintesi di ormoni steroidei, come quelli prodotti nelle ghiandole surrenali. Nel fegato, il colesterolo è il punto di partenza per la sintesi degli acidi biliari, essenziali per la digestione, e per la produzione di vitamina D3;
- riserva energetica: i lipidi rappresentano la forma più efficiente di stoccaggio energetico. Il tessuto adiposo bianco è specializzato nell’accumulo di enormi quantità di trigliceridi. Questa riserva può essere mobilizzata in caso di necessità per fornire energia ai tessuti, garantendo una fonte di carburante molto più concentrata rispetto ai carboidrati.
Classificazione e struttura dei lipidi
La diversità funzionale dei lipidi si riflette nella loro varietà strutturale. Una prima, ampia distinzione può essere fatta come segue:
Now loading…
- lipidi semplici e complessi:
- i lipidi semplici sono molecole che non contengono legami esterei o amidici; esempi chiave sono gli acidi grassi e il colesterolo;
- i lipidi complessi, invece, sono derivati di acidi grassi che presentano tali legami, come nel caso dei trigliceridi;
- acidi grassi: rappresentano le unità costitutive di molti lipidi complessi. Sono acidi carbossilici dotati di una lunga catena idrocarburica. La loro classificazione si basa su:
- lunghezza della catena: si distinguono in acidi grassi a catena media (6-12 atomi di C), lunga (13-21 atomi) e molto lunga (≥22 atomi);
- presenza di doppi legami: gli acidi grassi saturi non presentano doppi legami, mentre quelli insaturi ne contengono uno o più. Queste caratteristiche influenzano profondamente le loro proprietà fisiche. Catene più lunghe e un numero limitato di doppi legami riducono la solubilità in acqua. Al contrario, la presenza di doppi legami e catene più corte aumenta la fluidità, abbassandone la temperatura di cristallizzazione;
- triacilgliceroli (trigliceridi): sono la forma più comune di lipidi di riserva. La loro struttura consiste in una molecola di glicerolo a cui sono legati, tramite legame estere, tre acidi grassi. Questa struttura permette loro di essere immagazzinati in forma quasi anidra negli adipociti, massimizzando la densità energetica.

Compresa la natura chimica dei lipidi, la sfida metabolica successiva diventa di natura fisica e biochimica: come può l’organismo smantellare, assorbire e trasportare queste molecole intrinsecamente idrofobiche all’interno di un ambiente acquoso?
Processo digestivo e assorbimento dei lipidi alimentari
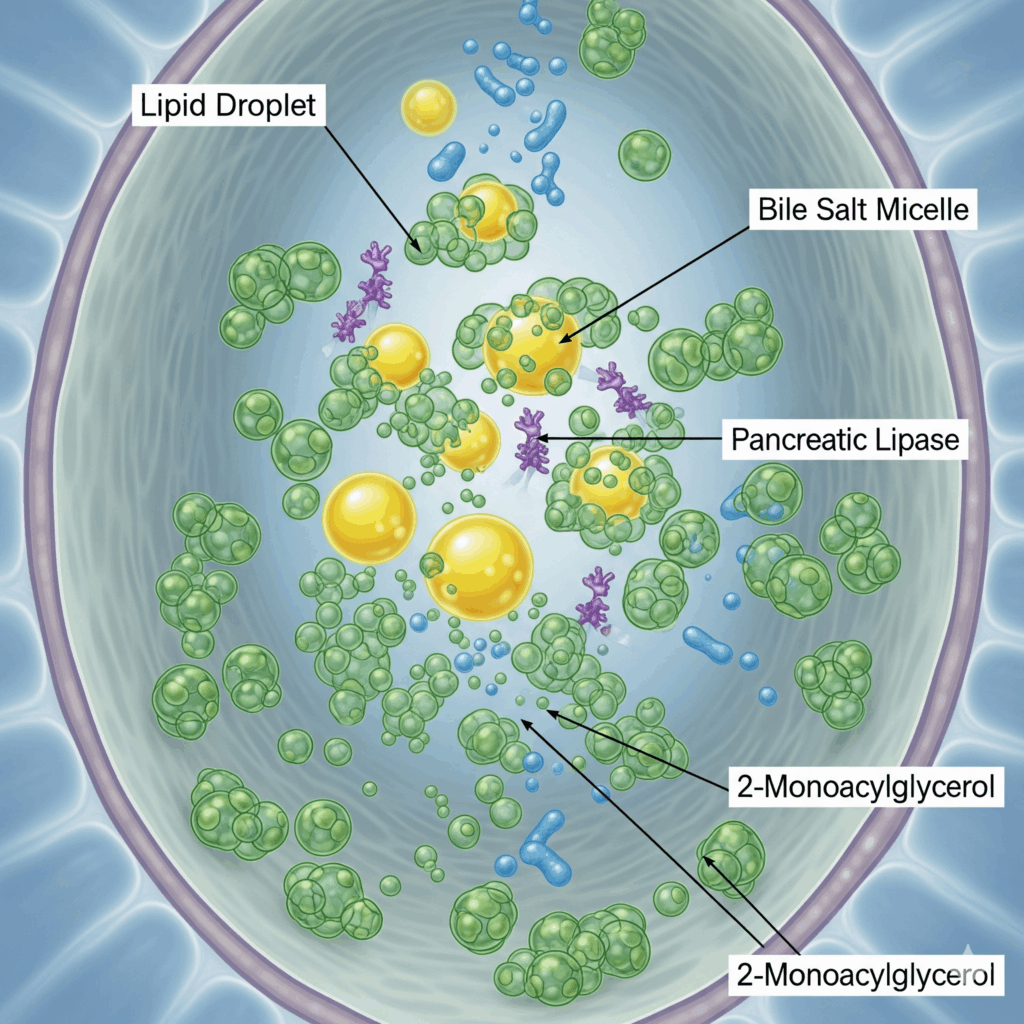
La digestione dei lipidi presenta una sfida fisiologica unica. Data la loro natura idrofobica, essi tendono ad aggregarsi in un ambiente acquoso come quello del tratto gastrointestinale, rendendo difficile l’accesso agli enzimi digestivi. Per superare questa barriera, l’organismo ha evoluto un sistema specializzato che, attraverso emulsione e idrolisi enzimatica, trasforma i grassi complessi in molecole assorbibili.
Il processo digestivo inizia a livello della bocca e dello stomaco con le lipasi linguali e gastriche, ma è nell’intestino tenue che avviene la fase cruciale. Qui intervengono i sali biliari, secreti dal fegato, che agiscono come detergenti biologici emulsionando le grandi gocce di grasso in micelle molto più piccole. Questo aumenta drasticamente la superficie di contatto per gli enzimi. La funzione dei sali biliari è anche quella di neutralizzare l’acidità gastrica, creando un ambiente con pH ottimale (intorno a 7) per l’attività degli enzimi intestinali.
Contemporaneamente, il pancreas secerne la prolipasi, attivata a lipasi dai sali biliari e dalla colipasi. La lipasi pancreatica possiede una specificità posizionale, idrolizzando i legami esterei nelle posizioni 1 e 3 del glicerolo. Questo lascia intatto il legame in posizione 2, generando come prodotti finali due acidi grassi liberi e un 2-monoacilglicerolo.
I prodotti della digestione (acidi grassi e 2-monogliceridi) vengono assorbiti per diffusione semplice dagli enterociti, principalmente nel digiuno. All’interno di queste cellule, avviene un processo inverso: la ri-sintesi dei trigliceridi. Questi lipidi neoformati, insolubili, vengono “imballati”, insieme a colesterolo, fosfolipidi e la proteina Apo B48, in complessi lipoproteici chiamati chilomicroni. Al termine di questo processo, gran parte dei sali biliari viene riassorbita e ritorna al fegato attraverso il circolo entero-epatico, un efficiente meccanismo di riciclo.
I chilomicroni vengono secreti nel sistema linfatico e da qui riversati nel flusso sanguigno, bypassando inizialmente il fegato. Il loro destino primario non è il fegato, ma i tessuti periferici come il tessuto adiposo e il muscolo scheletrico e cardiaco. Sulla superficie dei capillari di questi tessuti, l’enzima lipoproteina lipasi (LPL) idrolizza i trigliceridi contenuti nei chilomicroni, rilasciando acidi grassi che vengono captati dalle cellule per essere utilizzati come fonte energetica o risintetizzati a trigliceridi di riserva.
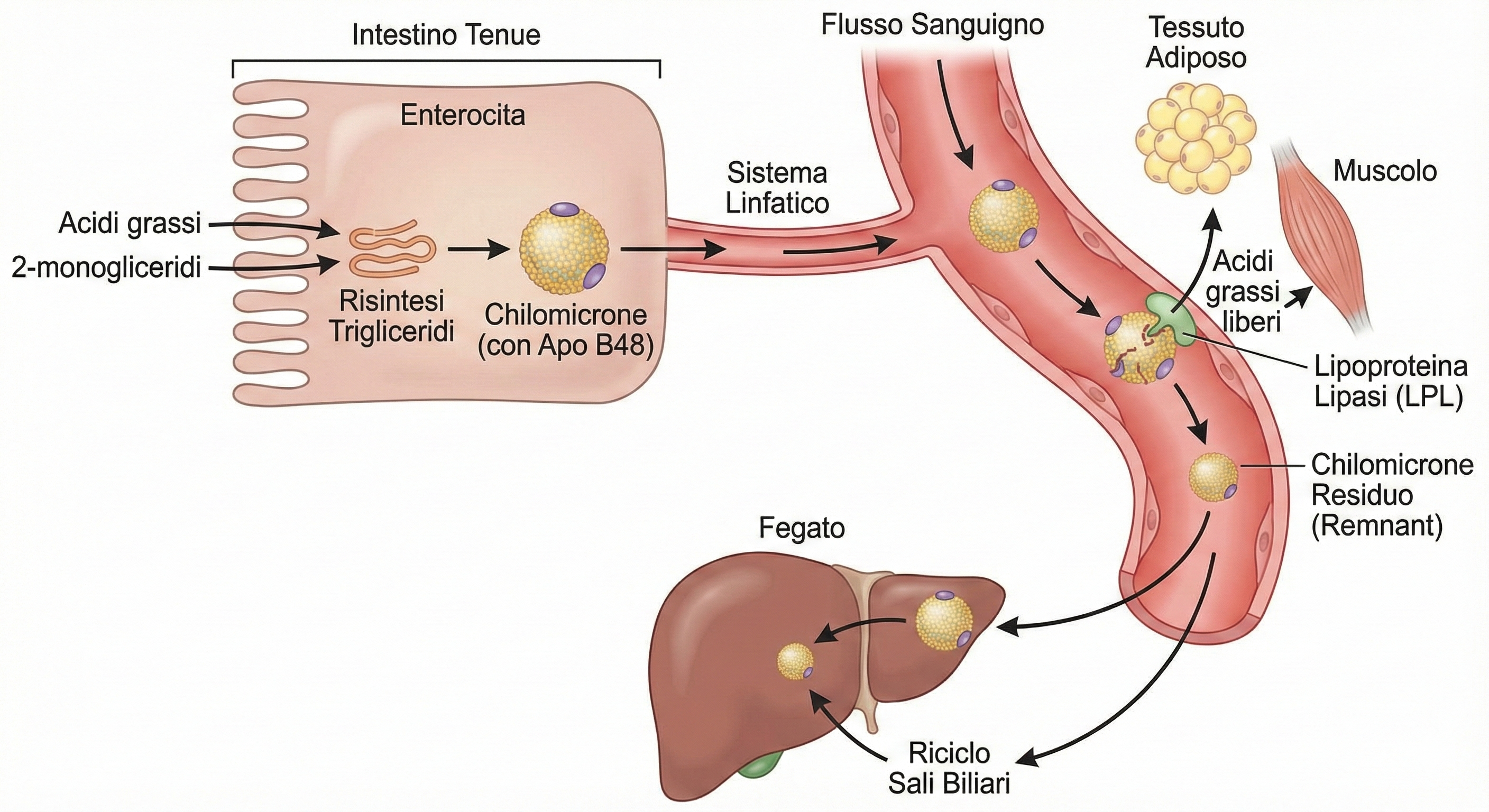
I chilomicroni residui (remnants), ormai impoveriti della maggior parte dei trigliceridi ma ancora ricchi di colesterolo, proseguono nel circolo sanguigno e vengono infine captati e metabolizzati dal fegato. L’organismo dispone inoltre di una riserva endogena di trigliceridi negli adipociti, mobilizzata da ormoni come glucagone e adrenalina durante il digiuno o l’esercizio fisico.
Una volta che gli acidi grassi raggiungono le cellule bersaglio, l’organismo avvia il processo catabolico per estrarne l’elevato potenziale energetico.
Catabolismo degli acidi grassi: la β-ossidazione mitocondriale
La β-ossidazione rappresenta il principale processo catabolico per l’estrazione di energia dagli acidi grassi, di importanza strategica soprattutto in condizioni di scarsità di carboidrati come il digiuno. Questo percorso, che avviene prevalentemente a livello epatico, è noto per la sua eccezionale resa energetica, superiore a quella del glucosio, poiché i grassi sono molecole chimicamente più ridotte e conservate in forma anidra.
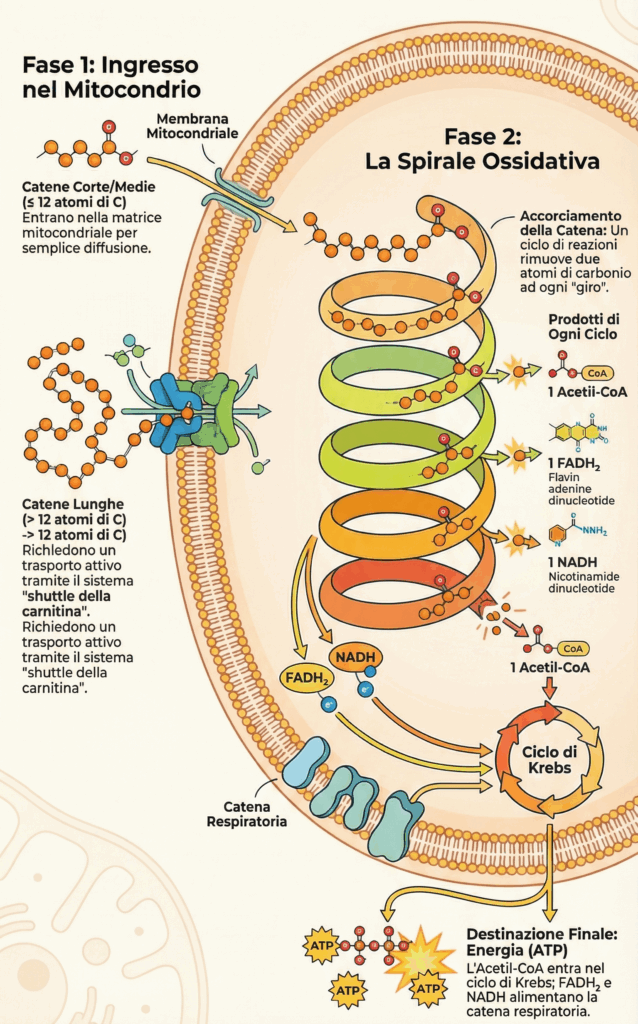
La β-ossidazione si svolge nella matrice mitocondriale. L’ingresso degli acidi grassi è differenziato in base alla lunghezza della catena:
- acidi grassi con catene non più lunghe di 12 atomi di carbonio entrano per diffusione;
- acidi grassi a catena lunga richiedono un trasporto attivo. Vengono prima attivati ad acil-CoA nel citosol e poi coniugati alla carnitina tramite l’enzima carnitina aciltransferasi I (CAT I). L’acil-carnitina attraversa la membrana mitocondriale, dove l’acido grasso viene rilasciato nuovamente come acil-CoA. Questa separazione fisica e il meccanismo di trasporto specializzato non sono casuali; rappresentano un punto di controllo critico per la regolazione del flusso metabolico.
Nella matrice, l’acil-CoA entra in una sequenza ciclica di reazioni. Ad ogni ciclo della “spirale” ossidativa, la catena viene accorciata di due atomi di carbonio, rilasciati come acetil-CoA. Ogni ciclo produce anche coenzimi ridotti: una molecola di FADH₂ e una di NADH, che cederanno i loro elettroni alla catena respiratoria per la sintesi di ATP. L’acetil-CoA, a sua volta, entra nel ciclo dell’acido citrico per essere completamente ossidato.
La β-ossidazione è soggetta a una rigida regolazione per integrarsi con i percorsi anabolici. I due punti di controllo chiave sono:
- inibizione da malonil-CoA: la CAT I è potentemente inibita dal malonil-CoA, il primo intermedio della biosintesi degli acidi grassi. Questa regolazione reciproca è un capolavoro di efficienza metabolica che previene l’instaurarsi di un ciclo futile, ovvero uno scenario dispendioso in cui la cellula spenderebbe energia per sintetizzare acidi grassi nel citoplasma e contemporaneamente li degraderebbe nel mitocondrio;
- inibizione da rapporto [NADH]/[NAD+]: la β-idrossiacil-CoA deidrogenasi è inibita da un elevato rapporto [NADH]/[NAD+]. Questo rapporto segnala che la cellula è già in uno stato di elevata carica energetica, rallentando di conseguenza il processo ossidativo.
Quando la cellula si trova in uno stato di abbondanza energetica, i percorsi metabolici si invertono, orientandosi verso l’anabolismo.
Anabolismo lipidico: sintesi di acidi grassi e colesterolo
In condizioni di surplus energetico, tipiche dello stato post-prandiale, l’eccesso di precursori metabolici viene deviato dalla produzione di ATP verso percorsi anabolici. L’acetil-CoA, in particolare, diventa il substrato per la sintesi di molecole di riserva (acidi grassi) e strutturali (colesterolo).
Dopo un pasto, zuccheri e amminoacidi vengono convertiti in acetil-CoA mitocondriale. Quando l’ATP è abbondante, questo acetil-CoA viene indirizzato alla sintesi lipidica. Qui, l’acetil-CoA cambia ruolo: da prodotto finale del catabolismo energetico a mattone fondamentale per l’anabolismo di riserva, una conversione dettata esclusivamente dallo stato di abbondanza energetica della cellula.
Il processo avviene nel citoplasma delle cellule epatiche e del tessuto adiposo e richiede il trasporto dell’acetil-CoA dal mitocondrio.
La reazione irreversibile che regola l’intero percorso è la carbossilazione dell’acetil-CoA a malonil-CoA, catalizzata dall’acetil-CoA carbossilasi (con cofattore biotina). Questa è una reazione chiave nella regolazione dell’intero metabolismo degli acidi grassi.
La catena dell’acido grasso si allunga tramite l’aggiunta progressiva di unità di malonil-CoA, catalizzata dal complesso acido grasso sintasi e utilizzando NADPH come agente riducente.
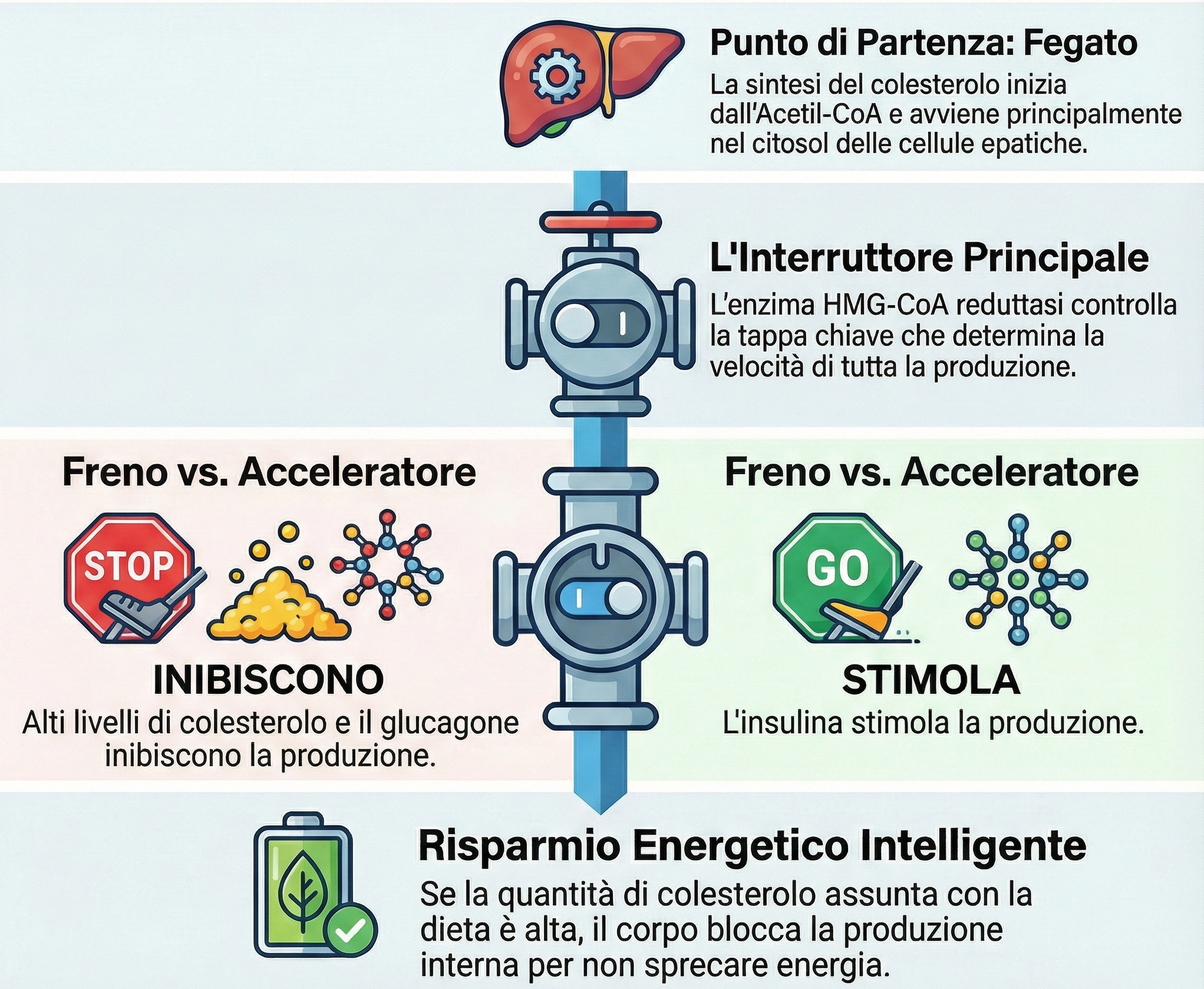
La sintesi del colesterolo avviene in tutte le cellule, ma principalmente nel citosol delle cellule epatiche, a partire dall’acetil-CoA.
Il percorso inizia con la conversione dell’acetil-CoA in mevalonato. La terza tappa, la riduzione di HMG-CoA a mevalonato da parte dell’HMG-CoA reduttasi, è la tappa obbligata e a velocità limitante (rate-limiting step) dell’intera via biosintetica. Il controllo del flusso metabolico attraverso l’intera sequenza è esercitato quasi esclusivamente a questo snodo.
L’attività della HMG-CoA reduttasi è finemente controllata. È inibita da alte concentrazioni di colesterolo intracellulare e dal glucagone, mentre è stimolata dall’insulina. Questo meccanismo di feedback negativo è essenziale per l’omeostasi del colesterolo. In presenza di un elevato apporto dietetico, la cellula reprime la propria sintesi de novo, un processo energeticamente molto dispendioso, conservando preziose risorse di ATP e NADPH.
Essendo insolubile, il colesterolo viene trasportato nel sangue tramite lipoproteine.
In condizioni di digiuno, l’enorme flusso di acetil-CoA dal catabolismo lipidico può superare la capacità del ciclo di Krebs, attivando una via alternativa: la sintesi dei corpi chetonici.
Formazione e utilizzo dei corpi chetonici
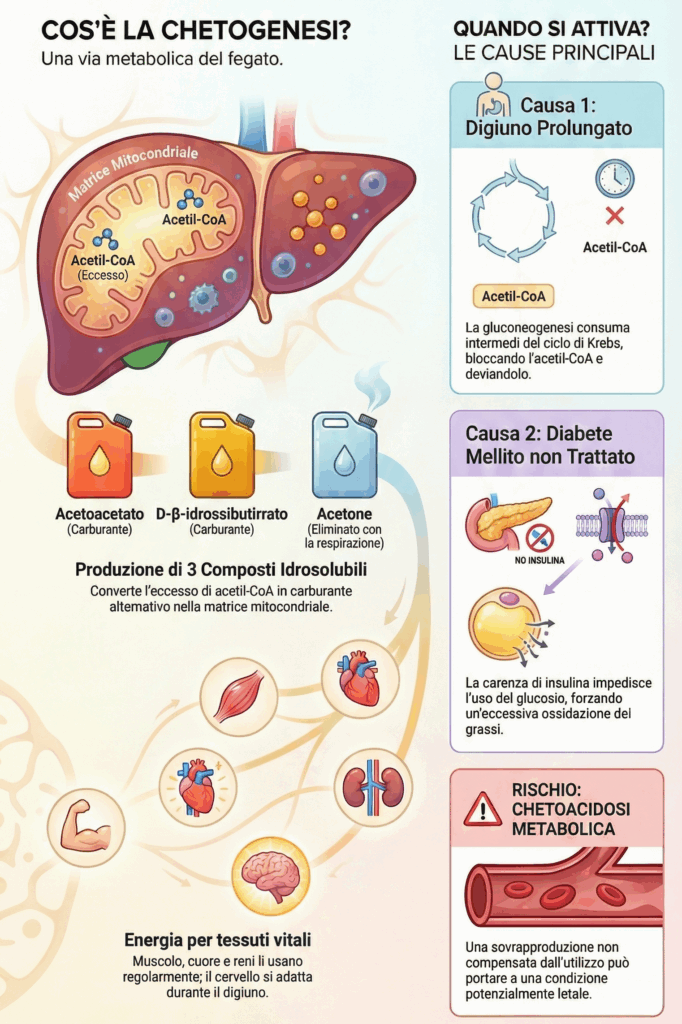
La sintesi dei corpi chetonici è una risposta del fegato a un eccesso di acetil-CoA, tipicamente derivante da un’intensa β-ossidazione. Questo percorso non è un semplice “sfogo” metabolico, ma produce un carburante alternativo cruciale per i tessuti extra-epatici.
La sintesi avviene nella matrice mitocondriale delle cellule epatiche. L’acetil-CoA in eccesso viene convertito in tre corpi chetonici: acetone, acetoacetato e D-β-idrossibutirrato. A differenza dei lipidi, questi sono solubili in acqua, il che ne facilita il trasporto nel sangue senza bisogno di lipoproteine.
Acetoacetato e D-β-idrossibutirrato vengono esportati dal fegato e usati come fonte di energia da tessuti come il muscolo scheletrico, il cuore e la corteccia renale. Il loro ruolo è critico per il cervello, che può adattarsi a usarli durante il digiuno prolungato, quando il glucosio scarseggia.
Due condizioni principali portano a una sovrapproduzione di corpi chetonici:
- digiuno prolungato: la gluconeogenesi massiva sottrae intermedi al ciclo di Krebs. L’ossalacetato può essere visto come il partner d’ingresso dell’acetil-CoA nel ciclo. Quando la gluconeogenesi lo “sottrae” per sintetizzare glucosio, l’acetil-CoA si ritrova senza il suo partner, bloccando l’ingresso nel ciclo. L’accumulo che ne consegue forza il fegato a deviare l’eccesso di acetil-CoA verso l’unica via d’uscita disponibile: la chetogenesi;
- diabete mellito non trattato: la carenza di insulina impedisce l’utilizzo del glucosio, forzando le cellule a dipendere dalla β-ossidazione. L’eccesso di acetil-CoA che ne deriva viene convertito in corpi chetonici.
Quando la produzione supera la capacità di utilizzo, si può instaurare una chetoacidosi metabolica, condizione potenzialmente letale dovuta all’abbassamento del pH ematico.
I percorsi metabolici dei lipidi quindi non sono isolati, ma profondamente interconnessi tra loro e con il metabolismo di carboidrati e amminoacidi. La comprensione di questa rete complessa è fondamentale per apprezzare la flessibilità del metabolismo energetico umano.