La sepsi non è solo una complicanza infettiva: è una vera emergenza medica, potenzialmente letale. Riconoscerla precocemente può salvare una vita. Ma cosa sappiamo davvero di questa condizione?
La sepsi è una risposta disfunzionale dell’organismo a un’infezione, che può condurre rapidamente a danno d’organo, shock e morte se non trattata tempestivamente.
La definizione più aggiornata (Sepsis-3, 2016) la descrive come:
“una disfunzione d’organo potenzialmente letale causata da una risposta disregolata dell’ospite a un’infezione”.
Quando alla sepsi si associa una ipotensione persistente nonostante un’adeguata replezione volemica, si parla di shock settico.
Le cause
Ogni sepsi nasce da un focolaio infettivo che può essere localizzato in sedi diverse: polmoni, vie urinarie, addome, tessuti molli o dispositivi medici impiantati. In questo contesto, il microrganismo, che può essere un batterio Gram‑positivo o negativo, un fungo o un virus, penetra inizialmente a livello locale. Qui, la risposta infiammatoria tenta di contenere il patogeno, ma quando sfugge al controllo e si diffonde nel circolo sanguigno, scatena una infiammazione sistemica.
Il passaggio da infezione localizzata a sepsi è facilitato da una vera e propria “tempesta di citochine“: una produzione massiva e incontrollata di mediatori infiammatori come TNF‑α, IL‑1 e IL‑6. Queste molecole attivano macrofagi e neutrofili, causano danno endoteliale, aumentano la permeabilità vascolare e favoriscono tra l’altro l’espressione della via coagulativa.
Alcuni patogeni (es. endotossine dei Gram‑negativi, peptidoglicani dei Gram‑positivi, superantigeni) sono particolarmente potenti nel richiamare questa reazione sistemica.
Nella sepsi, l’infiammazione induce un forte squilibrio nella coagulazione: l’endotelio danneggiato esprime fattore tissutale, favorendo la formazione di microtrombi nei capillari. Si crea quindi una forma di coagulazione intravascolare disseminata (DIC), con consumo di piastrine e fattori della coagulazione. Questo processo compromette la perfusione tissutale e contribuisce all’insufficienza multiorgano.
Inizialmente domina la fase proinfiammatoria, poi, in un secondo tempo, il sistema immunitario può risultare esaurito. Dopo la tempesta citochinica, l’organismo entra in una fase di immunosoppressione: si ha apoptosi dei linfociti (CD4+, CD8+), ridotta produzione di citochine e compromissione delle difese contro altri agenti infettivi. Questo squilibrio bifasico, in cui si alternano iperinfiammazione e deficit difensivo, aumenta il rischio di complicanze e mortalità.
Il danno agli organi deriva da più meccanismi connessi:
- ipossia ipossica – l’alterazione microcircolatoria, unita alla vasodilatazione, riduce l’apporto di ossigeno;
- danno mitocondriale – i mediatori infiammatori interferiscono con il metabolismo energetico cellulare;
- edema tessutale – la perdita del controllo sui vasi causa fuoriuscita di liquidi e gonfiore interstiziale.
Tali alterazioni portano a insufficienza renale, respiratoria, cardiaca, neurologica e coagulativa, con manifestazioni come IRA, ARDS, miocardiopatia settica, alterazioni neurologiche e DIC .
La probabilità che un’infezione evolva in sepsi dipende da variabili legate al paziente e all’ambiente:
- età avanzata o molto giovane, con sistema immunitario meno efficiente;
- patologie croniche (diabete, cirrosi, IRC, cancro) che alterano le difese;
- immunodepressione (chemioterapia, corticosteroidi, HIV, trapianti);
- procedure invasive (cateteri, ventilazione, protesi) e ricoveri in TI;
- uso eccessivo o inappropriato di antibiotici, che favorisce resistenza e diffusione di patogeni acquisiti in ambito ospedaliero.
I fattori predisponenti, in particolare l’età e le malattie croniche, provocano già un certo grado di disfunzione endoteliale (stress ossidativo, perdita di integrità, attività pro-coagulante). Questa condizione rende l’endotelio più suscettibile e reattivo alla risposta infiammatoria della sepsi, amplificando il danno vascolare e la formazione di microtrombi.
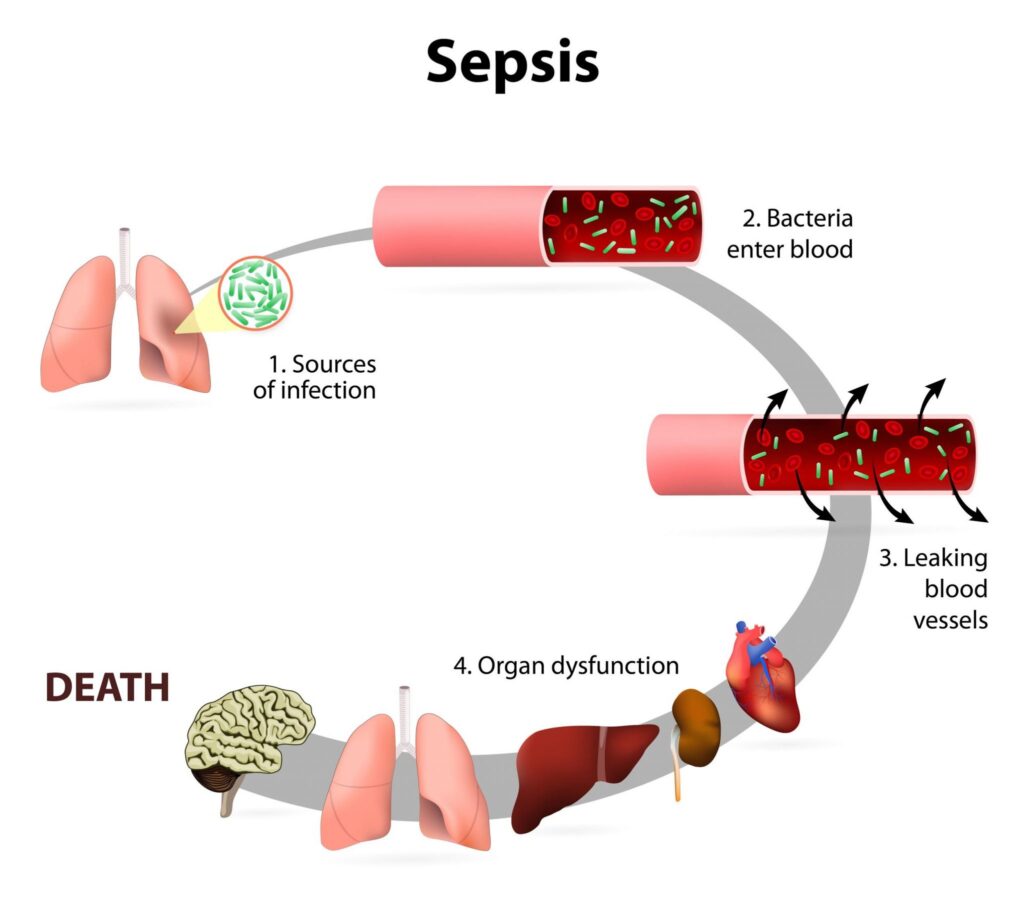
L’insieme di questi meccanismi patologici causa un effetto a cascata che coinvolge vari organi:
- Polmoni: edema alveolare e ARDS con insufficienza respiratoria;
- Reni: lesione tubulare acuta con oliguria fino a insufficienza renale acuta;
- Cuore: miocardiopatia settica con riduzione contrattilità e compromissione emodinamica;
- Fegato: disfunzione bilirubinica e insufficienza coagulativa;
- Sistema nervoso: encefalopatia settica con confusione, delirio, alterazioni del livello di coscienza.
Lo shock settico, portando ipotensione refrattaria a livelli con MAP <65 mmHg, è l’evento culminante, spesso irreversibile senza interventi urgenti.
Caricamento…
Come si riconosce? I segni chiave da non ignorare
La sepsi può svilupparsi rapidamente. Riconoscerla precocemente è fondamentale per migliorare le probabilità di sopravvivenza. I segni clinici possono variare, ma alcuni sono particolarmente indicativi e dovrebbero sempre suscitare sospetto.
Caricamento….
- Alterazioni della temperatura corporea
Un cambiamento significativo nella temperatura corporea è uno dei primi segnali di sepsi. La febbre elevata (oltre 38 °C) o la temperatura corporea insolitamente bassa (inferiore a 36 °C) possono indicare una risposta infiammatoria sistemica. È importante monitorare attentamente la temperatura, soprattutto in presenza di un’infezione accertata. - Frequenza cardiaca e respiratoria elevate
La tachicardia (frequenza cardiaca superiore a 90 battiti al minuto) e la tachipnea (respirazione superiore a 20 atti al minuto) sono risposte fisiologiche comuni alla sepsi. Questi segni riflettono lo stress sistemico e la necessità del corpo di compensare la diminuzione dell’ossigenazione tissutale. La presenza di questi sintomi, soprattutto se accompagnati da altri segni, richiede attenzione immediata. - Confusione e alterazione dello stato mentale
La sepsi può compromettere la funzione cerebrale, portando a confusione, disorientamento o difficoltà a rispondere. Questo è particolarmente evidente negli anziani e può essere uno dei primi segnali di deterioramento neurologico. - Alterazioni cutanee
La pelle può manifestare cambiamenti significativi durante la sepsi. La comparsa di pelle fredda, umida, pallida o con colorazione bluastra (cianosi) è indicativa di una perfusione tissutale compromessa. In alcuni casi, possono verificarsi eruzioni cutanee o petecchie, che non scompaiono alla pressione (test del vetro), suggerendo un coinvolgimento vascolare grave. - Riduzione della diuresi
Una diminuzione significativa della produzione di urina (oliguria) o l’assenza di minzione per 12 ore è un segno preoccupante. Indica una possibile insufficienza renale acuta, spesso conseguente a ipoperfusione renale durante la sepsi. La valutazione della diuresi è essenziale per monitorare la funzione renale in questi pazienti. - Dolore estremo o sensazione di malessere generale
I pazienti con sepsi spesso riferiscono un dolore intenso o una sensazione generale di malessere, descrivendo il loro stato come “il peggiore mai provato”. Questo può includere dolore addominale, toracico o muscolare. La presenza di dolore severo, soprattutto in assenza di una causa evidente, dovrebbe sollevare sospetti. - Segni di infezione primaria
La presenza di segni locali di infezione, come arrossamento, gonfiore, secrezione purulenta o dolore in un’area specifica del corpo, può essere il punto di partenza per lo sviluppo della sepsi. È fondamentale identificare e trattare prontamente la fonte dell’infezione per prevenire la progressione verso uno stato settico.
Caricamento…
Strategie per il riconoscimento precoce
Il riconoscimento tempestivo della sepsi è cruciale. Le linee guida suggeriscono l’uso di strumenti come il SOFA score (Sequential Organ Failure Assessment) o il qSOFA (quick SOFA). Tuttavia, è importante ricordare che nessuno strumento diagnostico sostituisce l’osservazione clinica attenta e la valutazione del paziente nel suo complesso.
Il SOFA score viene utilizzato principalmente in ambienti ospedalieri per monitorare la funzione d’organo e la gravità della sepsi. Valuta la funzione di sei sistemi d’organo: respiratorio, cardiovascolare, epatico, renale, neurologico e coagulativo. Ogni sistema riceve un punteggio da 0 a 4, con un punteggio totale che varia da 0 a 24. Un aumento di ≥2 punti rispetto al baseline è indicativo di un peggioramento clinico significativo.
| Sistema d’organo | Punteggio 0 | Punteggio 1 | Punteggio 2 | Punteggio 3 | Punteggio 4 |
|---|---|---|---|---|---|
| Neurologico | GCS = 15 | GCS = 13–14 | GCS = 10–12 | GCS = 6–9 | GCS < 6 |
| Cardiovascolare | MAP ≥70 mmHg | MAP <70 mmHg | Dopamina ≤5 µg/kg/min o dobutamina (qualsiasi dose) | Dopamina >5 µg/kg/min o norepinefrina ≤0.1 µg/kg/min o epinefrina ≤0.1 µg/kg/min | Dopamina >15 µg/kg/min o norepinefrina >0.1 µg/kg/min o epinefrina >0.1 µg/kg/min |
| Respiratorio | PaO₂/FiO₂ ≥400 | PaO₂/FiO₂ <400 | PaO₂/FiO₂ <300 | PaO₂/FiO₂ <200 | PaO₂/FiO₂ <100 |
| Coagulazione | Piastrine ≥150 × 10³/µL | Piastrine 100–149 × 10³/µL | Piastrine 50–99 × 10³/µL | Piastrine 20–49 × 10³/µL | Piastrine <20 × 10³/µL |
| Fegato | Bilirubina <1.2 mg/dL | Bilirubina 1.2–1.9 mg/dL | Bilirubina 2.0–5.9 mg/dL | Bilirubina 6.0–11.9 mg/dL | Bilirubina ≥12.0 mg/dL |
| Reni | Creatinina <1.2 mg/dL o diuresi >0.5 mL/kg/h | Creatinina 1.2–1.9 mg/dL o diuresi <0.5 mL/kg/h | Creatinina 2.0–3.4 mg/dL o diuresi <0.5 mL/kg/h | Creatinina 3.5–4.9 mg/dL o diuresi <0.5 mL/kg/h | Creatinina ≥5.0 mg/dL o anuria |
Il qSOFA è una versione semplificata del SOFA score, utilizzata per identificare rapidamente i pazienti a rischio di sepsi al di fuori delle unità di terapia intensiva, facilitando interventi tempestivi. Si basa su tre parametri clinici facilmente misurabili.
Tabella del qSOFA Score
| Parametro | Criterio positivo | Punteggio |
|---|---|---|
| Pressione arteriosa sistolica | ≤100 mmHg | 1 |
| Frequenza respiratoria | ≥22 atti/minuto | 1 |
| Stato mentale | GCS <15 | 1 |
Punteggio totale:
- 0: Basso rischio
- 1–2: Rischio intermedio
- 3: Alto rischio
Un punteggio ≥2 è associato a un rischio maggiore di mortalità o a un esito clinico sfavorevole in pazienti con infezione sospetta o confermata.
Esami diagnostici
Quando un paziente con sospetta sepsi arriva al Pronto Soccorso, è fondamentale avviare tempestivamente una serie di esami diagnostici per confermare la diagnosi, identificare la fonte dell’infezione e valutare la gravità del quadro clinico. Questi esami devono essere eseguiti senza ritardi, idealmente entro la prima ora, per ottimizzare le possibilità di un esito favorevole.
Caricamento….
- Emocolture (due prelievi separati)
Le emocolture sono essenziali per identificare l’agente patogeno responsabile dell’infezione, in genere prima di avviare la terapia antibiotica. È consigliabile prelevare almeno due campioni da siti differenti, come un accesso venoso periferico e un catetere centrale, per aumentare la probabilità di rilevare il microrganismo causale. Questa pratica è particolarmente importante poiché la presenza di batteri nel sangue si verifica solo nel 30% circa dei casi di sepsi. - Procalcitonina (PCT)
La procalcitonina è un biomarcatore che aiuta a distinguere le infezioni batteriche da quelle virali o da altre cause di infiammazione. Livelli elevati di PCT sono fortemente suggestivi di infezione batterica sistemica e possono guidare la terapia antibiotica. Oltre alla diagnosi, la PCT è utile nel monitoraggio della risposta al trattamento antibiotico. - Lattati sierici
Misurare i livelli di lattato nel sangue è cruciale per valutare la gravità della sepsi. Elevati livelli di lattato indicano una perfusione tissutale inadeguata e sono associati a un aumento del rischio di mortalità. La misurazione dei lattati è raccomandata nella prima ora dal sospetto di sepsi. - Emogasanalisi arteriosa (EGA)
L’EGA fornisce informazioni sullo stato acido-base, sull’ossigenazione e sulla ventilazione del paziente. Alterazioni nei parametri dell’EGA possono indicare insufficienza respiratoria, acidosi metabolica o respiratoria, e aiutano a monitorare la risposta al trattamento. - Emocromo con formula e piastrine
L’emocromo aiuta a valutare la risposta infiammatoria e la funzione ematologica. Leucocitosi o leucopenia, insieme a trombocitopenia, possono essere segni di sepsi. Questi parametri aiutano a monitorare l’evoluzione della sepsi e la risposta al trattamento. - Funzionalità renale e bilancio idrico
Valutare la funzione renale e l’equilibrio idrico è essenziale, poiché l’insufficienza renale acuta è una complicanza comune della sepsi. Esami come creatinina, urea ed elettroliti sierici (Na⁺, K⁺, Cl⁻) sono utili per monitorare la funzione renale e l’equilibrio idrico. - Funzionalità epatica
Esami come le transaminasi (ALT, AST) e la bilirubina totale e diretta aiutano a valutare la funzione epatica. Elevati livelli di bilirubina e transaminasi possono indicare danno epatico associato alla sepsi. - Proteina C reattiva (PCR)
La PCR è un altro biomarcatore che indica l’infiammazione sistemica. Livelli elevati di PCR sono indicativi di infiammazione, ma non sono specifici per l’infezione batterica. La PCR è utile nel monitoraggio della risposta al trattamento, ma la procalcitonina offre una maggiore specificità per le infezioni batteriche.
Come si tratta? La gestione nella pratica clinica
Nella gestione della sepsi e soprattutto dello shock settico, ogni minuto conta. Le linee guida della Surviving Sepsis Campaign 2021 sottolineano che si tratta di emergenze mediche che richiedono un intervento tempestivo, con trattamenti iniziati idealmente entro la prima ora dal riconoscimento clinico.

Una volta sospettata la sepsi, come già detto, si richiedono subito le emocoluture, dopo di ché, è imperativo somministrare una terapia antimicrobica ad ampio spettro entro un’ora, soprattutto in presenza di shock o elevata probabilità di sepsi. Questo approccio riduce drasticamente la mortalità: ogni ora di ritardo può aumentare il rischio di morte del 7–10 %. Se lo shock non è presente, la somministrazione può attendere fino a tre ore, purché gli esami diagnostici siano in corso .
Contestualmente alla terapia antibiotica, va iniziata una fluidoterapia vigorosa: almeno 30 mL/kg di soluzione cristalloide nei primi 3 ore, se il paziente è ipoperfuso o in shock. Le linee guida consigliano soluzioni bilanciate (es. Ringer o Plasma-Lyte) rispetto alla normale saline 0,9 %. L’obiettivo è ristabilire una pressione arteriosa media ≥65 mmHg, monitorando la risposta con parametri dinamici come il riflesso capillare o la variazione della pressione del polso .
Se nonostante la replezione volemica la pressione rimane bassa, il primo farmaco da scegliere è la norepinefrina, preferita rispetto a dopamina ed epinefrina. In caso di risposta insufficiente, si aggiunge vasopressina, e successivamente epinefrina se necessario. Le linee guida incoraggiano l’inizio precoce (anche periferico) per evitare ritardi nell’azione.
Oltre alla gestione emodinamica, la sepsi richiede misure per sostenere gli organi compromessi. In caso di insufficienza respiratoria si applicano protocolli per ARDS (volume corrente basso, plateau ≤ 30 cmH₂O). Nei pazienti con shock persistente, può essere indicata infusione di idrocortisone 200 mg/die . La nutrizione enterale precoce, la profilassi della trombosi venosa, e la protezione gastrica vengono avviate frequentemente a integrazione .
Un pilastro fondamentale è intervenire direttamente sulla fonte infettiva: drenaggio di ascessi, rimozione di dispositivi infetti, o chirurgia in caso di peritonite. Questo intervento può essere decisivo tanto quanto antibiotici e fluidi.
Il trattamento prosegue oltre l’ora iniziale con un attento monitoraggio della perfusione, della glicemia (mantenuta <10 mmol/L), dei parametri respiratori, dei lattati e dei segni di sovraccarico di liquidi. La titolazione di fluidi e vasopressori si basa su dati emodinamici (anche non invasivi) . Anche l’intensità del monitoraggio, inclusa la pressione invasiva, va decisa in base alla gravità del paziente e alle risorse disponibili .
Perché la sepsi è così pericolosa?
La sepsi è una delle principali cause di morte a livello mondiale. Ogni anno, si registrano circa 47–50 milioni di casi, con almeno 11 milioni di decessi, pari a circa il 20% di tutte le morti globali. La mortalità varia tra il 30% e il 60% nei casi di sepsi grave, e può raggiungere il 70% nei casi di shock settico. Inoltre, molti sopravvissuti presentano sequele fisiche, cognitive e psicologiche persistenti, note come sindrome post-sepsi, che possono compromettere la qualità della vita per mesi o anni.
Contrariamente a quanto si potrebbe pensare, la sepsi non è limitata ai Paesi a basso reddito. Negli ultimi dieci anni, l’incidenza della sepsi è aumentata nei Paesi ad alto reddito, con tassi annui compresi tra l’8% e il 13%. Questo aumento è attribuibile a diversi fattori, tra cui l’invecchiamento della popolazione, l’aumento delle malattie croniche e la diffusione di microrganismi resistenti agli antibiotici.
Difficoltà nel riconoscimento precoce
La sepsi è una patologia tempo-dipendente, e il riconoscimento precoce è cruciale per migliorare la prognosi. Tuttavia, la diagnosi può essere difficile, poiché i sintomi iniziali possono essere aspecifici e sovrapporsi a quelli di altre condizioni. Inoltre, la sepsi può evolvere rapidamente, e ogni ora di ritardo nel trattamento aumenta significativamente il rischio di morte.
Impatto economico e pressione sui sistemi sanitari
La sepsi rappresenta un onere significativo per i sistemi sanitari. I costi associati al trattamento della sepsi, compresi i ricoveri in terapia intensiva, le trasfusioni di sangue e la gestione delle complicanze, sono elevati. Inoltre, la sepsi contribuisce a un aumento dei giorni di degenza ospedaliera e a una maggiore incidenza di disabilità a lungo termine, con conseguenti costi sociali ed economici.
Fonti:
- Sepsi – Wikipedia;
- Tempesta di citochine – Wikipedia;
- Sepsis: The evolution in definition, pathophysiology, and management;
- Sepsis—Pathophysiology and Therapeutic Concepts – Frontiers;
- Sepsi e shock settico – Manuale MSD;
- Sepsi e setticemia: significato, cause, sintomi e cura – Valori normali;
- What is new and different in the 2021 Surviving Sepsis Campaign guidelines;
- Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021.