ESERCITAZIONE: SINTESI DELL’ASPIRINA

OBIETTIVO/I: Sintesi dell’Acido Acetilsalicilico tramite acetilazione dell’acido salicilico con anidride acetica e test della purità dell’aspirina con cloruro ferrico.
STRUMENTI:
Pallone di vetro, piastra riscaldante, cilindro graduato, refrigerante a bolle, pipetta graduata, imbuto buchner, carta da filtro, beuta da vuoto, bilancia tecnica, stufa, termometro.
REAGENTI:
- Acido salicilico C7H6O3 (3 g) (R 22-41-37/38 S 26-39);
- Anidride acetica C4H6O3 (6 ml) (R 10-20/22-34 S 2-36/37/39-45);
- Soluzione di acido solforico H2SO4 96% (10 gocce) (R 35 S 26-30-45);
- Alcol etilico CH3CH2OH (R 36/37/38 S 16-26-36);
- Cloruro ferrico FeCl3 (R 34 S 26-37/39);
- Acqua distillata H2O.
RELAZIONE:
CONOSCENZE TEORICHE:
L’aspirina, o acido acetilsalicilico, è l’analgesico più diffuso al mondo. Per oltre 100 anni è stata impiegata contro il mal di denti, il mal di testa, l’artrite e il dolore in generale. Esso è stato il primo farmaco ottenuto esclusivamente per sintesi chimica dal chimico della Bayer, Felix Hofmann, ed impiegato come antipiretico, antinfiammatorio e anticoagulante.
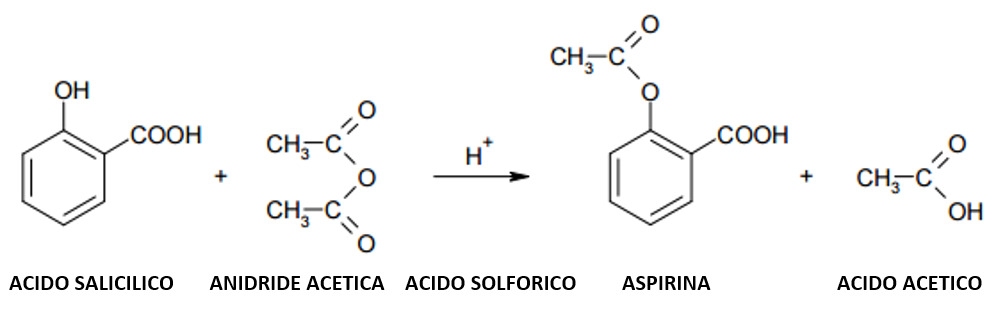
Per sintetizzare l’aspirina si effettua l’acetilazione dell’acido salicilico con anidride acetica.
Durante la reazione di sintesi dell’aspirina, l’anidride acetica deve essere in presenza di un acido forte, in modo da renderla instabile e uno dei due atomi di ossigeno aventi doppio legame acquista un protone. In questo modo, la sostituzione nucleofila dell’ossigeno ossidrilico dell’acido salicilico con il carbonio secondario dell’anidride acetica sarà più facile ed efficace e favorisce la rottura del doppio legame per formare due legami semplici con i due gruppi alcolici. Adesso, l’ossigeno alcolico legato al carbonio secondario, tende a riformare il doppio legame provocando la rottura del legame con il carbonio del gruppo acetile, favorendone il distacco della molecola di acido acetico.
REAZIONE:
DESCRIZIONE DELLA PROVA:

La reazione di sintesi dell’acido acetilsalicilico a partire dall’acido salicilico e l’anidride acetica richiede temperature comprese tra i 70-80 °C affinché l’OH fenolico dell’acido salicilico venga acetilato, cioè venga trasformato in estere dell’acido acetico per reazione con anidride acetica. Per questo motivo si allestisce un bagno-maria sulla piastra riscaldante.
In un pallone di vetro da 250 ml si versano 3 g di acido salicilico pesati con la bilancia tecnica e si aggiungono i 6 ml di anidride acetica prelevati con un cilindro graduato.
Si fissa il pallone alla struttura della piastra riscaldante in modo da farlo entrare nel becher del bagno-maria e si aggiungono 10 gocce di acido solforico concentrato al 96-97%, il catalizzatore della reazione. In questo momento si collega il pallone con il condensatore verticale a bolle (come nella figura 1) e si aspettano 15-20 minuti, sotto continua agitazione, affinché avvenga la reazione e fino a quando la soluzione non diventa completamente omogenea. La reazione va costantemente monitorata tramite l’utilizzo di un termometro per assicurarsi che la temperatura non superi gli 80 °C.
Quando la soluzione è omogenea, si toglie il refrigerante e si aggiungono, con molta cautela, 5 ml di acqua distillata per idrolizzare l’anidride acetica in eccesso, e si immerge il pallone in un becher contenente del ghiaccio, in modo da raffreddare rapidamente la soluzione provocando la precipitazione dell’acido acetilsalicilico sintetizzato che si presenterà sotto forma di cristallo.
Tuttavia, tra i prodotti di reazione non vi è solo l’acido acetilsalicilico, ma vi è anche l’acido acetico che deve essere quindi allontanato tramite filtrazione.
Si inserisci quindi una carta da filtro nell’imbuto buchner e, utilizzando una beuta da vuoto collegata ad una pompa ad acqua, si filtra il precipitato raccogliendo tutti i cristalli dal pallone aiutandosi con dell’acqua distillata (maggiore è la quantità di cristalli raccolti, migliore sarà la resa della prova).
Al termine della filtrazione, il solido deve essere essiccato in una stufa per allontanare l’acqua ad 88 C° per 7 minuti.
Nonostante la filtrazione, l’acido acetilsalicilico non è ancora puro e può contenere tracce di acido salicilico che non ha reagito con l’anidride acetica.
Si effettua quindi una cristallizzazione con soluzione idroalcolica (acqua distillata + alcol etilico in proporzioni 4:1) sfruttando la diversa solubilità dell’acido acetilsalicilico e dell’acido salicilico in etanolo in modo da ottenere cristalli più puri. Quindi si riallestisce un bagno-maria per far risolubilizzare l’acido acetilsalicilico e l’acido salicilico in etanolo e nuovamente si raffredda rapidamente la soluzione per provocare la cristallizzazione dell’acido acetilsalicilico. Si filtra di nuovo la miscela ed infine si inserisce in stufa il cristallo per allontanare la soluzione idroalcolica.
Al termine della cristallizzazione e dell’essiccazione i cristalli appariranno quasi puri. A questo punto si può calcolare la resa della reazione.
Adesso bisogna eseguire un test con cloruro ferrico, che è un test colorimetrico e qualitativo che si esegue per essere sicuri che l’acido salicilico si sia completamente trasformato in acido acetilsalicilico. E’ quindi un test che serve per valutare il grado di purezza dell’aspirina.
Questo test è basato sul confronto dell’acido acetilsalicilico sintetizzato in laboratorio con dell’aspirina (che servirà da controllo negativo) e con dell’acido salicilico (che servirà da controllo positivo).
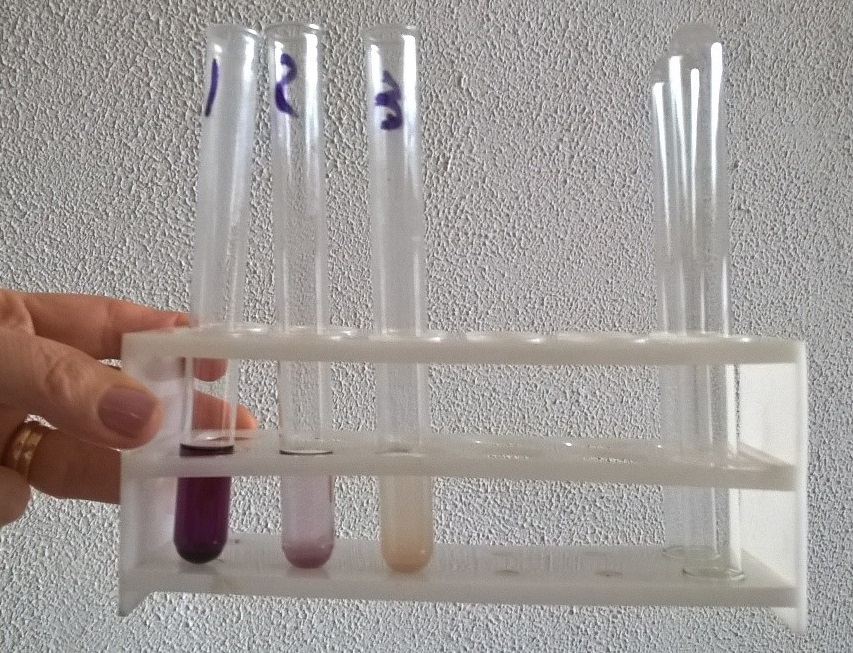
Il cloruro ferrico, in presenza di acido salicilico colora la soluzione di viola. Il colore (che può andare dal rosa al viola scuro) è proporzionale ai residui di acido salicilico presenti nella soluzione e indica il modo in cui si è lavorati.
Per eseguire questo test si allestiscono una serie di 3 provette, una in cui si inserisce l’acido salicilico sciolto in 5 mL di alcol eltilico, la seconda con l’acido acetilsalicilico grezzo sintetizzato in laboratorio sciolto in 5 mL di alcol etilico e la terza con l’aspirina commerciale disciolta in 5 mL di alcol etilico. Infine si aggiungono 2-3 gocce di Cloruro ferrico ad ogni provetta e si osserva la variazione di colore confrontando le varie provette.
CALCOLI:
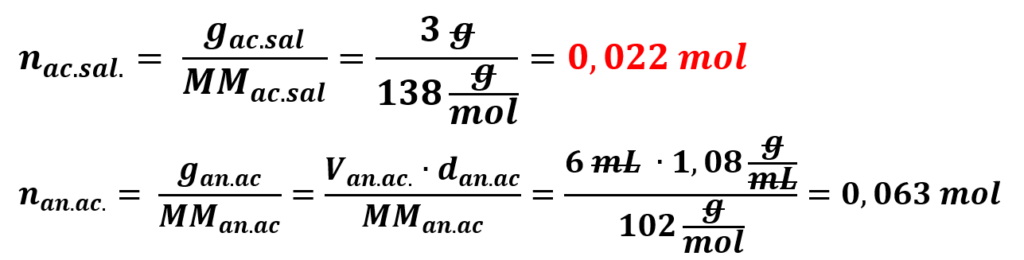
Dai calcoli risulta essere in eccesso l’anidride acetica: il reagente limitante è l’acido salicilico. Quindi naspirina=nacido salicilico, di conseguenza:
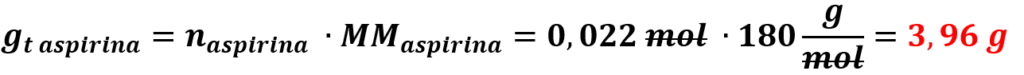
Dalla reazione di 3 g di acido salicilico si sarebbero dovuti formare 3,96 g di acido acetilsalicilico. Noi ne abbiamo pesato 2,05 g. La resa della reazione dopo la purificazione per cristallizzazione è:
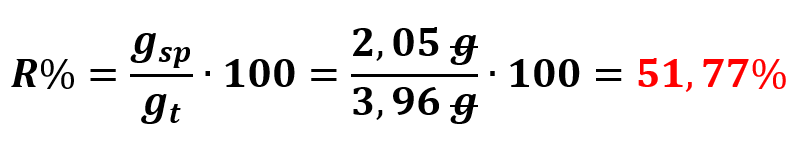
OSSERVAZIONI:
La resa della reazione calcolata da noi (51,77%) è molto bassa. La bassa resa è dovuta ad un incidente di percorso durante la prima filtrazione che ha portato ad una piccola perdita di materiale a causa della carta filtro che non ha ben aderito all’imbuto buchner. Tuttavia, l’aspirina da noi sintetizzata è abbastanza pura: come si può anche notare dalla figura 2, in seguito al test con cloruro ferrico, il colore della provetta con l’aspirina sintetizzata da noi in laboratorio è sul rosa perlaceo, questo indica che c’è scarsa presenza di acido salicilico.
Anche dalla figura 3 si può notare come i cristalli di aspirina siano così puri da apparire quasi completamente bianchi.
CONCLUSIONI:
Per concludere possiamo dire che, nonostante le problematiche riscontrate dopo aver perso parte dell’acido acetilsalicilico, la prova è andata a buon fine ed ha portato alla formazione di cristalli di aspirina quasi puri.