Il carcinoma prostatico rappresenta una delle neoplasie più comuni e costituisce una delle principali cause di mortalità da tumore negli uomini.
In Europa, sia l’incidenza che la mortalità del carcinoma prostatico sembrano essersi stabilizzate, mentre negli Stati Uniti è stata dimostrata una diminuzione della mortalità, probabilmente grazie alla diffusione dei controlli dell’antigene prostatico specifico (PSA).
L’età è un fattore di rischio importante. Autopsie su cadaveri hanno rivelato un’elevata prevalenza della lesione precancerosa, la neoplasia intraepiteliale prostatica (PIN), già diversi decenni prima dello sviluppo del carcinoma.
L’incidenza del carcinoma prostatico varia geograficamente. È rara in Asia, comune in Europa e più diffusa negli Stati Uniti, compresi gli emigranti di Asia e Giappone, nonché nell’etnia nera afroamericana. Questi dati suggeriscono l’importanza di fattori dietetici, razziali e genetici nella genesi della malattia.
Aspetti clinici
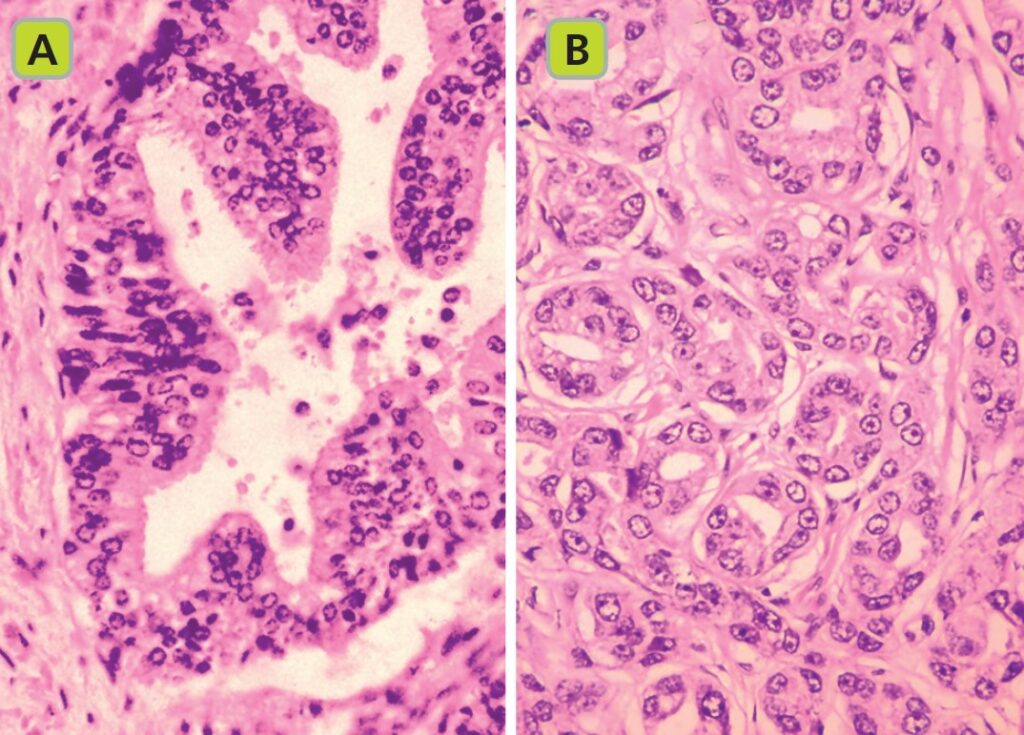
B. Il carcinoma prostatico è un adenocarcinoma, generalmente degli acini prostatici, che forma gruppi cellulari che infiltrano la lamina basale e proliferano sostituendo lo stroma prostatico.
Il carcinoma prostatico ha un lento sviluppo e può richiedere fino a 10 anni prima che diventi clinicamente significativo. L’infiltrazione locale può portare all’invasione della capsula prostatica, delle vescichette seminali o del collo vescicale.
L’obiettivo è identificare precocemente i pazienti con malattia biologicamente significativa per garantire che il trattamento radicale sia curativo. Allo stesso tempo, è importante individuare i pazienti che non trarranno beneficio dal trattamento.
Nel prendere decisioni terapeutiche, consideriamo l’età del paziente, la sua condizione clinica generale, il grado istologico (punteggio di Gleason), l’esplorazione rettale e i livelli di PSA.
Grazie allo screening del PSA, la forma abituale di presentazione del carcinoma prostatico è asintomatica e localizzata alla prostata.
Può manifestarsi con sintomi del tratto urinario inferiore (LUTS) come pollachiuria, nicturia o mitto intermittente. L’associazione con l’ipertrofia prostatica benigna (IPB) è comune.
L’esplorazione rettale e la biopsia prostatica ecoguidata sono fondamentali per la diagnosi istopatologica. Il PSA, sebbene non specifico, è un indicatore utile.
Nei casi più aggressivi spesso il PSA risulta particolarmente alto, espressione spesso di localizzazione metastatica di malattia ma non è infrequente riscontrare valori di PSA basso o normale (tumore altamente indifferenziato che non esprime PSA). Per stabilire la stadiazione e la prognosi della malattia si utilizza la classificazione TNM e il Gleason score.
Screening e diagnosi precoce
Il carcinoma prostatico è una malattia complessa, ma la diagnosi precoce e lo screening sono fondamentali per migliorare le prospettive dei pazienti.
Attualmente, le indicazioni per eseguire una biopsia transrettale o transperineale ecoguidata della prostata includono livelli di PSA superiori a 4 ng/ml. Anche l’esplorazione rettale sospettosa è un fattore importante, indipendentemente dai livelli di PSA. Questo vale per uomini con un’aspettativa di vita superiore a dieci anni.
Negli ultimi anni, la RM multiparametrica della prostata ha guadagnato importanza nella diagnosi del tumore prostatico. È indicata nei pazienti con PSA moderatamente elevato e senza evidenza palpatoria chiara. Questa tecnica consente di individuare specifiche aree sospette per l’eteroplasia prostatica e di condurre biopsie mirate (biopsia FUSION) combinando immagini ecografiche e di risonanza.
L’uso del PSA per lo screening della popolazione nel carcinoma prostatico è controverso. Sebbene sia stato dimostrato un aumento della sopravvivenza, l’eccessivo trattamento è un rischio. Pertanto, non esistono evidenze chiare a favore dello screening di massa.
La diagnosi precoce o lo screening opportunistico dovrebbero coinvolgere sia il medico che il paziente. Il paziente deve essere informato dei rischi e dei benefici della misurazione del PSA, e la decisione di eseguire il test deve essere condivisa con l’urologo.
Metodi di biopsia:
- biopsia classica: viene eseguita sotto guida ecografica con sonda transrettale, in modo “random”, con almeno 12 prelievi per coprire tutte le aree della prostata;
- biopsia FUSION: sta gradualmente sostituendo quella “random”. Utilizza la sovrapposizione in tempo reale delle immagini della RM con quelle ecografiche. Questo approccio mirato riduce il numero di biopsie non necessarie e le complicanze.
| RICORDA |
|---|
| Indicazioni per la Biopsia: PSA Totale Elevato: Un livello di PSA totale superiore a 4 ng/ml è una delle principali indicazioni per eseguire una biopsia. Questo valore dovrebbe essere confermato in più determinazioni. Modificazioni nel Tempo: Se il PSA totale mostra progressivi valori crescenti nel tempo, è necessario valutare ulteriormente con una biopsia. Nodulo Dubbio alla Esplorazione Rettale (EDR): La presenza di un nodulo sospetto alla palpazione rettale richiede una valutazione più approfondita tramite biopsia. Sospetto alla Risonanza Magnetica (RM): La RM multiparametrica della prostata può evidenziare specifiche aree sospette per il tumore. Se la RM suggerisce una lesione, la biopsia mirata è indicata. Valori di PSA e Interpretazione Valori Superiori a 10 ng/ml: In generale, valori di PSA superiori a 10 ng/ml indicano una maggiore probabilità di cancro in un paziente altrimenti sano. Valori Superiori a 20 ng/dl con Diagnosi Istologica Precedente: Se un paziente ha già una diagnosi istologica di adenocarcinoma prostatico e presenta valori di PSA superiori a 20 ng/dl, ciò suggerisce una probabile malattia localmente avanzata o già metastatica. Rapporto PSA Libero/Totale: Il rapporto tra PSA libero e totale è un parametro utile. Se il rapporto è inferiore al 20%, si orienta verso il sospetto di malignità. |
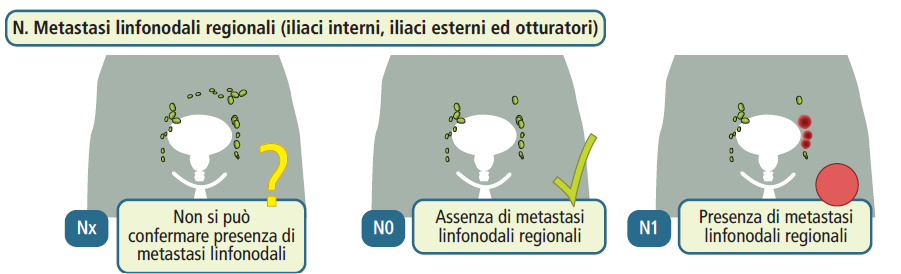
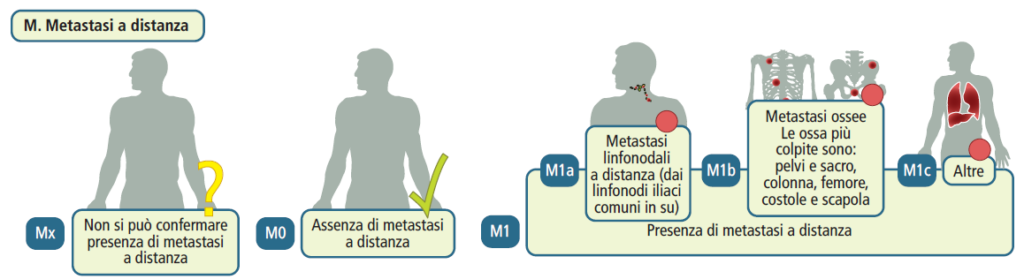
Classificazione TNM
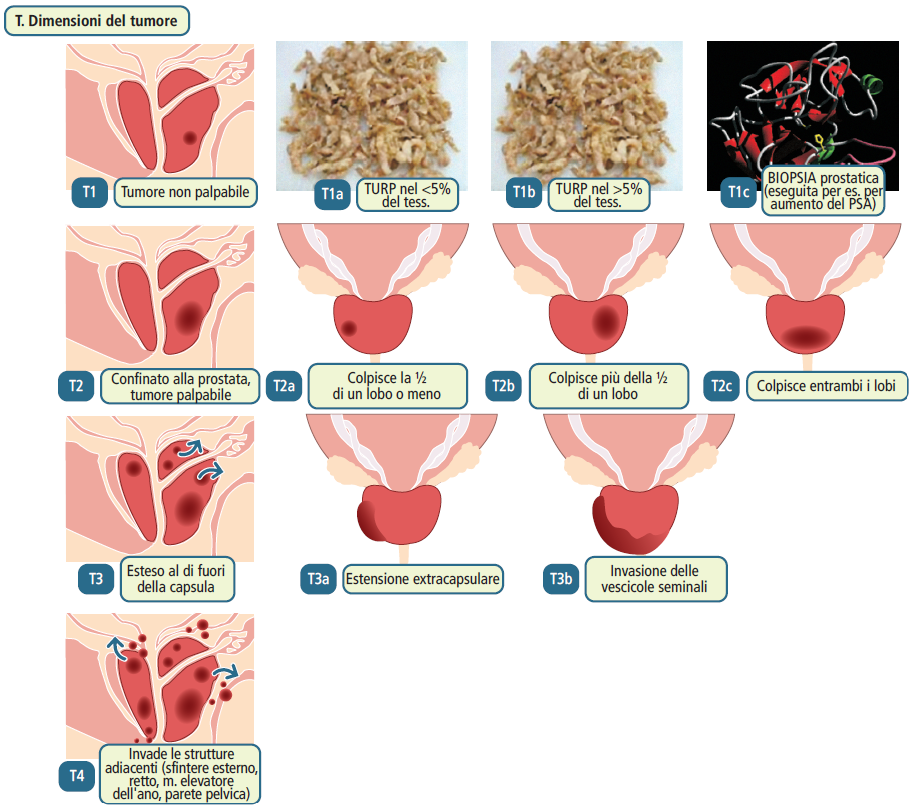
Terapia nel carcinoma prostatico localizzato
Il carcinoma prostatico, quando diagnosticato nelle fasi iniziali e ancora localizzato alla ghiandola prostatica, offre diverse opzioni terapeutiche con intento curativo.
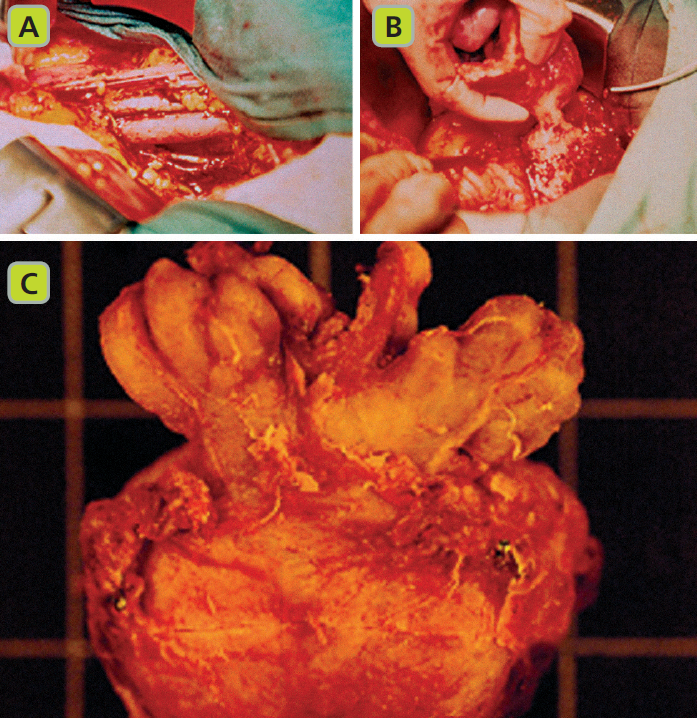
A. Linfadenectomia pelvica della catena otturatoria.
B. Prostatectomia radicale retropubica con dissezione retrograda dall’apice al collo vescicale.
C. Campione chirurgico visto dalla superficie posteriore.
- Sorveglianza Attiva (Active Surveillance): indicata per pazienti a basso rischio con aspettativa di vita >10 anni, PSA <10 ng/ml e Gleason ≤6 che non desiderano il trattamento radicale immediato.
Consiste in un rigoroso follow-up con PSA, esplorazione rettale, re-biopsie e RM multiparametrica della prostata (RMmp).
Se si verificano aumenti significativi di PSA o progressione, si passa al trattamento con intento curativo. - Osservazione (Watchful Waiting): trattamento palliativo per i soli sintomi, se si manifestano.
Indicato nei pazienti con aspettativa di vita inferiore a 10 anni o non idonei al trattamento curativo. - Prostatectomia Radicale: asportazione chirurgica della prostata e delle vescichette seminali. Esistono diverse metodiche di approccio, tra cui la chirurgia robotica (robot Da Vinci®) che riporta risultati eccellenti se la malattia è confinata all’organo con la possibilità di preservare i nervi erigendi (tecnica nerve-sparing).
- Linfoadenectomia: eseguita nei casi di tumori ad alto rischio (Gleason 4+4) e nella maggior parte dei tumori a rischio intermedio (Gleason 3+4 e 4+3).
Le due complicanze più frequenti della chirurgia sono la disfunzione erettile iatrogena (50-95%) e l’incontinenza urinaria (10-25%), solitamente da sforzo, in seguito alla rimozione della componente intraprostatica dello sfintere uretrale.
Il follow-up dopo prostatectomia radicale viene effettuato mediante controlli periodici del PSA ed esplorazione rettale.
La recidiva biochimica nel carcinoma prostatico si verifica quando il PSA aumenta sopra il valore di 0,2 ng/ml in almeno due determinazioni consecutive. Questo può essere indicativo di una progressione locale della malattia o dello sviluppo di metastasi sistemiche.
Per poter differenziare tra recidiva locale e metastasi si ci si basa sul tempo trascorso, la velocità di incremento del PSA e il Gleason iniziale e ci si affida a tecniche di imaging quali:
- PET-TC con Colina: utile per differenziare tra recidiva locale e metastatica;
- 68Ga-PSMA PET: ancora più sensibile per individuare lesioni prostatiche.
In genere un tumore indifferenziato, con recidiva di PSA precoce e un incremento rapido dei valori del PSA ci orienta verso una recidiva metastatica. Se la recidiva di PSA si verifica a partire da 10-12 mesi e l’incremento è lento, è probabile che si tratti di una recidiva locale.
Nel caso di recidiva metastatica il miglior trattamento è il blocco androgenico che riduce i livelli di testosterone e rallenta la crescita tumorale. In caso di recidiva locale si applica la radioterapia esterna di salvataggio.
- Radioterapia Esterna: Opzione valida per malattia localizzata con controllo oncologico simile alla chirurgia. Effetti avversi possono manifestarsi a mesi o anni di distanza dal trattamento.
Può dare complicanze come disuria, cistite, rettite o proctite. Rischio di seconde neoplasie, soprattutto a livello vescicale.
Dopo trattamento radioterapico la riduzione del PSA richiede un tempo piuttosto lungo perché il tessuto prostatico, neoplastico e non, rimane in sede. Il nadir (valore più basso raggiunto dal PSA) deve essere atteso tra i 6 e i 12 mesi dalla fine della RT.
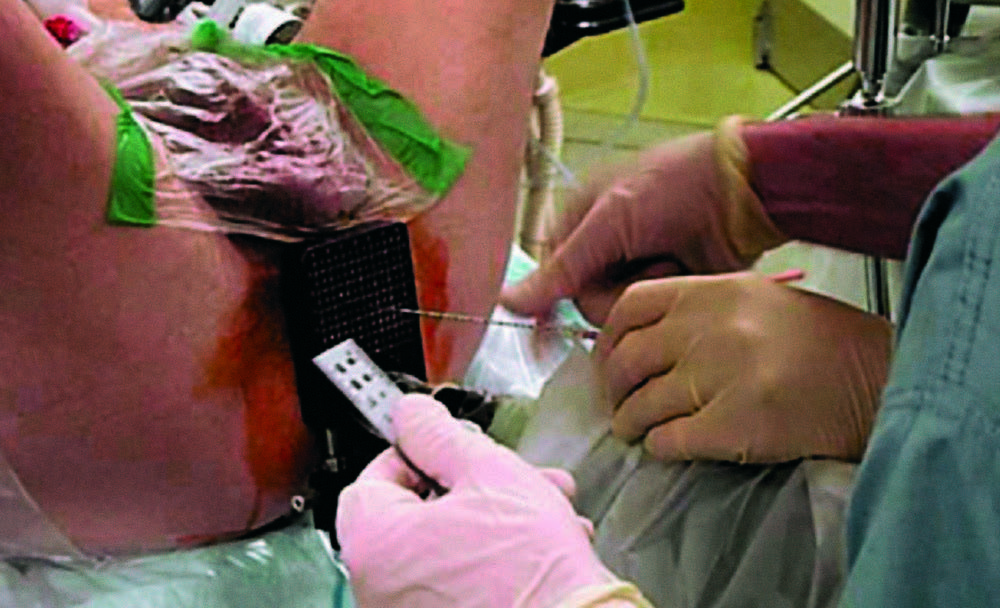
La recidiva biochimica è definita da un valore del PSA >2 ng/ml dal nadir. - Brachiterapia: nuova modalità di radioterapia in cui semi permanenti di I125 vengono collocati tramite accesso transperineale ecoguidato.
È indicata nei pazienti a basso rischio con Gleason ≤6 e PSA <10 ng/ml e un volume prostatico piccolo. Scelta ideale per l’anziano o il paziente giovane che desidera preservare la potenza.
Controindicata in volumi prostatici elevati o in pazienti con sintomatologia delle vie urinarie inferiori.
Carcinoma prostatico localmente avanzato
Il gruppo di pazienti con stadio avanzato del cancro alla prostata è sempre meno frequente, ma richiede una gestione attenta e mirata. Questi pazienti presentano caratteristiche specifiche:
- infiltrazione extracapsulare o infiltrazione delle vescichette seminali (T3-T4): il cancro si è diffuso oltre la capsula prostatica o ha coinvolto le vescichette seminali;
- metastasi a livello dei linfonodi loco-regionali (N+): sono presenti metastasi nei linfonodi vicini alla prostata, ma non si osserva disseminazione a distanza.
Poiché non esiste ancora un protocollo standardizzato per il trattamento di questi pazienti, la gestione deve essere personalizzata. Tuttavia, alcune opzioni terapeutiche hanno dimostrato efficacia:
- Combinazione di blocco androgenico e radioterapia: questa strategia mira a ridurre i livelli di testosterone (l’ormone maschile) e a irradiare direttamente la prostata. È un’opzione efficace per controllare la crescita tumorale e migliorare la sopravvivenza;
- prostatectomia: in alcuni pazienti (ad esempio, quelli con stadio T3a, Gleason score ≤ 8, PSA ≤ 20 ng/ml e speranza di vita superiore ai 10 anni), la rimozione chirurgica della prostata può essere considerata come parte di un trattamento multimodale. Questa procedura può essere combinata con radioterapia e ormonoterapia per massimizzare i risultati.
Carcinoma prostatico metastatico
Il carcinoma prostatico, quando sfugge al suo confinamento organico, rappresenta una sfida clinica.
Il cancro alla prostata può infiltrare i tessuti extraprostatici e diffondersi attraverso la via linfatica e ematogena. Le metastasi possono coinvolgere diversi organi, ma il tessuto osseo è particolarmente suscettibile. Questo fenomeno è più frequente nei tumori indifferenziati (con un punteggio di Gleason superiore a 7) o in lesioni di elevato volume tumorale. In questi casi, i livelli di PSA sierico sono significativamente superiori rispetto ai casi di malattia confinata all’organo.
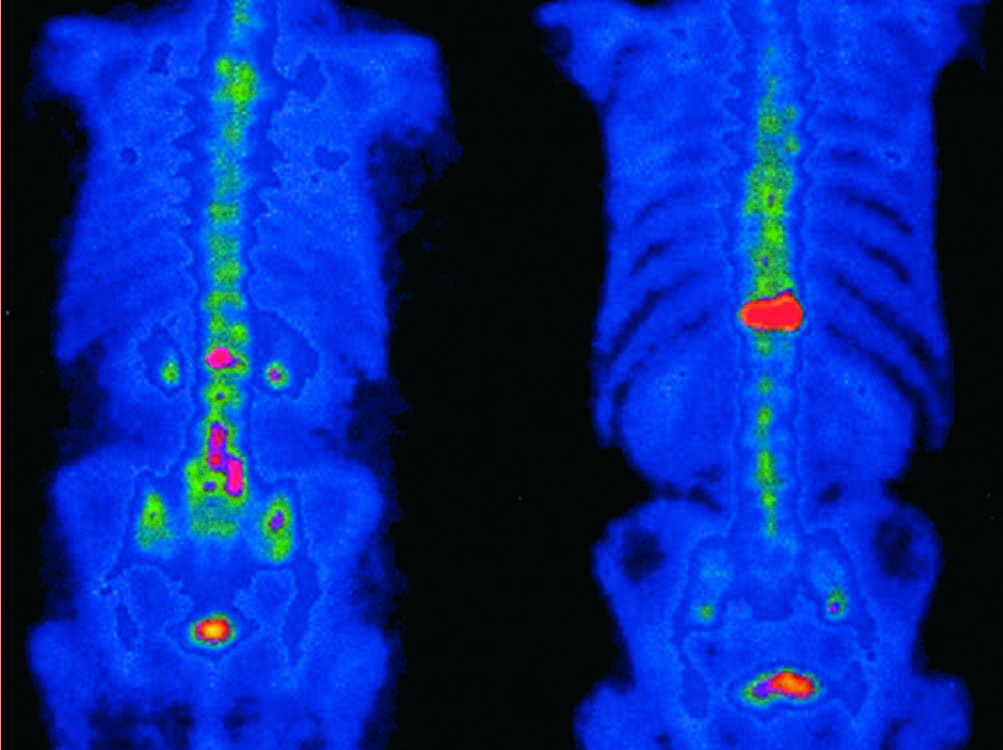
La presenza di metastasi rappresenta una controindicazione per i trattamenti locali con intento curativo. Pertanto, nei pazienti con PSA superiore a 20 ng/ml o un punteggio di Gleason maggiore di 8, è essenziale valutare l’estensione della malattia mediante scintigrafia ossea e TC addominopelvica con mezzo di contrasto. Questa valutazione guiderà la scelta dell’approccio terapeutico appropriato.
Il trattamento della malattia avanzata si basa principalmente sulla terapia ormonale. L’obiettivo è ridurre i livelli di testosterone (deprivazione androgenica o castrazione) per prevenire la comparsa di eventi ossei secondari e migliorare i sintomi. L’uso di analoghi dell’LHRH (come buserelina, goserelina e leuprolide) è comune. Tuttavia, questi farmaci possono causare un iniziale aumento transitorio del testosterone (flare-up). Pertanto, vengono spesso associati a farmaci anti-androgeni.
La scelta del momento migliore per iniziare l’ormonoterapia è ancora oggetto di dibattito. Tuttavia, sembra che un inizio precoce possa comportare benefici per il controllo precoce della malattia.
Va notato che la deprivazione androgenica può causare effetti avversi significativi, come calo della libido, disfunzione erettile, vampate, ginecomastia, alterazioni intestinali, edemi, perdita di massa ossea e fratture patologiche.
Se la terapia ormonale di prima linea fallisce, il tumore viene definito resistente alla castrazione (CRPC: Castration Resistant Prostate Cancer).
Nel paziente con malattia metastatica resistente alla castrazione (CRPC M1) candidabile a chemioterapia sistemica, il docetaxel rappresenta l’opzione di scelta. Per i pazienti non candidabili alla chemioterapia, le terapie ormonali di seconda linea (come abiraterone ed enzalutamide) sono valide alternative. Queste opzioni si applicano anche alle malattie resistenti alla castrazione non metastatiche (CRPC M0).
Nel carcinoma prostatico metastatico, il trattamento palliativo del dolore osseo è spesso necessario. Questo può includere l’uso di oppioidi, radioterapia, bifosfonati (come lo zoledronato), radiofarmaci (come lo stronzio o il radio) o denosumab.
Le metastasi ossee da carcinoma prostatico possono causare compressione midollare acuta, richiedendo un intervento tempestivo.
Si inizia con una risonanza magnetica (RM) della colonna vertebrale che copre i segmenti interessati. Questo aiuta a identificare le aree compromesse e valutare l’estensione della compressione midollare.
La scelta del trattamento dipende dalle manifestazioni neurologiche del paziente. È importante considerare la gravità dei sintomi e la funzionalità del midollo spinale.
Si somministrano corticosteroidi ad alte dosi per ridurre l’infiammazione e alleviare la compressione midollare. Questo può migliorare temporaneamente i sintomi e prevenire danni neurologici gravi.
Una volta posta la diagnosi di compressione midollare da metastasi ossee, si procede con trattamenti specifici:
- Radioterapia esterna urgente: se la speranza di vita del paziente è superiore a 6 mesi, la radioterapia esterna urgente è un’opzione. Questo trattamento mira a ridurre le dimensioni delle metastasi e alleviare la compressione midollare;
- Laminectomia decompressiva urgente: in alcuni casi, soprattutto quando la compressione è grave o non risponde alla radioterapia, si può optare per una laminectomia decompressiva. Questo intervento chirurgico rimuove parte delle vertebre per liberare lo spazio per il midollo spinale;
- Soppressione androgenica rapida: se la compressione midollare si sviluppa in modo subacuto, è possibile utilizzare una soppressione androgenica rapida. Questo può essere ottenuto tramite:
- estrogeni per via endovenosa: gli estrogeni possono ridurre rapidamente i livelli di testosterone e rallentare la crescita delle metastasi;
- chetoconazolo ad alte dosi: questo farmaco inibisce la produzione di testosterone;
- radioterapia o orchiectomia bilaterale: in alternativa, si può considerare la radioterapia o l’orchiectomia bilaterale (rimozione chirurgica dei testicoli) per ridurre i livelli di testosterone.