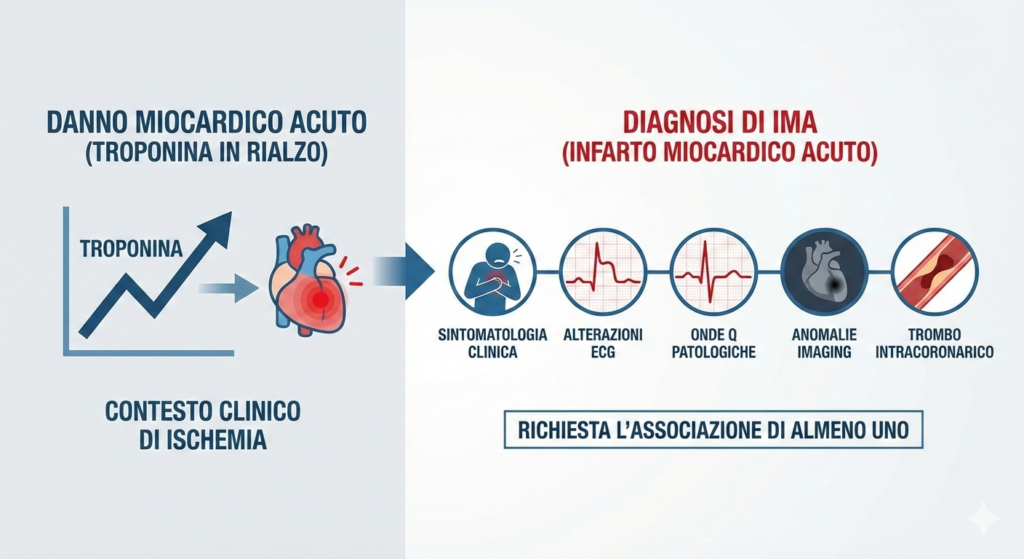
L’infarto miocardico acuto (IMA) rappresenta una delle manifestazioni più gravi della cardiopatia ischemica. Secondo la quarta definizione universale del 2018, il suo inquadramento diagnostico si basa su una distinzione cruciale tra “danno miocardico“, definito da un aumento dei valori di troponina, e “danno miocardico acuto“, caratterizzato da un andamento dinamico (rialzo e/o discesa) dello stesso biomarcatore.
L’infarto miocardico acuto viene quindi diagnosticato quando un danno miocardico acuto si manifesta in un contesto clinico suggestivo di ischemia. Questa precisa stratificazione terminologica è di importanza strategica, poiché permette di differenziare eventi acuti da condizioni croniche (come l’insufficienza renale o la cardiopatia ischemica stabile) che causano un rialzo stabile della troponina, prevenendo così diagnosi errate e l’inappropriata attivazione dei percorsi di cura acuta.
Per confermare la diagnosi di IMA in presenza di danno miocardico acuto, è richiesta l’associazione di almeno uno dei seguenti cinque criteri:
- sintomatologia clinica suggestiva di ischemia miocardica;
- alterazioni elettrocardiografiche di nuova insorgenza indicative di ischemia;
- comparsa di nuove onde Q patologiche all’elettrocardiogramma;
- evidenza, tramite tecniche di imaging, di nuove anomalie della contrattilità segmentaria;
- identificazione di un trombo intracoronarico mediante coronarografia o esame autoptico.
La fisiopatologia predominante dell’IMA risiede nella rottura di una placca aterosclerotica instabile all’interno di un’arteria coronaria, con conseguente formazione di un trombo che occlude, parzialmente o totalmente, il lume del vaso.
Questo processo, secondario all’aterosclerosi, è la causa più frequente. Esistono tuttavia cause più rare, che includono embolia coronarica, vasospasmo coronarico (ad esempio indotto da cocaina), cause iatrogene (post-chirurgiche o interventistiche) e condizioni extracardiache che alterano l’equilibrio tra domanda e offerta di ossigeno o favoriscono la trombosi, come stati di ipercoagulabilità, anemia falciforme o inalazione di monossido di carbonio.
La comprensione dell’eziologia specifica è fondamentale, poiché la prognosi e il trattamento variano significativamente; pertanto, è essenziale classificare i diversi tipi di infarto per orientare l’approccio terapeutico.
Caricamento….
Classificazione dell’Infarto Miocardico Acuto
La classificazione dell’infarto miocardico acuto è un passaggio fondamentale per stratificare il rischio del paziente, comprendere l’eziologia sottostante e guidare le decisioni terapeutiche in modo mirato.
La quarta definizione universale distingue cinque tipi di IMA in base al meccanismo fisiopatologico, mentre classificazioni cliniche come quella di Killip forniscono un’immediata valutazione prognostica basata sulla gravità dell’insufficienza cardiaca.
La tabella seguente riassume i cinque tipi di IMA secondo la definizione universale.
| Tipo | Descrizione |
|---|---|
| 1 | IMA “classico” spontaneo, dovuto all’ulcerazione e complicazione di una placca aterosclerotica coronarica |
| 2 | IMA secondario a una discrepanza tra domanda e offerta di ossigeno (es. anemia severa, crisi ipertensive, tachiaritmie, ipotensione) |
| 3 | IMA che si manifesta con morte cardiaca improvvisa, prima che sia possibile determinare l’aumento dei marcatori di miocardionecrosi |
| 4 | IMA associato a procedure coronariche: (4a) post-trattamento percutaneo, (4b) associato a trombosi dello stent, (4c) associato a restenosi di uno stent |
| 5 | IMA associato a un intervento chirurgico di bypass aorto-coronarico |
Parallelamente, la classificazione di Killip, basata su semplici reperti dell’esame obiettivo, rimane uno strumento prognostico essenziale per valutare la gravità dell’insufficienza cardiaca in fase acuta.
| Classe | Quadro Clinico |
|---|---|
| I | Assenza di segni di insufficienza cardiaca |
| II | Insufficienza cardiaca lieve, con presenza di crepitii polmonari e/o terzo tono cardiaco |
| III | Edema polmonare acuto franco |
| IV | Shock cardiogeno |
Queste classificazioni, sia eziologiche che cliniche, permettono di inquadrare le diverse manifestazioni con cui l’IMA può presentarsi, orientando l’approccio fin dal primo contatto medico.
Manifestazioni cliniche e valutazione iniziale
Le manifestazioni cliniche dell’IMA sono estremamente variabili, rendendo fondamentale un alto indice di sospetto per evitare ritardi diagnostici potenzialmente fatali. Sebbene il dolore toracico sia il sintomo cardine, è cruciale riconoscere le presentazioni atipiche, che sono più frequenti in popolazioni specifiche come anziani, donne e pazienti diabetici.
La presentazione più frequente è un dolore toracico di tipo anginoso, caratterizzato da:
- qualità: oppressivo, costrittivo, “a morsa”;
- durata ed intensità: maggiore durata (spesso >20-30 minuti) e intensità rispetto all’angina stabile;
- insorgenza: tipicamente a riposo, spesso al mattino al risveglio;
- risposta alla terapia: non recede con la somministrazione di nitroglicerina sublinguale;
- sintomi associati: frequentemente accompagnato da un importante quadro vagale con nausea, vomito e sudorazione profusa.
Le presentazioni atipiche possono includere dolore epigastrico (particolarmente nell’infarto a sede inferiore), dispnea isolata o una sincope non accompagnata da dolore toracico. Queste forme sono più comuni in pazienti anziani, di sesso femminile, diabetici o in pazienti critici e post-operati.
L’esame obiettivo fornisce indizi cruciali per la diagnosi e l’identificazione precoce delle complicanze:
- pressione arteriosa: generalmente non si riduce in modo significativo a causa della scarica catecolaminergica. Un’ipotensione marcata deve far sospettare una complicanza meccanica o una disfunzione ventricolare severa;
- auscultazione cardiaca e polmonare: è possibile riscontrare un terzo (S3) o quarto (S4) tono, uno sdoppiamento del secondo tono, la comparsa di un nuovo soffio da insufficienza mitralica (danno al muscolo papillare) o crepitii polmonari (segno di insufficienza cardiaca);
- segni di infarto del ventricolo destro: la presenza di turgore delle vene giugulari e il segno di Kussmaul (aumento paradosso della pressione venosa giugulare durante l’inspirazione) sono suggestivi di un coinvolgimento del ventricolo destro.
- Febbricola: È comune osservare un lieve rialzo termico nei primi giorni post-infarto.
La presentazione clinica può variare significativamente con l’età, come riassunto nella tabella seguente.
| Caratteristica | Pazienti giovani | Pazienti anziani (>75 anni) |
|---|---|---|
| Presentazione clinica | Sintomi tipici | Frequentemente sintomi atipici (dolore atipico, sincope, aritmie) |
| Caratteristiche dell’infarto | Più frequente IMA con sopraslivellamento dell’ST (STEMI). Primo infarto di maggiori dimensioni | Stessa frequenza di STEMI e NSTEMI (maggiore presenza di circoli collaterali) |
| Complicanze | Meno frequente shock cardiogeno e rottura della parete libera | Maggior incidenza di shock cardiogeno e rottura della parete libera |
I reperti clinici, per quanto essenziali, devono essere rapidamente integrati con esami strumentali e di laboratorio per raggiungere una diagnosi definitiva e avviare il trattamento più appropriato.
Criteri diagnostici strumentali e di laboratorio
La conferma del sospetto clinico di IMA si basa sull’integrazione di reperti elettrocardiografici, dosaggio dei marcatori di miocardionecrosi e, in casi selezionati, tecniche di imaging. Questi esami sono cruciali non solo per la diagnosi ma anche per distinguere tra IMA con (STEMI) e senza (NSTEMI) sopraslivellamento del tratto ST, una distinzione che guida le strategie di riperfusione urgenti.
Elettrocardiogramma (ECG)
L’ECG è l’esame fondamentale nella valutazione iniziale di un paziente con sospetta sindrome coronarica acuta e deve essere eseguito e interpretato entro dieci minuti dal primo contatto medico.
Nell’Infarto Miocardico senza Sopraslivellamento del Tratto ST (NSTEMI), l’occlusione coronarica è parziale, causando una lesione subendocardica (non transmurale). L’ECG può presentarsi con diversi quadri:
- ECG normale: soprattutto nelle primissime fasi;
- sottoslivellamento del tratto ST: orizzontale o discendente, considerato significativo se di almeno 0.5 mm in due o più derivazioni contigue;
- onde T negative e simmetriche: indicative di ischemia.
L’Infarto Miocardico con Sopraslivellamento del Tratto ST (STEMI) è causato da un’occlusione coronarica completa, che determina una lesione transmurale. Il segno ECG caratteristico è il sopraslivellamento convesso del tratto ST. L’evoluzione tipica dell’ECG nello STEMI prevede:
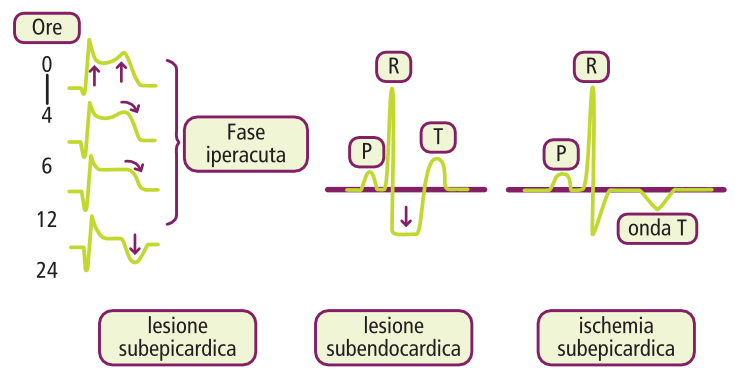
- negativizzazione progressiva dell’onda T;
- comparsa dell’onda Q di necrosi;
- normalizzazione graduale del tratto ST.
La persistenza del sopraslivellamento dell’ST a 6 mesi dall’evento deve far sospettare la formazione di un aneurisma ventricolare.
La localizzazione delle alterazioni ECG permette di identificare la parete miocardica coinvolta e, di conseguenza, l’arteria coronaria probabilmente occlusa:
- parete laterale alta: I, aVL (Arteria Circonflessa);
- parete laterale bassa: V5, V6 (Arteria Circonflessa);
- parete anteriore: V2-V4 (Arteria Interventricolare Anteriore);
- setto: V1-V2 (Arteria Interventricolare Anteriore);
- parete inferiore: II, III, aVF (Arteria Coronaria Destra);
- parete posteriore: sottoslivellamento ST in V1-V2 (immagine speculare). La conferma si ha con il sopraslivellamento nelle derivazioni dorsali V7-V9;
- ventricolo destro: sopraslivellamento ST nelle derivazioni destre V3R e V4R (da eseguire in tutti gli infarti inferiori).
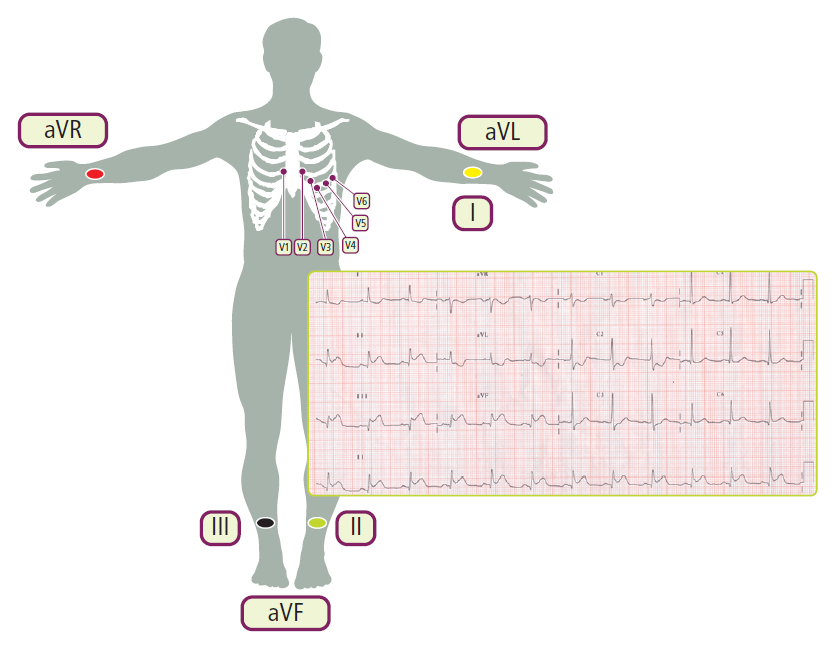
Si osservi l’elevazione del tratto ST a livello della parete inferiore (II, III, aVF), con sottoslivellamento in V1 e V2. Il sottoslivellamento in I e aVL, conferma ulteriormente l’ipotesi di un’origine ischemica del quadro (immagine speculare).
Esami di laboratorio
Il dosaggio dei marcatori di miocardionecrosi è essenziale per confermare il danno miocardico:
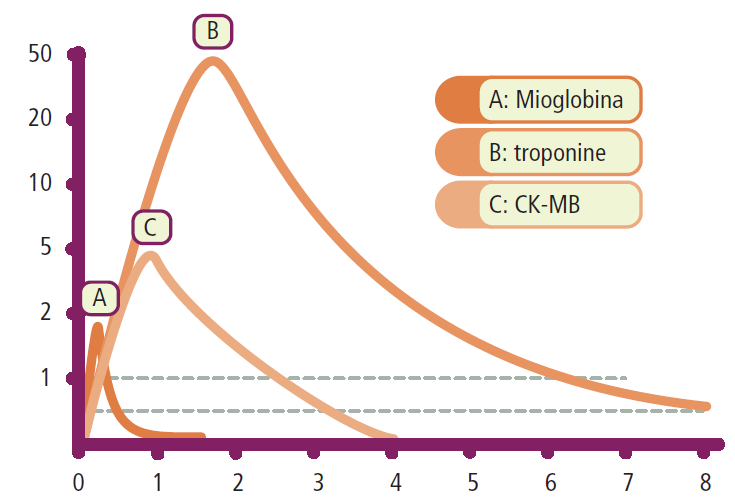
- CK e CK-MB massa: la creatinchinasi (CK) e la sua isoforma miocardica (CK-MB) iniziano ad aumentare dopo 4-6 ore, raggiungono un picco a circa 24 ore e si normalizzano in 48-72 ore. La loro specificità è limitata, poiché possono aumentare anche in seguito a danno muscolare, miocardite o cardioversione;
- troponine (TnI e TnT): sono i marcatori più specifici e sensibili di danno miocardico. Aumentano dopo 4-6 ore ma rimangono elevate per un periodo prolungato (7-14 giorni), rendendole utili per la diagnosi di infarto evoluto. Le Linee Guida 2020 raccomandano l’uso di test ad alta sensibilità (hs-cTn) e algoritmi rapidi (con prelievi a 0h/1h o 0h/2h) per accelerare il processo diagnostico in Pronto Soccorso. È imperativo sottolineare che l’interpretazione dei valori di troponina deve sempre avvenire nel contesto clinico completo del paziente, integrando anamnesi, esame obiettivo ed ECG;
- altri marcatori: la mioglobina si eleva molto precocemente (2 ore) ma è poco specifica. Il BNP/NT-proBNP non ha valore diagnostico per l’IMA ma è un importante marcatore prognostico di disfunzione ventricolare.
| Cause cardiache | Cause non cardiache |
|---|---|
| Insufficienza cardiaca | Embolia polmonare, ipertensione polmonare severa |
| Miocardite, miopericardite | Insufficienza renale |
| Sindrome di Tako-Tsubo | Accidente cerebrovascolare (ACV), emorragia subaracnoidea |
| Crisi ipertensiva | Paziente critico (sepsi, insufficienza respiratoria) |
| Tachiaritmie o bradiaritmie | Ustionati |
| Dissezione aortica o valvulopatia aortica | Rabdomiolisi |
| Cardiomiopatia ipertrofica | Distiroidismi |
| Contusione cardiaca, chirurgia, ablazioni | Sostanze tossiche, farmaci |
| Patologie infiltrative (amiloidosi, sarcoidosi) |
Tecniche di imaging
- Ecocardiogramma: è una tecnica fondamentale nella fase acuta per identificare alterazioni della contrattilità segmentaria (aree acinetiche o ipocinetiche), valutare la funzione ventricolare globale e diagnosticare precocemente eventuali complicanze meccaniche (rotture, versamento pericardico, trombi).
- scintigrafia di perfusione: tecnica a isotopi che ha valore soprattutto a posteriori, per valutare l’estensione della necrosi stabilizzata;
- RX del torace: utile nella diagnosi differenziale del dolore toracico e per valutare la presenza di congestione polmonare.
Con la diagnosi di IMA confermata e localizzata, e la distinzione critica tra NSTEMI e STEMI stabilita dall’ECG, la strategia terapeutica si diverge in due percorsi distinti e tempo-dipendenti.
Caricamento….
Strategie di gestione terapeutica
L’approccio terapeutico all’infarto miocardico acuto è radicalmente diverso a seconda della presenza o assenza del sopraslivellamento del tratto ST. Nello STEMI, l’obiettivo primario è la riperfusione coronarica più rapida possibile, poiché “il tempo è miocardio”. Nell’NSTEMI, l’approccio iniziale è basato sulla stabilizzazione medica e sulla stratificazione del rischio per determinare la tempistica ottimale per l’angiografia coronarica.
Infarto Miocardico senza Sopraslivellamento del Tratto ST (NSTEMI)
La gestione dell’NSTEMI è identica a quella dell’angina instabile; entrambe le condizioni rientrano nel quadro delle Sindromi Coronariche Acute senza sopraslivellamento del tratto ST (SCA-NSTE). L’approccio si basa sulla stratificazione del rischio ischemico per guidare la strategia invasiva.
Secondo le Linee Guida ESC 2020, i pazienti vengono stratificati come segue:
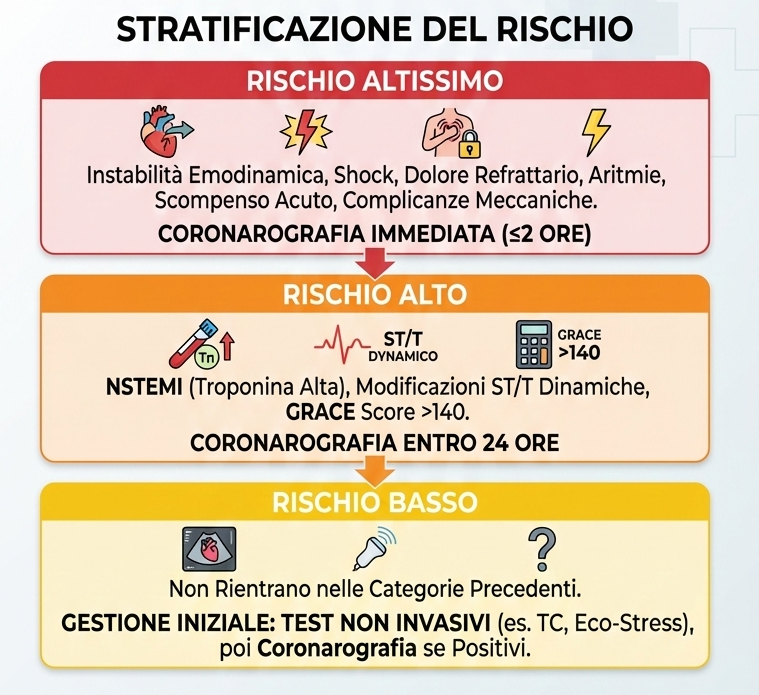
- rischio altissimo: pazienti con instabilità emodinamica, shock cardiogeno, dolore toracico refrattario, aritmie ventricolari maligne, scompenso cardiaco acuto o complicanze meccaniche. Questi pazienti richiedono una coronarografia immediata (entro 2 ore);
- rischio alto: pazienti con diagnosi confermata di NSTEMI (rialzo di troponina), modificazioni dinamiche del tratto ST/T o un GRACE score >140 (Global Registry of Acute Coronary Events). Questi pazienti devono essere sottoposti a coronarografia entro 24 ore;
- rischio basso: pazienti che non rientrano nelle categorie precedenti. Possono essere gestiti inizialmente con test non invasivi (es. TC coronarica, eco-stress) e sottoposti a coronarografia solo se questi risultano positivi.
La terapia medica per l’NSTEMI comprende:

- antiaggregazione: acido acetilsalicilico (ASA) a cui si aggiunge un secondo antiaggregante (inibitore del recettore P2Y12). Le Linee Guida 2020 sconsigliano il pre-trattamento di routine con inibitori P2Y12, poiché tale approccio potrebbe essere dannoso nei pazienti con diagnosi alternative (es. dissezione aortica) e può aumentare il rischio emorragico o ritardare interventi chirurgici urgenti;
- anticoagulazione: si utilizzano fondaparinux (farmaco di prima scelta), eparina sodica o eparine a basso peso molecolare fino alla rivascolarizzazione o alla dimissione;
- terapia antianginosa: include nitrati, beta-bloccanti e calcio-antagonisti per il controllo dei sintomi.
Infarto Miocardico con Sopraslivellamento del Tratto ST (STEMI)
Lo STEMI è un’emergenza medica causata da un’occlusione coronarica completa. L’obiettivo è ripristinare il flusso sanguigno (riperfusione) il prima possibile, con un beneficio massimo ottenuto entro le prime 3 ore dall’insorgenza dei sintomi.
Le misure iniziali del protocollo di gestione dello STEMI includono:
- ossigenoterapia: se la saturazione di ossigeno è <90% o in presenza di segni di scompenso cardiaco;
- ASA: dose di carico da somministrare il prima possibile;
- secondo antiaggregante: prasugrel o ticagrelor (da preferire) o clopidogrel;
- anticoagulazione: generalmente con eparina non frazionata;
- terapia del dolore: morfina per alleviare il dolore e ridurre il precarico;
- stabilizzazione emodinamica: gestione dell’ipotensione (fluidi, inotropi) o dell’ipertensione (nitroglicerina, beta-bloccanti).
Le strategie di riperfusione sono due:
- angioplastica coronarica percutanea (PCI) primaria: è la strategia di scelta. Consiste in un cateterismo cardiaco urgente per dilatare l’arteria occlusa e impiantare uno stent;
- trombolisi (o fibrinolisi): somministrazione di un farmaco per via endovenosa che scioglie il trombo. È indicata solo se non è possibile eseguire una PCI primaria entro 120 minuti dal primo contatto medico.
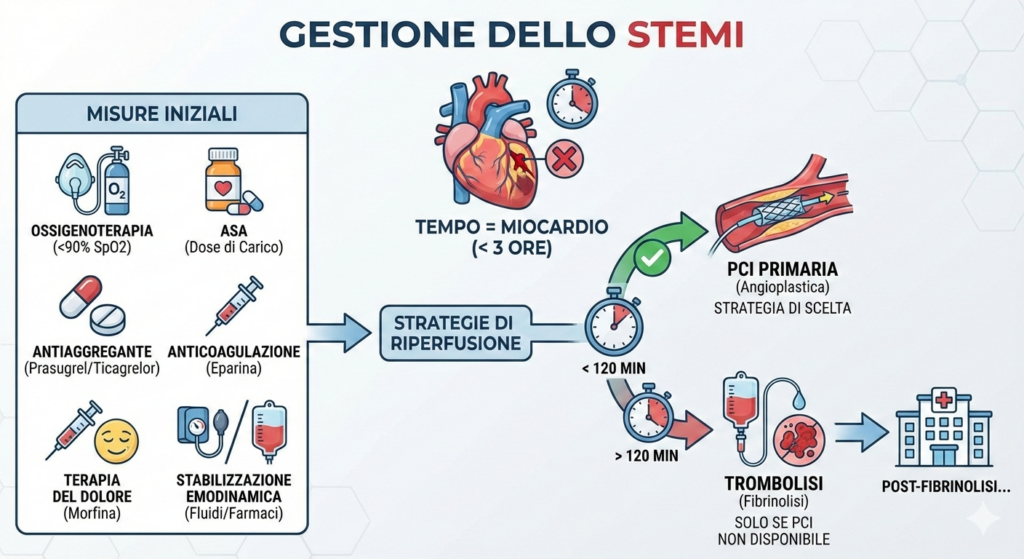
Dopo la fibrinolisi, il paziente deve comunque essere trasferito in un centro in grado di eseguire una coronarografia. Se la fibrinolisi ha successo (risoluzione del dolore e riduzione del sopraslivellamento ST >50% rispetto al basale), si esegue una coronarografia “di routine” entro 24 ore. Se la fibrinolisi fallisce, è indicata una PCI “di salvataggio” immediata.
La fibrinolisi presenta specifiche controindicazioni che devono essere attentamente valutate.
| Controindicazioni assolute | Controindicazioni relative |
|---|---|
| Pregressa emorragia intracranica | Attacco ischemico transitorio (TIA) nei 6 mesi precedenti |
| Infarto cerebrale ischemico nei 6 mesi precedenti | Pressione arteriosa >180/110 mmHg refrattaria alla terapia |
| Neoplasia, aneurisma o malformazione artero-venosa cerebrale | Gravidanza o parto nell’ultima settimana |
| Emorragia gastrointestinale nell’ultimo mese | Patologia epatica avanzata |
| Intervento di chirurgia maggiore, intracranica o intraspinale nelle 3 settimane precedenti | Endocardite infettiva |
| Trauma grave nelle ultime 3 settimane | Ulcera peptica attiva |
| Emorragie interne attive o diatesi emorragica nota | Rianimazione cardiopolmonare (RCP) prolungata o traumatica |
| Sospetta dissezione aortica | Terapia anticoagulante orale in corso |
| Puntura in sede non comprimibile nelle ultime 24 ore |
La scelta e la gestione della terapia antitrombotica, che include fibrinolitici, antiaggreganti e anticoagulanti, rappresentano il cardine del trattamento dell’IMA.
Approfondimento sulla terapia antitrombotica
La terapia antitrombotica è la pietra angolare del trattamento dell’infarto miocardico acuto. Essa si basa sull’uso sinergico di farmaci fibrinolitici, antiaggreganti e anticoagulanti. La scelta dell’agente specifico all’interno di ciascuna classe è dettata dal quadro clinico (STEMI vs. NSTEMI), dalla strategia di riperfusione pianificata (PCI vs. fibrinolisi) e da fattori individuali del paziente, come il rischio emorragico e le comorbilità.
Terapia fibrinolitica
I farmaci fibrinolitici agiscono attivando il plasminogeno a plasmina, l’enzima endogeno che degrada la fibrina, lisando così il trombo. Il loro impiego è riservato esclusivamente al trattamento dello STEMI nei casi in cui una PCI primaria non sia realizzabile entro 120 minuti dalla diagnosi e in assenza di controindicazioni assolute. I principali agenti includono:
- rTPA (attivatore tissutale del plasminogeno) e derivati: agenti fibrino-specifici come tenecteplase (TNK) sono i più utilizzati per la loro efficacia e la comoda somministrazione in bolo unico;
- streptochinasi: di origine batterica, il suo uso è limitato a causa del potenziale allergenico e del rischio di ipotensione;
- anistreplasi (APSAC): un complesso di streptochinasi e plasminogeno, anch’esso di uso raro.
Farmaci antiaggreganti
Questi farmaci inibiscono l’attivazione e l’aggregazione delle piastrine, prevenendo la crescita del trombo:
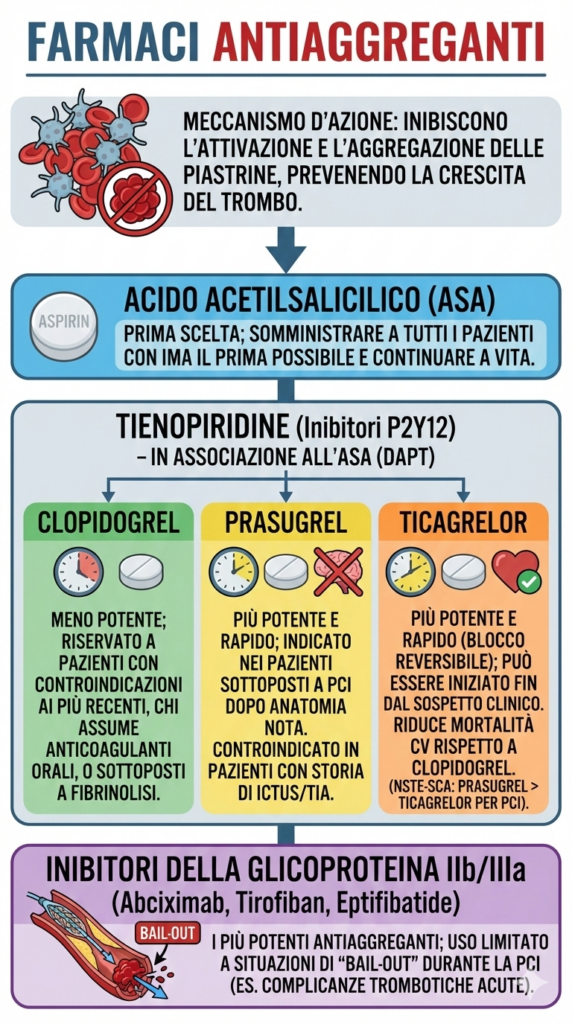
- acido acetilsalicilico (ASA): è il farmaco di prima scelta, da somministrare a tutti i pazienti con IMA il prima possibile e da continuare a vita;
- tienopiridine (inibitori del recettore P2Y12): agiscono bloccando il recettore P2Y12 dell’ADP. Si utilizzano sempre in associazione all’ASA (doppia terapia antiaggregante, DAPT):
- clopidogrel: meno potente, è oggi riservato ai pazienti con controindicazioni agli agenti più recenti, a chi assume già un anticoagulante orale o a chi viene sottoposto a fibrinolisi;
- prasugrel: più potente e rapido del clopidogrel. È indicato nei pazienti sottoposti a PCI, ma solo dopo che l’anatomia coronarica è nota. È controindicato in pazienti con storia di ictus/TIA;
- ticagrelor: più potente e rapido del clopidogrel, con un blocco reversibile del recettore. A differenza del prasugrel, può essere iniziato fin dal sospetto clinico. Riduce la mortalità cardiovascolare rispetto al clopidogrel. Nelle SCA-NSTE, qualora si proceda a PCI dopo angiografia diagnostica, il prasugrel dovrebbe essere considerato superiore al ticagrelor;
- inibitori della glicoproteina IIb/IIIa (Abciximab, Tirofiban, Eptifibatide): sono i più potenti antiaggreganti disponibili. Il loro uso è oggi limitato a situazioni di “bail-out” durante la PCI (es. complicanze trombotiche acute in sala di emodinamica).
Farmaci anticoagulanti
Gli anticoagulanti vengono aggiunti alla terapia antiaggregante per inibire la cascata della coagulazione e la formazione di fibrina:
- fondaparinux: un inibitore selettivo del Fattore Xa. È considerato il farmaco di prima scelta nell’NSTEMI per il suo favorevole profilo di efficacia/sicurezza. È invece controindicato durante la PCI primaria nello STEMI, poiché aumenta il rischio di trombosi intra-stent;
- bivalirudina: un inibitore diretto della trombina. È un’alternativa all’eparina, particolarmente utile durante la PCI primaria in pazienti ad alto rischio emorragico.
Terapia alla dimissione e gestione a lungo termine
Una volta superata la fase acuta, la gestione del paziente post-infarto si concentra sulla prevenzione secondaria, con l’obiettivo di ridurre il rischio di reinfarto e morte improvvisa, controllare i sintomi residui e promuovere la riabilitazione funzionale. La terapia alla dimissione si basa su farmaci che hanno dimostrato di aumentare la sopravvivenza:
- ASA (acido acetilsalicilico): deve essere continuato a vita in tutti i pazienti, in assenza di controindicazioni;
- secondo antiaggregante (DAPT – doppia terapia antiaggregante): la durata della DAPT (ASA + inibitore P2Y12) è personalizzata in base al profilo di rischio emorragico del paziente, valutato con score come il PRECISE-DAPT:
- basso rischio emorragico: la DAPT è generalmente raccomandata per 12 mesi;
- alto rischio emorragico (PRECISE-DAPT score ≥25): si raccomanda una DAPT con ASA + Clopidogrel per 3 mesi, seguita dalla sola aspirina;
- altissimo rischio emorragico: si raccomanda una DAPT con ASA + Clopidogrel per 1 mese, seguita dal solo clopidogrel.
- beta-bloccanti: vanno iniziati non appena il paziente è stabile. Riducono il consumo miocardico di ossigeno, il rischio di aritmie ventricolari maligne e la mortalità;
- ACE-inibitori: sono fondamentali per prevenire il rimodellamento ventricolare sinistro, specialmente dopo un IMA anteriore;
- statine: devono essere prescritte a tutti i pazienti. La terapia prevede statine ad alta intensità, spesso in associazione con ezetimibe, con l’obiettivo di raggiungere un livello di colesterolo LDL <55 mg/dl. In caso di un secondo evento cardiovascolare entro 2 anni, l’obiettivo si abbassa a <40 mg/dl;
- anti-aldosteronici (spironolattone, eplerenone): riducono la mortalità nei pazienti con disfunzione ventricolare sinistra (frazione di eiezione ≤40%) e segni di scompenso cardiaco o diabete.
Oltre alla terapia farmacologica, è cruciale promuovere un percorso di riabilitazione cardiaca, l’astensione totale dal fumo e fornire supporto psicologico, dato che circa il 20% dei pazienti può sviluppare una sindrome ansioso-depressiva dopo l’evento acuto.
Complicanze post-infartuali
Le complicanze dell’infarto miocardico acuto possono insorgere precocemente o a distanza di tempo e sono classicamente suddivise in meccaniche, elettriche, emodinamiche e pericardiche. Un loro rapido riconoscimento e trattamento è fondamentale per migliorare la prognosi. Particolare attenzione va posta alla distinzione tra un vero aneurisma (parete ventricolare assottigliata ma integra) e uno pseudoaneurisma (rottura cardiaca contenuta), che rappresenta un’emergenza chirurgica.
Complicanze meccaniche
Sono eventi catastrofici, spesso associati a shock cardiogeno, che richiedono un intervento chirurgico urgente.
| Tipo di complicanza | Caratteristiche e diagnosi | Sintomatologia clinica | Terapia |
|---|---|---|---|
| Rottura della parete libera del cuore | Più comune in IMA anteriore, anziani, donne. L’ecocardiogramma è diagnostico. | Dissociazione elettromeccanica (attività elettrica senza polso), tamponamento cardiaco e morte quasi sempre imminente. | Chirurgia d’urgenza (patch). |
| Rottura del setto interventricolare | Crea uno shunt sinistro-destro. Diagnosticata con ecocardiogramma e cateterismo (salto ossimetrico nel ventricolo destro). | Insufficienza cardiaca grave con comparsa di un nuovo, rude soffio pansistolico. | Stabilizzazione con nitroprussiato e contropulsatore aortico, seguita da chirurgia correttiva. |
| Insufficienza mitralica acuta | Dovuta a disfunzione o rottura del muscolo papillare. L’ecocardiogramma è diagnostico. | Da lieve (soffio) a gravissima (edema polmonare acuto, shock cardiogeno). | In caso di rottura, chirurgia urgente. In attesa, contropulsatore aortico per ridurre il rigurgito. |
| Aneurisma ventricolare | Dilatazione sacciforme della parete infartuata. Diagnosticato con ECG (ST sopraslivellato persistente) ed ecocardiogramma. | Può causare insufficienza cardiaca, angina, aritmie ventricolari o embolismi sistemici da trombi murali. | Terapia medica; chirurgia considerata in casi selezionati. |
| Infarto del ventricolo destro | Associato all’IMA inferiore. Diagnosticato con ECG (sopraslivellamento in V3R-V4R) ed ecocardiogramma. | Insufficienza cardiaca destra: ipotensione, turgore giugulare, campi polmonari puliti. | Terapia basata sull’espansione volemica (fluidi endovenosi). Diuretici e nitrati sono controindicati. |
Complicanze elettriche (aritmie)
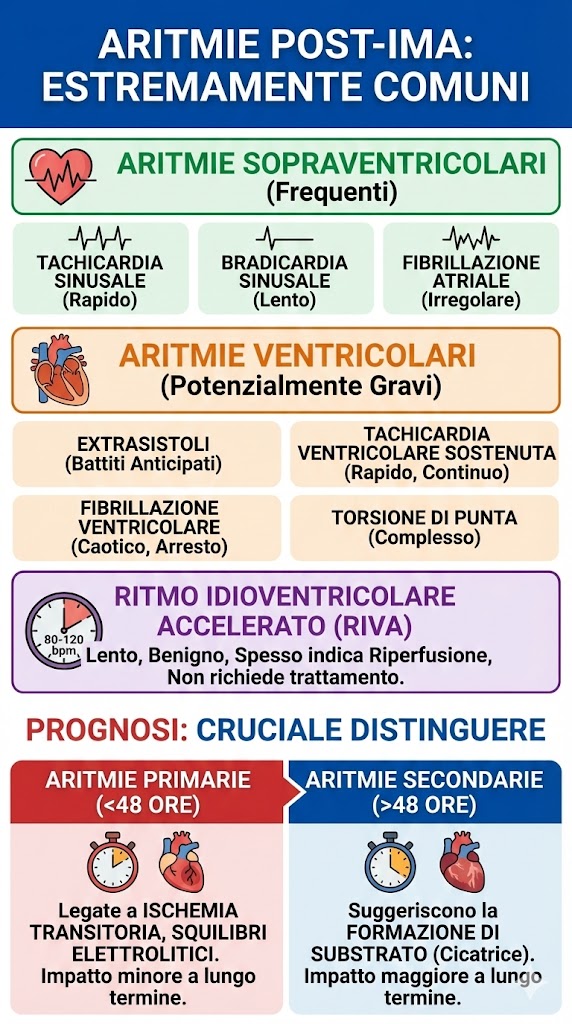
Le aritmie sono estremamente comuni dopo un IMA:
- aritmie sopraventricolari: tachicardia sinusale, bradicardia sinusale, fibrillazione atriale;
- aritmie ventricolari: extrasistoli, tachicardia ventricolare sostenuta, fibrillazione ventricolare, torsione di punta;
- ritmo idioventricolare accelerato (RIVA): ritmo ventricolare lento (80-120 bpm), tipicamente benigno, che spesso indica l’avvenuta riperfusione coronarica e non richiede trattamento.
Prognosticamente, è cruciale distinguere tra aritmie primarie (insorte entro le prime 48 ore) e secondarie (dopo 48 ore). Le prime sono spesso legate a ischemia transitoria e squilibri elettrolitici, avendo un impatto minore a lungo termine. Le seconde, invece, suggeriscono la formazione di un substrato aritmogeno stabile e cicatriziale, comportano una prognosi peggiore e rappresentano un’indicazione a valutare l’impianto di un defibrillatore (ICD).
Insufficienza ventricolare sinistra e shock cardiogeno
La necrosi miocardica riduce la capacità contrattile del cuore, portando a un’insufficienza ventricolare sinistra che può variare dalla lieve congestione polmonare (Killip II) allo shock cardiogeno (Killip IV), la causa più frequente di morte intra-ospedaliera. La gravità può essere valutata anche con la classificazione di Forrester, che utilizza parametri emodinamici. Il trattamento dello shock cardiogeno richiede un approccio aggressivo con supporto inotropo, eventuale contropulsatore aortico e, soprattutto, una rivascolarizzazione immediata con PCI.
Complicanze pericardiche
- Pericardite post-infartuale (epistenocardica): compare nella prima settimana, è più frequente negli IMA transmurali e si manifesta con dolore pericardico e sfregamenti;
- sindrome di Dressler: compare più tardivamente (dopo la prima settimana), ha una base autoimmune e si presenta con febbre, pericardite e pleurite.
Il trattamento per entrambe le condizioni si basa su ASA ad alte dosi o FANS. In caso di scarsa risposta, si può tentare con i glucocorticoidi. L’uso di anticoagulanti è controindicato per l’elevato rischio di emopericardio.
Fonte: Manuale di cardiologia, chirurgia vascolare e cardiochirurgia. Concorso Nazionale SSM.
Caricamento…